作者简介: 赵玉晓, 1987年生, 上海大学生命科学学院博士研究生 E-mail: 15821513643@126.com
癫痫是影响所有年龄段的慢性脑功能障碍, 主要特征为整个或局部脑区神经元异常同步化高频群集动作电位发放。 利用神经毒素海人藻酸(KA)立体定位注射入大鼠海马, 诱导大鼠产生癫痫持续状态, 建立颞叶癫痫大鼠模型。 应用同步辐射显微光谱和同步辐射显微光谱成像分析癫痫持续状态发作后24小时的颞叶癫痫大鼠海马角(CA)1区神经元生物化学分子的胞内浓度和分布是否改变。 结果显示反映蛋白质二级结构的酰胺Ⅰ在1 655 cm-1的振动频率和属于脂类功能集团的2 800~3 000 cm-1振动频率, 在正常对照大鼠海马CA1神经元胞体内呈高浓度分布, 但在癫痫大鼠海马CA1神经元胞体, 反映蛋白质二级内呈低浓度分布, 并且以细胞核分布浓度最低, 但在神经元胞体外围分布浓度相对较高。 属于核酸集团的1 055~1 054 cm-1 PO2反对称拉伸振动在正常和癫痫大鼠海马CA1神经元胞体内分布趋势没有差异, 都在胞体内呈高浓度分布, 尤其在细胞核分布浓度最高。 对属于酰胺Ⅰ的吸收频率进行二级导数分析显示癫痫海马神经元的酰胺Ⅰ相对于正常对照多出1个1 653 cm-1附近的负峰。 以上结果提示在发生癫痫持续发作后海马神经元生物化学分子的细胞分布会出现变化。
Epilepsy is a common chronic neurological disorder which is characterized by the occurrence of unprovoked and recurrent spontaneous seizures. Kainic acid (KA), a neurotoxin, was stereotaxically injected into the right hippocampus of rats to induce the post-status epilepticus (SE) model of temporal lobe epilepsy. Then the neurons in CA1 subregion of the hippocampus in the post-SE rats were detected by synchrotron radiation based-Fourier transform infrared microspectroscopy (SR-FTIR) at 24 hour after status epilepticus, determining the distribution and concentration of main biochemical molecules in the epileptic neurons. The infrared imaging of the biological molecules showed that the protein and lipid functional groups (bands at: 1 655 cm-1, 2 800~3 000 cm-1) were mainly localized in the cell body of the control CA1 neuron, whereas exhibited intracellular low concentration but high concentration in the region surrounding the cell body in the epileptic neurons of the hippocampal CA1 subregion. Moreover, the nucleic acid functional groups (bands at: 1 055~1 054 cm-1) were mainly located in the cell body of neurons in the control and epilepsy rats, and there was no significant difference in the distribution and concentration of the nucleic acid functional groups between the control and epileptic neurons. Additionally, the secondary derivative spectra for amide Ⅰ (assigned to 1 655 cm-1) in the CA1 neurons showed that there was an additional negative peak near 1 653 cm-1 in the epileptic hippocampus compared to the control neuron. These findings suggested that the disorders of biochemical composition in the hippocampal neurons in epilepsy rats emerge earlier than their morphological damages.
癫痫是影响所有年龄段的慢性脑功能障碍。 世界卫生组织的统计结果表明: 人群中患有癫痫的比例在4‰ ~10‰ 。 癫痫是一种由多病因所致的发作性疾病, 癫痫发生的主要特征为整个或局部脑区神经元异常同步化高频群集动作电位发放, 临床主要表现为肢体的强直痉挛[1, 2]。 近年来, 虽然精确的临床诊断技术不断提高, 对抗癫痫药的临床使用进行密集监控新的抗癫痫药不断地投入临床应用的情况下, 但仍有至少30%的癫痫病人的发作不能有效控制, 发展成为难治性或慢性癫痫[3]。
即使目前关于难治性癫痫的相关研究报道很多, 但其确切病理机制尚不明确。 经典的观点认为, 癫痫发生是一个过程, 发生进程分为三个阶段: 急性期: 脑损伤发生; 之后进入潜伏期: 在此阶段时期, 病人不出现癫痫发作; 最后进入慢性癫痫期即: 表现为未受任何刺激的情况下也会产生自发性惊厥发作。 在癫痫急性— 潜伏— 慢性期发展进程中, 发生许多生物学改变包括一系列分子、 细胞、 神经环路水平的变化, 最终出现大脑神经元异常同步化电发放[4, 5]。 揭示癫痫发展进程的生物化学分子变化, 有助于人们进一步了解癫痫的发病机制。
红外光谱可以通过对探测样品中所含化学分子成分的特征性振动模式来确定样品中化学分子空间分布信息和结构组成[6]。 在进行红外光谱检测时, 将显微镜和傅里叶变换红外光谱仪耦合, 从而在微小尺度进行测量。 在生物科学领域, 红外光谱可以原位检测生物组织细胞中的生物化学分子包括核酸、 脂类、 蛋白质和碳水化合物的含量、 分布, 尤其可以准确分析组织细胞中蛋白质二级结构的改变, 提供不同病理生理条件下细胞或组织中各种生物化学分子的结构、 分布和浓度[7, 8, 9, 10]。 与传统热红外光源相比, 同步辐射光源在中红外光区段比传统红外光源亮100~1 000倍。 同步辐射红外光谱显微成像技术(synchrotron radiation based-Fourier transform infrared microspectroscopy, SR-FTIR)能够在细胞水平对生物组织或细胞中包含的各种生物化学分子的代谢状态进行分析。 例如SR-FTIR显示阿尔兹海默氏症特征性病理改变老年斑中蛋白质构象β -sheet含量上升[8]。 本文通过将化学致癫药物海人藻酸(kainic acid, KA)立体定位注射入大鼠海马, 诱导大鼠发生癫痫持续状态, 建立癫痫大鼠模型。 对癫痫大鼠海马CA1区神经元进行同步辐射红外显微光谱测量和同步辐射显微光谱成像, 初步研究癫痫发生初期海马神经元是否存在胞内生化分子的分布和代谢改变。
实验用SPF级雄性SD(Sprague Dawley)大鼠由上海大学实验动物中心提供, 2~3月龄, 体重180~220 g, 正常环境饲养, 12 h光照/12 h黑暗, 自由进食, 经反复行为学实验确认无运动异常后进行实验。 使用6%水合氯醛(300 mg· kg-1, i.p)麻醉, 固定于大鼠立体定位仪(
1%戊巴比妥钠(100 mg· kg-1, i.p)将大鼠麻醉后, 4%多聚甲醛溶液对大鼠进行全身组织固定, 固定后取下大鼠全脑, 30%蔗糖梯度脱水后置冰冻切片机(Microm H525)对大鼠海马切片(15 μ m), 并将切片贴附于BaF2玻片。
相关同步辐射红外显微成像和显微光谱检测实验在合肥国家同步辐射实验室的红外谱学实验站进行。 红外显微光谱及红外显微成像通过傅里叶变换红外光谱仪(Bruker IFS 66v)耦合红外显微镜(Bruker Hyperion3000)采用透射模式收集, 通过512次重复累积进行光谱采集, 分辨率为4 cm-1, 并且将20 μ m× 20 μ m狭缝尺寸定位检测尺寸。 红外显微成像光斑大小为10 μ m× 10 μ m, 对正常大鼠和癫痫大鼠海马形态正常的神经元进行覆盖探测。 采用OPUS软件(5.5版本)采集和处理光谱测量和显微成像数据。
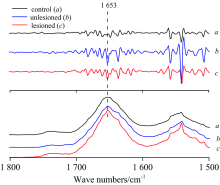
单侧海马注射致癫剂海人藻酸(kainic acid, KA)会导致大鼠注射侧大脑呈现同步化群集高频放电, 高兴奋性的神经元细胞内生物化学分子的结构、 浓度、 定位可能会出现变化。 图1(a)为KA注射癫痫大鼠和正常对照大鼠海马切片在可见光显微镜下的形态图。 图1(b)显示KA注射癫痫大鼠和正常对照大鼠的大脑海马CA1区神经元的同步辐射显微红外吸收光谱, 红外光斑面积大约可以覆盖单个神经元胞体。 图1(b)中红外光谱特征吸收峰所属功能基团振动模式指认见表1。 在表1中, 属于脂质基团的吸收区域集中在红外3 000~2 800和1 750~1 720 cm-1区段, 对这些区段的显微光谱进行分析能够判断脂类功能集团的浓度[7, 11]。 分析结果显示癫痫大鼠KA注射侧海马神经元胞体在属于CH2反对称拉伸振动的2 930 cm-1的积分吸收面积比正常大鼠海马神经元样增加了约9%。 位于1 655 cm-1附近的酰胺Ⅰ 和位于1 545 cm-1附近的酰胺Ⅱ 是构成蛋白质的主要成分, 其中位于1 655 cm-1附近的酰胺Ⅰ 对蛋白质的二级结构变化较敏感, 主要包含CO的拉伸振动, CN拉伸振动以及NH弯曲振动(图1, 表1)[12, 13]。 为进一步明晰酰胺Ⅰ 的光谱结构, 我们对1 655 cm-1的光谱区段进行了二级导数分析(图2)。 相对于正常大鼠海马样品, 癫痫大鼠KA注射侧海马神经元胞体的酰胺Ⅰ 在1 653 cm-1附近多出一个额外的负峰, 提示癫痫大鼠大脑高兴奋性放电活动可能会损伤神经元的蛋白质二级结构。 位于1 236 cm-1附近的的PO2反对称拉伸振动和位于1 086 cm-1附近的PO2对称拉伸振动能够反映核酸的浓度。 对红外显微光谱的分析显示癫痫大鼠KA注射侧海马神经元胞体在位于1 086 cm-1 PO2的吸收积分强度较正常大鼠显著下降。
| 表1 图1所示红外吸收光谱的各生化分子集团频率指认 Table 1 The bands frequencies assigned for the IR spectra shown by Fig.1 resource indicated in Fig.1 |
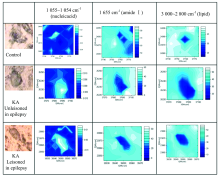
对于正常对照大鼠和癫痫大鼠海马CA1区神经元的主要生化分子在神经元胞体内的空间分布情况进行定位, 我们做了同步辐射红外光谱显微二维平面成像分析。 构建细胞显微成像的数据采集自代表性海马CA1神经元的红外显微光谱, 代表性海马CA1神经元的光学图像叠加区域见图3。 在对样品进行光栅扫描后, 对主要生化分子功能集团的积分强度进行计算。 图3为正常对照大鼠和癫痫大鼠海马KA未注射侧和KA注射侧CA1区代表性神经元的光学图像和主要生化分子功能集团的红外光谱显微成像图谱。 位于1 055~1 054 cm-1的PO2反对称拉伸振动属于核酸吸收区域, 因此主要位于神经元的细胞核区域[14]。 核酸如DNA也是胞内线粒体基因组的主要组成成分, 因此位于1 055~1 054 cm-1的振动频率也许反映出细胞核或线粒体内的核酸在神经元内的空间定位。 如图3显示在正常对照和癫痫海马神经元中在1 055~1 054 cm-1的振动频率最大浓度都位于细胞核和胞体中, 提示在癫痫高兴奋性放电活动发生24 h后神经元核酸分布没有变化。 反映蛋白质二级结构的酰胺Ⅰ 的吸收位于1 655 cm-1的振动频率附近[12, 13]。 同步辐射红外光谱显微二维平面成像显示1 655 cm-1的振动频率在正常对照大鼠海马CA1神经元胞体内呈高浓度, 但在癫痫大鼠海马KA未注射侧和KA注射侧CA1神经元胞体内呈低浓度分布, 在细胞核内分布浓度最低, 但在神经元胞体外围区域分布浓度较高。 提示在癫痫大鼠神经元内的蛋白二级结构异常, 这可能是癫痫发生过程中大脑海马神经元的陆续死亡的重要分子基础。 在2 800~3 000 cm-1区间主要为脂类的CH2和CH3拉伸振动。 同步辐射红外光谱显微二维平面成像显示2 800~3 000 cm-1振动频率在正常对照海马CA1神经元胞体内呈高浓度分布, 在癫痫海马KA未注射侧和KA注射侧CA1神经元呈现胞体内低浓度分布而胞体外区域高浓度分布的趋势。 由于细胞体膜和细胞器膜的主要成分为磷脂, 因此这种癫痫海马神经元的脂类功能集团分布改变可能与癫痫高兴奋性放电造成的细胞体膜和细胞器膜的结构和功能改变有关[15]。
同步辐射红外显微光谱检测和同步辐射红外显微成像初步研究癫痫大鼠海马CA1区神经元生物化学成分的结构和细胞内定位特异性变化。 实验结果显示相对于正常海马神经元, 癫痫大鼠神经元的蛋白质二级结构和脂类功能集团在胞内的分布出现改变, 表现为反应蛋白质二级结构的酰胺Ⅰ 和脂质在癫痫大鼠神经元胞体内呈低浓度分布, 但在神经元胞体周围分布相对较高。 表明癫痫大鼠高兴奋癫痫放电活动会改变神经元生物化学成分的结构和分布, 从而导致神经元损伤, 并且这些生化分子的改变早于细胞形态的改变。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|