作者简介: 吴 莹, 女, 1982年生, 江苏师范大学物理与电子工程学院 e-mail: wuying@jsnu.edu.cn
在食品和环境监测中, 大肠杆菌是一个重要指标细菌, 因此, 对大肠杆菌的监测和灭菌效果也引起了人们广泛的关注。 基于荧光光谱检测技术具有的灵敏度高、 速度快、 稳定性强等优点, 利用荧光光谱技术研究了大肠杆菌的发射峰强度与大肠杆菌浓度的内在变化规律, 得到了一种更加方便、 快捷、 监测浓度更低的大肠杆菌计数方法。 采用289 nm的激发光照射大肠杆菌水溶液, 得到大肠杆菌的荧光发射光谱; 改变大肠杆菌溶液的浓度, 得到不同浓度大肠杆菌溶液的荧光光谱, 并分析大肠杆菌特征峰强度与大肠杆菌浓度的关系。 在此基础上, 利用荧光光谱技术研究了银纳米颗粒对大肠杆菌荧光发射的影响, 分析了银纳米颗粒对大肠杆菌的灭菌效果, 结果表明: (1)当289 nm的激发光照射大肠杆菌水溶液时, 大肠杆菌分别在332和425 nm两处有明显的荧光特征峰; 荧光特征峰强度随着大肠杆菌浓度降低而降低; 当大肠杆菌浓度小于20%时, 332和425 nm处特征峰强度与大肠杆菌溶液的浓度均呈线性关系。 (2)当大肠杆菌水溶液中加入银纳米颗粒时, 在4个小时内, 银纳米颗粒的作用时间越长, 大肠杆菌的荧光特征峰越弱, 即灭菌率越高; 增加银纳米颗粒的浓度或者提高环境温度, 均可提高银纳米颗粒对大肠杆菌的灭菌率。 本文的研究结果对食品、 环境等中大肠杆菌的计数和灭菌研究有参考意义。
Escherichia coli (E. coli) is an important indicator bacteria in food and environmental monitoring, therefore, monitoring the number and sterilization effect of E. coli has attracted extensive attention. Based on many advantages of fluorescence spectroscopy, such as high sensitivity, high speed, strong stability and so on, the relationship between the concentration of E. coli and the intensity of E. coli emission peak is studied, and a method for monitoring the concentration of E. coli conveniently, and rapidly at low concentration is given. Namely, the emission spectrum of E. coli can be got by irradiating E. coli solution with 289 nm excitation light, then the fluorescence emission characteristics of E. coli solution with different concentrations are given, and the relationship between the intensity of characteristic peak of E. coli and the concentration of E. coli is analyzed. Besides, the effect of silver nanoparticles on the fluorescence emission of E. coli is studied by fluorescence spectroscopy, and the sterilization effect of silver nanoparticles on E. coli is analyzed. The results show that: (1) E. coli has obvious fluorescence characteristic peaks at 332 and 425 nm respectively, when the excitation light at 289nm irradiates the aqueous solution of E. coli. The intensity of fluorescence peak decreases with the decreasing of E. coli concentration. And when the concentration of E. coli is less than 20%, there is a linear relationship between the concentration of E. coli and the intensity of characteristic peak at 332 and 425 nm. (2) When silver nanoparticles are added to the solution of E. coli, within 4 hours, the longer the existence time of silver nanoparticles is, the weaker the fluorescence characteristic peak of E. coli is, which means that sterilizing rate increases with the increasing of the time. Increasing the amount of silver nanoparticles or increasing the ambient temperature, the sterilizing rate of E. coli can be improved. The results of this paper are useful for the enumeration and sterilization study of E. coli in food and environment.
大肠杆菌是无芽孢的原核生物, 通常寄居在人和动物的肠道内[1, 2]。 正常情况下, 大肠杆菌是人体的益生菌, 不仅能竞争性抵御致病菌的进攻, 而且能合成维生素B和K, 与人体互利共生。 20世纪中叶, 欧洲等国爆发出血性腹泻, Riley[3]等对病因调查后, 发现了致病性大肠杆菌O157:H7。 时至今日, 研究人员发现很多起食物中毒事件的源头都是致病性大肠杆菌[4, 5]。 因此, 有必要对大肠杆菌的生长进行监测, 因监测大肠杆菌的过程伴随着其自身的生长及衍生, 所以需要开发一种综合监测大肠杆菌浓度和生长曲线特征的方法。
纳米银颗粒具有安全、 高效、 无耐药性及广谱抗菌等特点, 可杀死数百种微生物, 是最新一代的天然抗菌剂[6, 7]。 如, 纳米银可以与细胞内的线粒体作用产生具有强氧化性的活性氧, 使其失去生物活性, 导致细胞凋亡[8]; 纳米银可以与细菌的细胞壁发生化学反应, 破坏菌体的细胞壁[9]; 纳米银可以降低伤口创面感染, 具有良好的止血效果[10]; 纳米银在心血管疾病中可以降低那些需要留置静脉针患者的感染率。 但是银纳米颗粒对大肠杆菌的灭菌效果还有待研究。
常用的测量大肠杆菌浓度的方法为微生物计数法, 这种方法既可以了解大肠杆菌的浓度, 也可以研究其生长特征, 但是传统的平板菌落计数法, 耗时长, 操作方法相对复杂[11]。 荧光光谱检测法具有灵敏度高、 速度快、 稳定性强等特点, 因此可以利用荧光光谱检测技术研究大肠杆菌的荧光特征, 进而研究纳米银对大肠杆菌的灭菌率。
FLS900型多功能型光谱仪(Edinburgh Instruments), 激发光光源为氙灯, 波长为289 nm, 发射光谱扫描范围为310~550 nm。 摇床(米欧, GS-20), 离心机(赛洛捷克)。
大肠杆菌(固体, ATCC25922标准菌株, 5 ℃保存), LB液体培养基[干粉, Tryptone(胰蛋白胨)], 柠檬酸钠(分析纯), 硝酸银(分析纯), 生理盐水, 和去离子水。
将0.02 g柠檬酸钠溶解于2 mL去离子水中, 待用。 将0.018 g硝酸银溶解于100 mL去离子水中, 加热至90 ℃后, 逐滴滴入已配好的柠檬酸钠溶液, 保持90 ℃, 30 min后冷却至室温, 得到均匀分布的、 平均半径约为28 nm的银纳米颗粒。
(1)一代大肠杆菌溶液配制: 在无菌环境中将0.024 g大肠杆菌菌种接种至2 mL配制好的无菌培养液中, 37 ℃环境下, 用摇床(120 r· min-1)震荡培养24 h, 然后放入离心机, 2 000 r· min-1离心10 min, 用无菌吸管吸除上层液体, 得到一代大肠杆菌溶液。
(2)二代大肠杆菌溶液配制: 将500 μ L一代大肠杆菌溶液, 加入50 mL无菌培养液中, 37 ℃环境下, 用摇床(120 r· min-1)震荡培养24 h, 得到二代大肠杆菌溶液。 取2 mL二代大肠杆菌溶液放入到4 mL离心管中, 在离心机中2 000 r· min-1离心10 min, 无菌吸管吸除上层液体, 加入4 mL生理盐水, 重复3次, 即制成所需的大肠杆菌溶液。
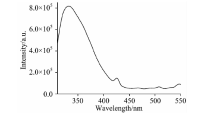
用289 nm的激发光照射配好的大肠杆菌溶液, 得到大肠杆菌的荧光光谱, 如图1所示。 从图中可以看出332 nm附近有一个非常宽的强发射峰, 425 nm附近有一个非常弱的发射峰。 通过查阅文献得知332 nm附近处的发射峰是由蛋白质中氨基酸的酪氨酸和色氨酸相互叠加产生的, 425 nm附近的发射峰是由核酸和NADH叠加产生的[12]。
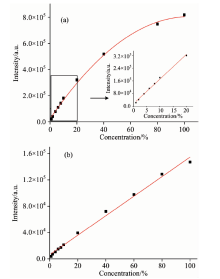
为了更好的研究大肠杆菌浓度与荧光发射强度之间的关系, 实验得到了11个不同浓度的大肠杆菌溶液的荧光光谱, 荧光光谱的形状与图1相似, 但峰值略有不同。 图2给出了332和425 nm处荧光特征峰的强度随大肠杆菌浓度变化的关系, 其中, (a)为332 nm的荧光特征峰强度随大肠杆菌浓度变化的关系, (b)为425 nm的荧光特征峰随大肠杆菌浓度变化的关系。 从图中可以看出, 随大肠杆菌浓度的增加, 332和425 nm处特征峰的强度也随之增大。
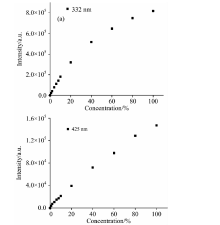 | 图2 大肠杆菌浓度与荧光特征峰强度的关系 (a): 332 nm; (b): 425 nmFig.2 Relationship between concentration of E. coli and fluorescence intensity (a): 332 nm; (b): 425 nm |
利用软件ORIGIN8.5对图2中的数据进行拟合, 得到大肠杆菌浓度和荧光强度间的关系曲线, 如图3所示。 图3(a)为大肠杆菌浓度在1%~100%之间变化时, 332 nm荧光特征峰强度随大肠杆菌浓度变化的曲线, 拟合公式为: y=20 709.33+15 107.26x-73.04x2, 相关系数r=0.996 94。 从拟合公式可以看出, 当大肠杆菌浓度较低时, 大肠杆菌的特征峰强度与浓度呈线性关系。 任取大肠杆菌的浓度为10%, 此时, x=10, y=20 709.33+151 072.6-7 304, 由此可见, 73.04x2对(a)的拟合公式的影响可以忽略不计。 当大肠杆菌浓度较高时, 大肠杆菌的特征峰强度与浓度呈非线性关系。 任取大肠杆菌的浓度为60%, 此时x=60, y=20 709.33+906 435.6-262 944, 此时73.04x2的数值不可忽略不计。 当大肠杆菌浓度在1%~20%区间变化时, 332 nm荧光特征峰强度随大肠杆菌浓度变化的曲线拟合公式可写为: y=11 430.92+15 726.03x, 相关系数r=0.995 09, 拟合公式所对应的曲线如图3(a)中的插图所示, 表明大肠杆菌浓度在1%~20%区间变化时, 大肠杆菌的特征峰强度与浓度呈线性关系。 图3(b)为大肠杆菌浓度在1%~100%之间变化时, 425 nm荧光特征峰强度随大肠杆菌浓度变化的曲线, 拟合公式为: y=4 766.41+1 484.09x, 相关系数r=0.993 73。 可以看出, 425 nm处峰值与大肠杆菌浓度整体呈线性关系。
根据朗伯-比耳吸收定律
式中, Ia为吸收的光量, ε 为摩尔吸光系数, l为液池的厚度, c为样品的摩尔浓度。 得出荧光发射强度If与入射光强度I0及荧光量子产率Φ 的关系
可知: 当荧光物质含量较低时, 荧光强度与物质的浓度成正比。 大肠杆菌浓度的大小与溶液中大肠杆菌活体的数量有关, 当大肠杆菌浓度较低时, 大肠杆菌溶液总的荧光强度可以看成由溶液中每个大肠杆菌个体发出的荧光叠加而成, 因此, 20%浓度以下大肠杆菌在332 nm处特征峰强度和425 nm处特征峰强度与大肠杆菌活体数量呈线性关系。 当大肠杆菌浓度增加到一定值以后, 即使大肠杆菌浓度继续增加, 在光斑照射范围以外的大肠杆菌无法直接接收光的照射, 且332 nm处的荧光特征峰是蛋白质中的氨基酸发射的, 蛋白质在细胞中含量较多, 荧光发射谱可能会受到大肠杆菌内蛋白质以外的其他物质的影响, 因此, 荧光强度与浓度间不再呈线性关系。 而发射425 nm荧光特征峰的是辅酶和酶类物质, 在细胞中存在的量很少, 荧光强度较弱, 当大肠杆菌浓度增加时, 荧光强度也随之增加, 但整体强度较低。
2.2.1 时间对银纳米颗粒灭菌的影响
取1 mL配制好的大肠杆菌溶液, 加入3 mL生理盐水, 确保大肠杆菌浓度低于20%。 记样品1, 作为空白对照组。 取1 mL配制好的大肠杆菌溶液, 加入2.5 mL生理盐水和0.5 mL银纳米颗粒溶液, 记样品2。
样品1和样品2各配制6份, 放置在37℃环境中, 每间隔1h测量一份样品1和样品2在310~550 nm范围内的荧光光谱。 两种样品中的大肠杆菌荧光光谱的形状与图1相似, 但峰值略有不同, 如图4所示。
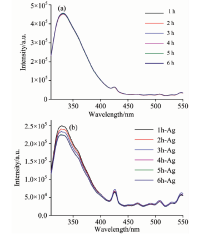 | 图4 (a)未加入银纳米颗粒的大肠杆菌荧光光谱; (b)加入银纳米颗粒的大肠杆菌荧光光谱Fig.4 (a) Fluorescence spectra of E. coli without silver nanoparticles; (b) Fluorescence spectra of E. coli with silver nanoparticles |
从图4(a)可以看出, 随着时间的延长, 332和425 nm处特征峰的强度变化不大。 从图4(b)可以看出, 加入银纳米颗粒后, 大肠杆菌在332 nm处的荧光特征峰强度随着时间的延长而逐渐降低, 而425 nm处特征峰的强度变化不大。
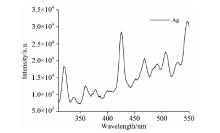
在图4(b)所给出的荧光光谱中, 溶液中不仅含有大肠杆菌, 而且含有一定量的银纳米颗粒, 因此, 有必要在图4(b)中去除银纳米颗粒的荧光光谱。 银纳米颗粒溶液的荧光光谱图如图5所示。 从图中可以看出, 银纳米颗粒溶液在321和425 nm处有发射峰, 将影响大肠杆菌在332和425 nm处特征峰的强度。 因此, 加入银纳米颗粒的大肠杆菌真实的荧光光谱I, 应该用加入银纳米颗粒的大肠杆菌的荧光强度I0, 减去银纳米颗粒的荧光强度In, 即 (I=I0-In)。
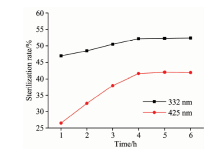
因为大肠杆菌浓度较低时, 其荧光特征峰的强度和大肠杆菌的浓度成正比, 因此, 可以用特征峰的强度表征大肠杆菌的浓度, 进而计算银纳米颗粒的灭菌率(%)=(Ie-I)/Ie, 其中Ie为大肠杆菌荧光强度, I为加入银纳米颗粒后大肠杆菌真实荧光强度。 图6给出了332和425 nm特征峰对应的银纳米颗粒的灭菌率随时间的变化, 从图6中可以看出: 银纳米颗粒溶液与大肠杆菌反应4 h内, 灭菌率与反应时间成正比; 4~6 h内, 灭菌率趋于平稳, 不再增长。 灭菌过程中大肠杆菌332 nm处的特征峰的强度变化比425 nm处的要大, 说明银纳米颗粒主要破坏蛋白质中的氨基酸, 而对核酸和NADH的破坏作用较小。
2.2.2 银纳米颗粒浓度及温度对灭菌的影响
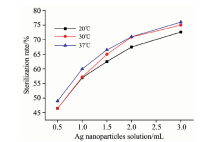
取1 mL配制好的大肠杆菌溶液, 分别加入0, 0.5, 1, 1.5, 2, 3 mL银纳米颗粒溶液, 和3, 2.5, 2., 1.5, 1, 0.5, 0 mL生理盐水, 配制方法如表1所示, 得到不同浓度的银纳米颗粒溶液, 其中样品1是空白对照组。
| 表1 不同浓度银纳米颗粒溶液实验样品配制表 Table 1 Sample preparation table with different concentrations of silver nanoparticles |
参照表1配制实验样品, 每个样品配制3份, 分别放置在20, 30和37 ℃环境下反应4 h, 然后按照样品编号逐一测量其在310~550 nm范围内的荧光光谱。 用332 nm处特征峰强度表征相应浓度的大肠杆菌, 灭菌率随银纳米颗粒加入量的变化关系如图7所示。 从图7 中可以看出, 银纳米颗粒的加入量及银纳米颗粒与大肠杆菌相互作用时的温度都对灭菌率有影响。 即随银纳米颗粒溶液加入量的增加, 灭菌效果也随之增大; 温度越高, 银纳米颗粒的灭菌率越大, 本实验中灭菌效果最好的是37 ℃。
生物体内有很多酶, 这些酶是功能型蛋白质, 参与细胞生命代谢活动, 催化细胞体内的各种生化反应, 是活细胞生命活动的必需物质。 有研究表明, 酶的活性与直接相关的氨基酸有关, 这些氨基酸被称为酶的活性中心。 酶活性中心实现催化作用的必需氨基酸基团, 主要包括: 羟基、 巯基、 咪唑基、 酚羟基、 氨基。 若通过化学修饰改变这些基团, 则酶活性丧失, 这将影响细胞正常生命活动, 致使细胞死亡。
银纳米颗粒遇到大肠杆菌后, 能吸附在细胞壁表面, 甚至穿过大肠杆菌细胞壁进入菌体, 与体内蛋白酶中半胱氨酸的巯基中的S离子结合, 使得巯基中的H离子游离出去, 改变了半胱氨酸的结构, 破坏了蛋白酶必需活性基团, 致使蛋白酶丧失活性, 从而使大肠杆菌的呼吸代谢被阻断, 最终窒息死亡。 在这个过程中, 引起了整个蛋白质的构象变化, 从而引起色氨酸、 酪氨酸的荧光光谱降低。
利用荧光光谱技术研究了大肠杆菌浓度在1%~100%区间内的发光特性, 以及银纳米颗粒对大肠杆菌的灭菌效果, 研究结果表明:
(1) 大肠杆菌在332和425 nm处有荧光特征峰。 大肠杆菌浓度低于20%时, 332 nm处特征峰强度与大肠杆菌浓度呈线性关系; 大肠杆菌浓度高于20%时, 332 nm处特征峰强度与大肠杆菌浓度呈非线性关系。 而425 nm处特征峰强度与大肠杆菌浓度整体呈线性关系。
(2) 银纳米颗粒对大肠杆菌有灭菌作用, 随银纳米颗粒与大肠杆菌作用时间的延长, 灭菌率持续增加, 但4 h后, 灭菌率几乎不再增加。
(3) 银纳米颗粒浓度越高, 灭菌率越高; 银纳米颗粒与大肠杆菌作用的环境温度越高, 灭菌率越高。
综上所述, 利用荧光法可以更加简单、 快速地对大肠杆菌计数, 进一步提高荧光法的应用范围。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|