作者简介: 杨露露, 女, 1991年生, 桂林理工大学化学与生物工程学院硕士研究生 e-mail: LLYang822@163.com
在模拟人体生理条件下, 采用分子模拟结合三维荧光、 圆二色谱、 荧光光谱、 时间分辨荧光等光谱方法, 研究了四溴联苯醚(BDE47)与溶菌酶的相互作用机制。 结果表明: BDE47能有效地猝灭溶菌酶的内源性荧光, 猝灭机制为静态猝灭。 分子对接显示, BDE47与溶菌酶分子中的TRP62, TRP63, ARG61, ASN59, ALA107和ILE98等氨基酸残基具有相互作用, 且BDE47分子中的醚键O原子与TRP63形成了氢键, 氢键距离为2.2 Å。 三维荧光的实验结果表明, BDE47的加入导致了溶菌酶的荧光强度降低, 峰位置发生略微红移, BDE47与溶菌酶之间的结合作用改变了溶菌酶的微环境。 圆二色谱分析则进一步证明, BDE47的存在引起了溶菌酶的构象发生改变, 导致α-螺旋结构的含量减少。 根据Föster非辐射能量转移理论计算得出, 供体(溶菌酶)与受体(BDE47)的结合距离 r为3.31 nm, 满足非辐射能量的条件。 分析四个温度下的热力学参数发现, BDE47与溶菌酶之间的结合是一个自发放热的过程, 主要驱动力为氢键和范德华力, 与分子对接、 结合自由能分析结论一致。
The binding of BDE47 to lysozyme was investigated by molecular modeling combined with three-dimensional (3D) fluorescence, circular dichroism (CD) techniques, fluorescence spectroscopy, and time-resolved fluorescence decay under simulative physiological conditions. The results indicated that the quenching reaction of BDE47 to lysozyme was observed, and the quenching mechanism was suggested as static quenching. Molecular docking showed that the amino acid residues, TRP62, TRP63, ARG61, ASN59, ALA107, ILE98 in lysozyme have interactions with BDE47. The hydrogen bonds were formed between the O atom of BDE47 and TRP62 with the distances of 2.2 Å. The 3D fluorescence experiments showed that the fluorescence intensity of lysozyme gradually decreased in the presence of BDE47 and a red shifted was observed, suggesting that the microenvironment around the TRP-residues of lysozyme has changed during the binding process. Furthermore, CD spectra implied that the interaction of BDE47 with lysozyme induced conformational change of lysozyme, and the content of α-helix structures in lysozyme decreased. The binding distance r between the donor (lysozyme) and acceptor (BDE47) calculated using Förster’s nonradiative energy transfer theory was 3.31 nm, indicating a high probability of energy transfer from lysozyme to BDE47. The thermodynamic parameters at different temperatures indicated that the hydrogen bonds and van der Waals forces played a predominant role in the spontaneous binding process. The results were consistent with the molecular docking and binding free energy analysis.
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是一系列含溴原子的芳香族化合物, 其同系物共有209种。 PBDEs在高温下分解产生还原性很强的溴原子, 它可以捕获燃烧过程中产生的· OH自由基和· O· 自由基, 生成水和活性较低的溴原子, 从而达到阻燃灭火的目的, 且PBDEs价格便宜, 因而被广泛应用于生产生活中[1]。 研究表明, PBDEs可随着食物链富集在生物体内, 对人体具有内分泌干扰毒性[2]、 发育神经毒性[3]和免疫毒性等[4]作用。 2, 2’ , 4, 4’ -四溴联苯醚(tetra-brominated diphenyl ethers, BDE47)是环境样品及生物组织中含量最高的PBDEs同系物之一, 主要蓄积于人体脂肪、 肝脏等组织中, 具有较强的生物毒性[5]。
溶菌酶是一种低分子量的球形蛋白质, 因其具有溶解细菌细胞壁的作用, 故命名为溶菌酶。 溶菌酶作为一种存在于人体正常体液及组织中的非特异性免疫因子, 能够与很多外源性、 内源性物质结合, 从而具有多种生理、 药理作用, 如抗菌、 抗病毒、 抗肿瘤等[6]。 长期以来, 溶菌酶一直被作为一种模型蛋白, 用于研究蛋白质的空间构象、 酶动力学以及分子进化与分子免疫间的关系[7]。 目前, 已有部分研究者在进行溶菌酶与药物[8, 9]、 染料[10, 11]、 纳米粒子[12, 13]等的相互作用研究, 但关于溶菌酶与污染物(如PBDEs)的相互作用研究甚少。 研究四溴联苯醚与溶菌酶的结合作用, 从而更好的了解污染物对生物体的毒理学效应, 这对于阐明多溴联苯醚的毒理作用机制具有重要的指导意义。
利用计算模拟研究了BDE47与溶菌酶的结合模式, 获得两者结合作用力的类型、 相互作用的氨基酸残基、 结合自由能等信息。 并结合荧光光谱、 荧光寿命和圆二色谱法对两者的作用机制及其溶菌酶的构象变化进行探究。
RF-5301PC型荧光光度计, Hitachi F-4600荧光光谱仪; JASCO-810圆二色光谱仪, FL3-P-TCSPC时间分辨荧光仪。
BDE47和鸡蛋清溶菌酶(分别购于美国AccuStandard、 Sigma公司), pH 7.40的Tris-HCl缓冲溶液(含0.15 mol· L-1 NaCl), 其他试剂为分析纯, 实验用水为二次蒸馏水。
用pH 7.40的Tris-HCl缓冲液配制浓度为5.0× 10-4 mol· L-1的溶菌酶贮备液和1.0× 10-6 mol· L-1的BDE47贮备液, 并置于4 ℃冰箱保存备用。
1.2.1 计算模拟
溶菌酶的晶体结构(1aki.pdb, 1.5 Å )从Brookhaven蛋白质数据库(http://www.rcsb.org/pdb)获得。 首先, 对溶菌酶进行除水、 加氢、 加电荷等前处理, 利用AutoDock 4.2将BDE47对接进入溶菌酶分子的活性口袋中。
将对接后的蛋白和小分子导入GROMACS 4.6.5程序中, 采用正则系统(NVT)和等温等压系统(NPT)平衡体系, 并进行50 ns的分子动力学模拟。 然后, 用分子力学泊松玻尔兹曼表面积(MM-PBSA)方法计算分析溶菌酶与BDE47之间的结合自由能[14, 15]。
1.2.2 光谱法
荧光光谱: 在291, 298, 306和310 K 4个温度下, 以280 nm为激发波长, 激发和发射狭缝宽度均为5.0 nm, 测定溶菌酶-BDE47体系在290~450 nm范围内的荧光光谱。
三维荧光: 激发波长和发射波长均设为200~500 nm, 步长和狭缝分别为5和2.5 nm, 测定溶菌酶与溶菌酶-BDE47体系的三维荧光光谱。
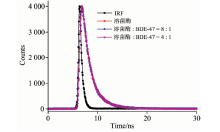
时间分辨荧光: 激发和发射波长分别为280和346 nm, 激发和发射狭缝均为6 nm, 计数峰值counts为4 000, 记录溶菌酶荧光寿命的变化。
圆二色谱: 用Tris-HCl缓冲液做基线校正, 扫描速度为200 nm· min-1, 响应时间为2 s, 在波长为190~260 nm范围内扫描样品液的圆二色谱。
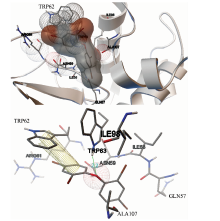
利用分子对接软件AutoDock 4.2将小分子BDE47对接进入溶菌酶的活性口袋, 得到10种构象。 10种构象的对接结果均表明, 溶菌酶与BDE47结合的主要作用力为范德华力和氢键, 而静电作用能非常小, 可忽略不计。 选取结合自由能较低的一种构象进行分析, 如图1。 溶菌酶中与BDE47发生相互作用的氨基酸残基有: TRP62, TRP63, ARG61, ASN59, ALA107, ILE98和ILE58等, 其中, TRP62和TRP63距离BDE47非常近, 相互作用较强。 另外, 可以观察到BDE47与色氨酸(TRP62)的苯环、 吲哚环部分基本平行, 存在着错位面对面堆积作用(即F型堆积作用); BDE47分子中的醚键O原子与TRP63形成氢键, 氢键距离为2.2 Å 。 氢键的形成和F型堆积作用在一定程度上对BDE47与溶菌酶结合起到了稳定的作用, 结合位点更靠近TRP62和TRP63。
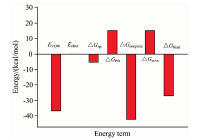
50 ns的动力学模拟结束后, 选取平衡后30~50 ns的模拟轨迹对溶菌酶与BDE47之间的结合自由能进行分析, 结果如图2。 用MM-PBSA方法计算得到的结合自由能为-27.10 kJ· mol-1。 体系的范德华相互作用能Δ GvdW为负(-36.81 kJ· mol-1), 且绝对值比其他能量项大很多, 表明Δ GvdW有利于溶菌酶与BDE47的结合作用, 范德华作用为主要驱动力。 体系的静电相互作用能Δ Gelect虽然也利于两者的结合, 但非常弱, 极性的静电溶剂化能很大程度上抵消了这种趋势(体系的极性化能高达15.22 kJ· mol-1), 这表明极性溶剂化自由能对结合是极为不利的[16]。
2.3.1 三维荧光
蛋白质一般含有色氨酸、 酪氨酸、 苯丙氨酸这三种芳香氨基酸, 因此能发射荧光。 常用三维荧光来分析药物小分子对溶菌酶的构象和微环境的影响。 图3中, 加入BDE47后, 体系的瑞利散射峰(λ ex=λ em)增强, 这可能是由于溶菌酶与BDE47生成复合物, 导致溶液中溶质粒径增大, 散射效应增强[17]。 峰1是色氨酸、 酪氨酸等残基的特征峰, BDE47的加入使溶菌酶的荧光强度降低, 色氨酸的微环境发生改变。 峰2是溶菌酶多肽骨架的特征峰, 加入BDE47后, 峰2的强度降低, 并且其发射波长发生略微红移(5 nm), 这表明BDE47的存在导致了溶菌酶的构象发生改变[18]。
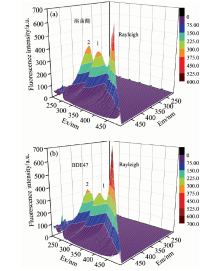 | 图3 溶菌酶(a)与溶菌酶-BDE47(b)体系的三维荧光光谱Fig.3 Three-dimensional fluorescence spectra of lysozyme (a) and lysozyme-BDE47 (b) systems clysozyme=2.0× 10-6 mol· L-1, cBDE47=5.0× 10-7 mol· L-1 |
2.3.2 圆二色谱
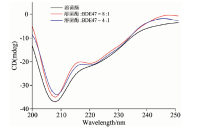
为了进一步验证溶菌酶的构象发生变化, 采用圆二色谱对溶菌酶的二级结构含量进行定量分析。 溶菌酶的圆二色谱在208和222 nm附近有两个负峰, 这是α -螺旋的光谱特征[9]。 如图4, 加入BDE47后, 谱图中负峰的强度减弱。 根据式(1)和式(2)[19]计算溶菌酶中α -螺旋的含量, 结果显示, 蛋白的α -螺旋含量从35.8%减少到33.1%和31.6%, 这表明BDE47与溶菌酶的相互作用改变了溶菌酶的二级结构, 导致其α -螺旋含量减少。
式中, cp为蛋白质的摩尔浓度, n为氨基酸残基数(溶菌酶为129), l为样品池的厚度(0.1 cm); MRE208是蛋白质在208 nm处的平均残基椭圆率(deg· cm2· dmol-1), 4 000是螺旋和无规则卷曲在208 nm处的平均残基椭圆率, 33 000是纯螺旋结构在208 nm处的平均残基椭圆率。
2.4.1 溶菌酶的荧光猝灭机制
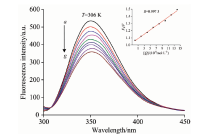
溶菌酶分子中含有6个色氨酸残基, 其中TRP62和TRP108是溶菌酶主要的荧光苯团之一, 最大荧光发射波长分别为352和342 nm。 如图5, 随着BDE47的加入, 溶菌酶的荧光强度逐渐降低, 但峰型基本保持不变, 表明BDE47与溶菌酶发生了相互作用, 改变了TRP62附近的微环境, 导致荧光猝灭。
蛋白质的荧光猝灭通常有动态猝灭、 静态猝灭及非辐射能量转移三种。 而时间分辨荧光是区分动态猝灭和静态猝灭最准确的方法。 静态猝灭过程中, 猝灭剂的加入, 荧光分子激发态等寿命并不会改变; 而在动态猝灭中, 猝灭剂的存在可引起溶菌酶荧光寿命的缩短[20]。 图6为加入BDE47前后溶菌酶的荧光寿命衰减曲线, 双指数拟合结果列于表1。 加入BDE47后, 溶菌酶的平均寿命由1.72 s变到1.77和1.78 s, 荧光寿命有微小的增加, 表明溶菌酶与BDE47发生相互作用, 改变了溶菌酶TRP的微环境。 但变化不大, 由此可认为BDE47对溶菌酶的荧光猝灭是一个静态猝灭过程。
| 表1 加入BDE47后溶菌酶的荧光寿命变化 Table 1 Fluorescence lifetime of lysozyme as a function of concentration of BDE47 |
2.4.2 溶菌酶与BDE47的结合距离
小分子与溶菌酶相互作用的结合距离可根据Fö ster偶极-偶极非辐射能量转移理论计算[10]。 图7为溶菌酶的荧光光谱与BDE47的紫外吸收光谱的重叠图谱。
式(3)— 式(5)中K2=2/3; N=1.36为介质折射指数; Φ =0.15为给体的荧光量子产率; J为给体的荧光发射光谱与受体的吸收光谱间的重叠积分, R0是转移效率为50%时的临界距离; r为给体与受体的结合距离。
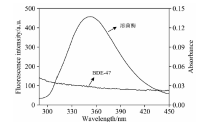 | 图7 溶菌酶荧光光谱和BDE47吸收光谱的重叠图Fig.7 The overlap of lysozyme fluorescence and BDE47 absorbance spectra clysozyme=cBDE47=5.0× 10-7 mol· L-1 |
根据式(3)— 式(5)计算得出, 两光谱重叠区的重叠积分J=5.12× 10-14 cm3· L· mol-1, 能量转移效率E=0.13, R0和r分别为3.31和4.55 nm。 BDE47与溶菌酶的结合距离r小于7 nm, 且满足0.5R0< r< 1.5R0, 符合非辐射能量转移的条件, 表明非辐射能量转移是导致溶菌酶荧光猝灭的另一个原因。 此外, MD的计算结果显示, BDE47与TRP62之间的距离为2.03 nm, 小于7 nm, 与能量转移结论一致。
2.4.3 溶菌酶与BDE47结合的作用力类型
小分子-受体相互作用力的类型包括范德华力、 疏水作用力、 静电引力和氢键等。 根据Ross和Subramanian理论[21], 由热力学参数可判断其结合作用力类型。 由实验计算得出的自由能值与上述计算模拟获得的结合自由能(-27.10 kJ· mol-1)吻合良好。 由表2可知, 291~310 K时, 该体系中Δ G< 0, Δ H< 0, Δ S< 0, 说明BDE47与溶菌酶之间的结合是一个自发放热的过程, 二者结合的作用力类型为氢键和范德华力[9]。 这与分子对接、 结合自由能分析的结论一致, 表明了计算模拟的准确性。
| 表2 不同温度下BDE47与溶菌酶相互作用的热力学常数 Table 2 The thermodynamic parameters of BDE47-lysozyme interaction at different temperatures |
利用分子模拟、 结合自由能分析以及光谱法研究了溶菌酶与BDE47的作用机制。 由荧光光谱和时间分辨荧光可知, BDE47使溶菌酶的荧光发生猝灭, 猝灭机制为静态猝灭, 且伴随着非辐射能量转移。 三维荧光光谱表明, BDE47能与溶菌酶生成复合物, 导致溶菌酶的微环境及构象发生改变, 这与圆二色谱分析一致。 根据热力学参数分析, 溶菌酶与BDE47结合的主要作用力为范德华力与氢键。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|