作者简介: 张静宜, 1995年生, 浙江理工大学机械与自动控制学院本科生,e-mail: 510334258@qq.com
农作物生长发育过程中经常会遭到病虫害等外界因素侵染, 如果不能实施有效的监测诊断和科学的防治, 极易引起农药喷洒不当或过量, 不仅会影响作物的产量和种植户的经济效益, 还会造成严重的环境污染。 近年在广西大棚厚皮甜瓜上发生了一种严重的由瓜类尾孢( Cercospora citrullina)引起的甜瓜叶斑病, 导致甜瓜减产和种植户的经济损失。 故此应用高光谱成像开展甜瓜叶片的尾孢叶斑病检测, 获取健康甜瓜叶片和受瓜类尾孢感染的具有不同病变程度的甜瓜叶片在380~1 000和900~1 700 nm的高光谱图像, 选取感兴趣区域并获取相应的平均光谱反射率, 比较发现健康叶片和不同病变程度叶片染病区域的平均反射率差异显著。 在540 nm处附近, 健康叶片和病变程度轻微的叶片的光谱具备波峰形态, 随着病变程度增加, 波峰逐渐消失; 在700~750 nm处附近, 叶片反射率曲线急剧上升, 出现绿色植物光谱曲线显著的“红边效应”特征; 750~900 nm范围, 健康叶片与轻微病变区域的光谱反射率变化趋于平稳, 而其他病变区域的反射率呈上升趋势, 且健康叶片的反射率高于病变区域, 反射率随病变程度增加而下降, 这一变化规律一直持续到近红外波段的900~1 350 nm范围。 运用主成分分析、 最小噪声分离法观察叶片早期病变的特征, 经主成分分析和最小噪声分离法处理后, 特别是对于早期病变, 样本受感染后发病的区域更为明显。 基于高光谱图像提取的前三个主成分得分绘制三维散点图, 虽然不同病变程度的部分样本有重叠, 但病变样本与健康样本的分布区分明显。 应用K-近邻法和支持向量机方法建立叶片病变判别模型, 结果显示: KNN模型对健康样本测试集判别率为98.7%, 病变样本的判别率随病变程度加重而逐渐升高; 对病变程度较轻样本, 支持向量机模型相比于KNN模型而言, 判别正确率更高、 分类效果更好; 总体上, 高光谱图像对健康样本的判别率较高(>97%), 可用于健康样本与病变样本的识别, 但对不同病变程度的区分效果欠佳。 研究结果表明, 高光谱成像可用于甜瓜尾孢叶斑病的检测, 对不同病变程度的区分效果仍有待提高。
During crop growth, it is often infected by external factors such as pests and diseases. If effective monitoring, diagnosis and scientific control can’t be carried out, it will easily leds to improper or excessive spraying of pesticides. It will not only affect the yield of crops and the economic benefits of farmers, but also cause serious environmental pollution. In recent years, a serious muskmelon leaf spot caused by Cercospora citrullina occurred in Guangxi, which leads to yield reduction and economic losses. In this study, hyperspectral imaging technology was used to detect muskmelon Cercospora leaf spot. Hyperspectral images of healthy leaves and diseased leaves with varying degrees of lesionwere collected at 380~1 000 and 900~1 700 nm. Regions of interest were selected and the corresponding average reflectances spectra was obtained. It was found that the mean reflectance of healthy leaves and the diseased leaves were significantly different and changed regularly according to the degree of lesion. Near 540 nm, the spectra of healthy leaf and leaf with slight lesion had a peak, which disappeared gradually with the increase of lesion degree. In 700~750 nm, the leaf reflectance curve increased sharply, and there was a significant “red edge effect” of green plant spectral curve. In the range of 750~900 nm, the reflectance spectra of healthy leaves and leaves with mild lesions changed steadily. The reflectance of healthy leaves was higher than that of the lesion area. The reflectance decreased with the increase of lesion degree. And this change regularity lasted until 900~1350 nm in the near infrared region. Principal component analysis (PCA) and minimal noise fraction (MNF) were used to observe the characteristics of early leaf lesions. After pretreated with PCA and MNF, the area of infection was more obvious, especially for early lesions. Three-dimensional scatter plot was drawn based on the scores of the first three principal components extracted from hyperspectral images. Although some samples with different degrees of lesion overlap, the distribution of lesion samples and healthy samples is distinct. K-nearest neighbor (KNN) method and support vector machine (SVM) were used to establish the discriminant models. The correctness of KNN model for healthy sample discrimination in the test set was 98.7%. And the discriminant rate of lesion samples increases with the severity of lesion. For the lighter lesion samples, SVM model has higher discriminant accuracy and better classification effect than KNN model. Generally, hyperspectral images had a high discriminant rate (>97%) for healthy samples and lesion samples, however, the discrimination of different lesion degrees is not good enough. It can be concluded that hyperspectral imaging technology can be used to detect muskmelon Cercospora leaf spot disease, but the discrimination of different lesion degrees still needs to be improved in the future.
在农作物的生长和发育过程中, 经常会遭到病虫害等外界因素侵染, 如果不能实施有效的监测诊断和科学的防治, 极易引起农药喷洒不当或过量[1], 不仅会影响作物的产量和种植户的经济效益, 还会造成严重的环境污染。
传统检测植物叶片病变的方法主要有人工感官诊断和理化实验检测, 人工感官诊断法精度较低、 费时费力, 而理化检测的步骤繁琐、 破坏性强、 时效性差[2]。 光谱能够实现植物病变的检测和识别, 如: 饶敏等[3]研究了柑桔黄龙病的可见-近红外光谱特征, 并结合偏最小二乘-线性判别分析方法(PLS-DA)对健康及染病样本进行判定, 准确度接近100%; 李小龙等[4]开展了基于近红外光谱的小麦条锈病严重度分级识别研究, 依据发病程度不同分为9个等级, 识别准确率大于95%。 但光谱检测获取的空间信息少, 无法展现病变在空间的差异, 也无法实现病变分布或程度的可视化表达。
高光谱成像结合了光谱和图像分析的优点[5], 可以获得如光谱、 形状、 颜色和纹理信息等许多不同的特征, 在检测植物病变的研究中展现出了巨大的优势与潜力[6]。 近年来, 国内外学者采用高光谱成像对植物叶片病变或虫害等进行检测, 如健康和患病棕榈的判别[7]、 柑桔溃疡病大小的估算[8]、 病害油菜的分类[9]、 番茄叶片疫病鉴别[10, 11]、 茄子叶片枯萎病的识别[12]等, 均取得了良好的检测效果。
甜瓜是一种广受大众喜爱的水果, 甜瓜叶斑病会严重影响甜瓜的产量和瓜农的收益。 国内外已报道能引起甜瓜叶斑病的病原菌有很多种, 包括瓜链格孢(Alternaria cucumerina)[13]、 交链格孢(A. alternata)[14]和多主棒孢霉(Corynespora cassiicola)[15]等。 近年在广西大棚厚皮甜瓜上发生一种严重的叶斑病, 叶云峰[16]等将该病的病原菌鉴定为瓜类尾孢(C. citrullina), 同时将该病害定名为甜瓜尾孢叶斑病。 本研究采用高光谱成像技术开展甜瓜尾孢叶斑病早期病变的检测研究, 应用化学计量学方法建立不同病变程度的判别模型。
从生长健壮的甜瓜植株上部剪取10片健康叶片, 用无菌水冲洗干净, 叶片茎部切口处用湿润的脱脂棉包裹, 避光冷藏快速运输至实验室。 叶片送到实验室后先分组编号: 第一组的两片瓜叶样本为健康叶片对照组; 第二组的两片瓜叶样本为局部区域针刺叶片对照组; 第三组的六片瓜叶为实验组。 两个对照组叶片不接种菌, 实验组样本分别用灭菌接种针在健康叶片上的每个接种点针刺3下, 在伤口处滴半滴无菌水, 然后从28 ℃黑暗培养15 d以上的瓜类尾孢病菌菌落上切取菌丝块(5 mm× 5 mm), 将长菌丝的一面贴于针刺伤口处, 每片瓜叶接种3个菌丝块。 将实验组和对照叶片置于培养箱内28 ℃下12 h光暗交替保湿培养。
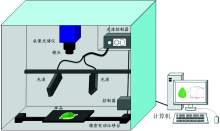
用图1所示的高光谱成像系统获取甜瓜叶片样本的高光谱图像信息。 该系统主要包括光谱仪(Imspector N17E, 900~1 700 nm; Imspector V10E, 400~900 nm)(Spectral Imaging Ltd., Oulu, Finland), 一台具有320× 256像素的InGaAs焦平面阵列(FPA)相机(Xenics, Model Xeva-1.7-320, Leuven, Belgium), 一台14位的1 600× 1 200像素的CCD相机 (B1410, IMPERX Inc., Florida, USA), 摄像机镜头(S31/f2.0, 061210, Spectral Imaging Ltd., Oulu, Finland; OLE23, Schneider, Germany), 两个150 W卤素灯线光源(3900, Illumination Technologies Inc., New York, USA), 由步进电机(IRCP0076-1COMB, Isuzu Optics Corp., Taiwan, China)驱动的样品台和配备数据采集软件(Spectral Image software, Isuzu Optics Corp., Taiwan, China)的计算机。
高光谱图像采集前, 先调整采集参数, 确保采集到的图像完整清晰且不变形, 主要参数设置如下: 相机的曝光时间为25 ms、 位移台速度7.3 mm· s-1。 采集样本图像前先进行黑白场校正, 消除光照强度变化对成像的影响, 白参比选用反射率为99%的聚四氟乙烯板, 暗场采集时关掉光源并盖上镜头盖。 第三组瓜叶接种瓜类尾孢病菌前, 先采集所有健康叶片的高光谱图像, 叶片正面朝相机, 然后进行上述的针刺和接种处理, 之后每隔24 h采集叶片的高光谱图像。
从光谱图像分析和建模判别两方面对采集到的高光谱图像展开分析, 研究高光谱成像技术对甜瓜尾孢叶斑病检测的可行性和有效性。 通过提取瓜叶样本高光谱图像的主成分(principal component, PC), 分析健康和染病的叶片的差异; 应用最小噪声分离法(minimum noise fraction, MNF)对高光谱图像数据进行特征优选, 进一步消除噪声的影响; 最后采取K-近邻法(k-nearest neighbor, KNN)和支持向量机(support vector machine, SVM)两种分类方法建立叶片病变程度的判别模型。 高光谱数据处理和建模主要采用ENVI 4.8(ITT, Visual Information Solutions, Boulder, Colorado, USA)和Matlab(R2016aThe MathWorks Inc., 美国)等软件。
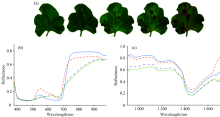
图2所示为健康叶片和不同病变程度(分别为接菌后第3, 4, 5和6天)叶片染病区域的平均光谱信息, 由图可知: 健康叶片和不同病变程度叶片染病区域的平均反射率差异明显。 在540 nm处附近的叶绿素吸收作用较小, 健康叶片和病变程度轻微的区域的光谱呈现波峰形态, 随着病变程度增加, 波峰逐渐消失; 在700~750 nm处附近, 叶片反射率曲线急剧上升, 这是绿色植物光谱曲线显著的“ 红边效应” 特征; 750~900 nm范围, 健康叶片与病变区域的反射光谱、 差异显著, 健康叶片与轻微病变区域的光谱反射率变化趋于平稳, 而其他病变区域的反射率在该范围呈上升变化趋势, 且健康叶片的反射率高于病变区域, 反射率随病变程度增加而下降, 这一变化规律一直持续到近红外波段的900~1 350 nm范围, 910, 960和1 120 nm等波段是水、 氧的窄吸收带[12]; 1 350 nm之后, 健康叶片和病变叶片的光谱不再呈现明显的变化规律。 总体而言, 甜瓜叶片的光谱在叶绿素、 水分等特殊吸收波段都表现出与其他绿色植物叶片类似的特征[17], 且在750~1 350 nm波长范围, 健康叶片和不同程度病变叶片的变化非常规律, 由此可见, 基于甜瓜叶片光谱特征进行甜瓜尾孢叶斑病的检测分析是可行的。
使用主成分分析(principal component analysis, PCA)对采集到的高光谱图像光谱数据降维。 图3为受瓜类尾孢感染的甜瓜叶片高光谱图像(380~1 000 nm)的前三个主成分图(PC1, PC2和PC3)。 比较前三个主成分图像可见: PC2中样本受感染后发病的区域更为明显也更易提取病变区域的光谱信息。
为进一步区分健康叶片和病变叶片, 选择叶片健康区域和四种不同病变程度的病斑区域共计90个样本, 使用PCA对样本数据进行处理, 基于前三个主成分得分绘制三维散点图, 如图4所示, 虽然不同病变程度的部分样本有重叠, 但病变样本与健康样本的分布区分十分的明显。 大多数病变程度较轻的样本(如接菌后2~3 d初发病阶段难以用肉眼观测)经PCA分析可以被较好地区分识别, 结合图3中病变程度1的主成分图像可知, PCA方法可用于甜瓜尾孢叶斑病的病变早期识别, 有利于实施有效的作物病变监测诊断和科学的防治。
图5为甜瓜叶片样本高光谱图像(380~1 000 nm)进行最小噪声分离法(MNF)变换后的图像。 选择MNF变换后前三个分量组成的RGB彩色图像, 比起肉眼观测的图像被感染的病斑区域颜色较其他未种菌的区域更为鲜艳, 而且病斑中心区域病变越严重颜色越深, 更为直观。 对原始图像数据进行了特征优选, 进一步消除了噪声的影响。
用140个样本的高光谱数据(380~1 000 nm)建立甜瓜叶片病变程度判别模型, 其中90个样本为训练集, 50个样本为测试集。 样本集分为健康叶片和四种不同病变程度叶片共5种类型, 采取K-近邻法(KNN)和支持向量机(SVM)两种分类方式建立叶片病变判别模型。 其中, 样本的病变程度由轻微到严重依次为: 病变程度1、 病变程度2、 病变程度3、 病变程度4(分别对应接菌后的第3, 4, 5和6天)。 将经过预处理以及特征波长提取分析的90个样本叶片高光谱数据作为KNN与SVM模型的输入构建叶片不同病变程度的判别模型, 然后利用测试集内的50个样本数据对模型进行验证。
病变程度判别结果见表1, KNN模型对健康样本测试集判别率为98.7%、 对病变程度最轻的样本判别率为56.7%, 随病变程度加重, 病变样本的判别率逐渐升高。 支持向量机模型的判别结果相比于KNN模型而言, 对病变程度较轻样本的判别正确率更高、 分类效果更好。 总体上, 高光谱图像对健康样本的判别率较高, 可用于健康样本与病变样本的识别, 但对不同病变程度的区分结果欠佳, 可能是由于叶片的病变程度与时间并不是呈绝对的线性关系, 某些不同天数的样本叶片感染区域之间症状较为相似。
| 表1 叶片病变程度的KNN和SVM判别分析结果 Table 1 Results of the KNN and SVM models for leaves lesion degrees discrimination |
基于高光谱成像研究了受瓜类尾孢侵染的甜瓜叶片的光谱图像特征, 研究发现健康叶片与病变叶片的光谱具有显著差异, 且不同程度病变叶片的光谱也具有明显变化趋势。 比较甜瓜叶片的高光谱图像的前三个主成分图像发现, PC2图像中叶片病变区域更为明显也更易提取病变区域的光谱信息, 高光谱图像进行最小噪声分离法变换后病变区域区分也更显著。 建立的基于K-近邻法和拽持向量机方法的判别模型结果显示, 高光谱图像对健康样本的判别率较高(> 97%), 可用于健康样本与病变样本的识别, 但对不同病变程度的区分效果欠佳。 研究结果表明, 高光谱成像可用于植物病变的检测, 但对不同病变程度的区分效果仍有待提高, 今后可从光谱图像预处理、 有效光谱波长筛选、 建模方法优选等方面加以改进, 以提高检测精度。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|