作者简介: 宋凡浩, 1991年生, 中国环境科学研究院和北京师范大学博士研究生 e-mail: songfh@craes.org.cn
利用同步荧光光谱(SFS)结合二维相关光谱(2D COS)和修正Stern-Volmer模型探究了森林土壤富里酸(FA)亚组分的质子键合多相性。 利用XAD-8吸附树脂结合Na4P2O7缓冲溶液逐步洗脱方法成功将土壤FA分级为异质性低的FA亚组分(FA3-FA13)。 FA3-FA13含有类蛋白(类酪氨酸和类色氨酸)、 类富里酸和类腐殖酸组分, 且FA7-FA13比FA3和FA5含有更多含量的类蛋白组分。 FA3-FA13中不同荧光组分的光谱峰强受溶液碱性pH值变化的影响较为明显。 FA3-FA13的2D COS同步和异步相关谱图中自峰和交叉峰的复杂分布与荧光组分的质子键合多相性有关。 FA5-FA13中类蛋白、 类富里酸和类腐殖酸组分因pH值变量扰动而产生的光谱变化方向相同。 在碱性pH值条件下, 修正Stern-Volmer模型定量拟合FA3-FA13中荧光组分的解离常数(p Ka值), 其中类酪氨酸、 类色氨酸、 类富里酸和类腐殖酸的p Ka值范围分别为6.11, 8.93~10.12, 9.32~10.65和9.70~10.63( R>0.854)。 FA3中类酪氨酸组分的低p Ka值(6.11)表明类酪氨酸组分含有更多含量的芳香族结构和相邻酚基官能团。 FA3-FA13中类色氨酸、 类富里酸和类腐殖酸组分的相似p Ka值(8.93~10.65)与羟基苯和氨基酸的p Ka值(8.0~12.02)相近, 表明类色氨酸、 类富里酸和类腐殖酸组分具有相似的质子亲和力, 且酚基官能团和氨基酸组分在其质子键合过程中起主要作用。 FA3-FA13中特定波长处荧光组分的波长连续变化顺序与其p Ka值递增趋势相一致, 且质子结合位点的多相性特征同时存在于FA亚组分的不同荧光组分间和相同荧光组分内。 FA3中特定波长处类酪氨酸和类色氨酸组分的p Ka值(6.11~9.16)小于类腐殖酸组分(9.70~9.97), 且荧光组分的递增趋势与波长连续变化的顺序(250 nm→275 nm→425~490 nm)相一致。 FA5-FA13中特定波长处类色氨酸组分、 类富里酸和类腐殖酸组分的p Ka值递增趋势与波长连续变化的顺序表现出相一致的规律: 275 nm(8.93~9.70)→375~495 nm(9.88~10.16)→350 nm(10.65)(FA5和FA7), 275 nm(10.11)→290~400 nm(10.35)(FA9)和265~345 nm(9.32~9.80)→360~450 nm(10.06~10.13)(FA13)。 同时, FA13中同一类富里酸组分的波长和p Ka值存在325 nm(9.32)→375~425 nm(10.06~10.13)的连续变化顺序。 SFS-2D COS结合修正Stern-Volmer模型具有降低光谱重叠率和捕获光谱波长连续变化的优势, 为深入研究有机质和污染物间复杂相互作用提供支撑。
The proton binding heterogeneity of forest soilfulvic acid (FA) sub-fractions (FA3-FA13) was investigated by use of synchronous fluorescence spectra (SFS), combined with two-dimensional correlation spectroscopy (2D COS) and modified Stern-Volmer model. XAD-8 adsorption techniques coupled with stepwise elution using Na4P2O7 buffers were successfully developed to separate the soil FA into FA sub-fractions with low heterogeneity (FA3-FA13). FA3-FA13 contained protein-like (i. e., tyrosine-like and tryptophan-like), fulvic-like and humic-like materials, and FA7-FA13 contained more contents of protein-like materials than both FA3 and FA5. The intensities of fluorescence peaks for different fluorescent materials in FA3-FA13 were affected significantly by the change of alkaline pH. The complex distributions of the auto-peaks and cross-peaks in synchronous and asynchronous maps derived from 2D COS were related to the proton binding heterogeneity of fluorescent materials in FA3-FA13. The protein-like, fulvic-like and humic-like materials in FA5-FA13 occurred in the same spectral directionby the pH perturbations. At alkaline pH conditions, the dissociation constants (p Ka) of fluorescent materialsin FA3-FA13were quantified by the SFS-2D COS combined with modified Stern-Volmer model. The p Ka values of tyrosine-like, tryptophan-like, fulvic-like and humic-like materials were ranged 6.11, 8.93~10.12, 9.32~10.65, and 9.70~10.63 ( R>0.854), respectively. The lower p Ka value (6.11) of tyrosine-like materials of FA3 indicated that the tyrosine-like material scontained more aromatic structures and adjacent phenolic functional groups. Similar p Ka values were presented for the tryptophan-like, fulvic-like and humic-like materials of FA3-FA13(8.93~10.65), and were similar to the p Ka values (8.0~12.02) of hydroxyl-benzene and amino acid. This result suggested that the tryptophan-like, fulvic-like and humic-like materials of FA3-FA13 had similar proton affinities, and the phenolic functional groups and amino acid components played a major role in the proton bonding process. The sequential changesof fluorescent materials with specific wavelengths in FA3-FA13 were consistent with their increasing trends of p Ka values. Additionally, the heterogeneous distributions of proton binding sites were both presented in different fluorescent materials and same fluorescent materials of FA sub-fractions. The p Ka values (6.11~9.16) of tyrosine-like and tryptophan-like materials with specific wavelengths of FA3 were smaller than those of humic-like materials (9.70~9.97), and their increasing trends were consistent with the sequential orders (250 nm→275 nm→425~490 nm). The increasing trends of p Ka values of tryptophan-like, fulvic-like and humic-like materials of FA5-FA13 were consistent with the sequential variations: 275 nm (8.93~9.70)→375~495 nm (9.88~10.16)→350 nm (10.65) for both FA5 and FA7, 275 nm (10.11)→290~400 nm (10.35) for FA9, and 265~345 nm (9.32~9.80)→360~450 nm (10.06~10.13) for FA13. In addition, the sequential wavelength changes and p Ka values of same fulvic-like materials in FA13 showed the orders of 325 nm (9.32)→375~425 nm (10.06~10.13). With the advantages of reducing theoverlaps of spectra and capturing the sequential wavelength changes, the SFS-2D COS combined with modified Stern-Volmer model will provide supports for exploring complex interactions between dissolved organic matter and contaminants in future studies.
富里酸(FA)是溶解性有机质(DOM)中一类含有羟基和羧基等多种官能团的非均质混合物, 具有较强的溶解性, 移动性和污染物亲和力[1, 2, 3]。 FA中脂肪族和芳香族等官能团的结构和性质赋予了FA酸碱特性, 而FA酸碱特性又显著影响着FA的官能团形态、 分子结构、 构型构象和分子内反应等, 促进或制约着营养物质, 重金属和有机污染物等化学物质在环境介质中的迁移转化和生物有效性[4, 5, 6, 7]。 FA的质子键合能力是其酸碱特性的重要表现形式。 基于酸性pH值条件下(pH 1.0~5.0)的荧光特性, 河流和海洋中DOM或FA的解离常数(Ka)成功拟合并用来表征其化学特性[8, 9]。 然而, FA在碱性pH值条件下的Ka值拟合尚未系统地研究。 同时, FA结构的异质性和复杂性成为探究FA质子键合行为的重要限制因素[2, 8], 借助XAD吸附树脂结合不同类型洗脱液将FA分级为低异质性的亚组分有利于深入探究FA的起源、 分子结构及其与化学物质相互作用机理。 同步荧光光谱(SFS)具有需样量少、 灵敏度高、 操作简便和无破坏性的优点, 广泛应用于表征河流、 湖泊、 土壤和沉积物来源DOM中芳香类化合物、 不饱和脂肪烃和蛋白质等有机化合物[10, 11]。 同时, SFS常用于建立FA中荧光组分与质子或重金属间的相互结合参数[8]。 但是, 由于SFS中荧光峰的重叠现象严重, 导致单一SFS技术无法充分反映DOM与质子或重金属相互结合位点的多相性特点。 二维相关光谱法(2D COS)能实现二维尺度上的光谱信号分析, 具有光谱分辨率高和光谱重叠峰简化度高的优势, 能够基于光谱信号峰间变化的相关性来探究不同物质间的相互作用[10, 12]。 基于外扰因素引起的两个不同光谱变量间的关系, 2D COS能有效识别由外界微扰所引起的细微光谱变化顺序[10, 12]。 2D COS为研究DOM在不同环境因素干扰下的结构改变和反应差异等提供了技术支撑, 在DOM对环境污染物吸附和解吸等研究中具有巨大的潜在优势。 Chen等[10]和Xu等[13]利用紫外吸收光谱和SFS结合2D COS探究了DOM与金属离子的成键过程。 Wen等[14]利用红外光谱结合2D COS研究了施肥时间差异性对土壤DOM与Al3+相互作用过程的影响。 荧光滴定法结合修正Stern-Volmer模型成功拟合DOM与金属离子(如Cu2+和Hg2+)或有机污染物(如PAH或菲)相互作用的条件稳定常数[15, 16]。 但是, 荧光滴定法结合修正型Stern-Volmer模型用于拟合FA的碱性Ka值和探究其质子结合位点的多相性的研究还不够充分。
利用SFS技术结合2D COS和修正Stern-Volmer模型表征土壤FA亚组分的结构组成, 拟合FA亚组分中荧光组分的Ka值, 探究荧光组分因碱性pH值变化扰动而引起的连续变化方向和次序, 并深入揭示荧光组分的质子结合位点的多相性特征。
土壤样品采自北京鹫峰国家森林公园0~15 cm表层, 风干后将其研磨并过2.0 mm孔筛, 去除砾石和植物残体。 参照国际腐殖酸协会的推荐方法, 将过筛后的土壤进行酸化和碱化处理后, 得富含FA溶液。 将上述FA溶液吸附在XAD-8树脂柱上, 经NaOH洗脱, 蒸馏水冲洗, HCl-HF除杂和H+-阳离子交换树脂纯化后, 冷冻干燥得FA固体样品。
利用一定量的浓度为0.1或0.5 mol· L-1的NaOH或HCl溶液配置浓度均为0.1 mol· L-1, 初始pH值分别为3.0, 5.0, 7.0, 9.0和13.0的Na4P2O7缓冲溶液。 用蒸馏水溶解FA, 并将其重新吸附到XAD-8树脂柱上, 然后利用不同pH值的Na4P2O7缓冲溶液逐步洗脱XAD-8树脂柱上的FA, 分别得到5种FA洗脱液。 5种FA洗脱液分别进行HCl处理(pH 1.0), 再用XAD-8树脂吸附, 依次用0.65倍树脂柱体积的蒸馏水和3倍树脂柱体积的浓度为0.1 mol· L-1的NaOH溶液淋洗XAD-8树脂, 分别得5种FA碱性洗脱液。 上述FA碱性洗脱液分别进行HCl处理(pH 1.0), 然后添加HCl-HF溶液(终止浓度为0.3 mol· L-1)进行除杂, 静止48 h, 经H+-饱和阳离子交换树脂纯化后, 冷冻干燥得5种FA亚组分(FA3, FA5, FA7, FA9和FA13)。
利用100 mL的Milli-Q水分别溶解FA3-FA13后, 过0.22 μ m滤膜。 利用KClO4溶液分别稀释过滤后的FA3-FA13溶液, 配置成FA3-FA13浓度为10.0 mg· L-1, KClO4浓度为0.05 mol· L-1的储备溶液。 天然水体中FA浓度一般介于2~20 mg· L-1, 故选择10 mg· L-1的FA3-FA13既反映自然环境浓度下的FA质子键合行为, 又避免FA在高浓度时因发生聚合作用而导致光谱变化[2, 4]。 采用滴加微量HClO4或KOH溶液的方式将FA3-FA13储备溶液的pH值在7.0~11.5范围内以0.5个pH单位进行梯度调节。 梯度调节溶液pH值过程中, 氮气吹扫FA3-FA13储备溶液各15 min, 避免氧气和碳酸盐物质的缓冲作用而引起静态猝灭现象。 条件实验表明, FA亚组分的质子键合反应在15 min内达到平衡, 保持FA3-FA13溶液pH值稳定15 min, 保证了FA3-FA13与质子反应完全。 控制HClO4或KOH溶液的体积滴加量不超过FA3-FA13储备溶液体积(100 mL)的0.1%(V/V)。 实验所用KClO4和HCl等化学品均为分析纯。
利用荧光光谱仪(Hitachi F-7000, Tokyo, Japan)测定FA亚组分的SFS谱图。 测定条件如下: 石英比色皿池长为1 cm; Ex和Em波长的狭缝宽度分别为5和10 nm; Ex波长范围为200~550 nm, 以及Ex和Em的波长间隔为30 nm; 扫描速度为240 nm· min-1。 FA亚组分的SFS减去空白KClO4的SFS, 且荧光峰波长为Ex值。
基于FA亚组分的SFS数据, 2D COS分析生成同步和异步相关谱图, 提供更为详细的光谱变化信息[17]。 同步和异步相关谱图分别提供了光谱强度同步和顺序变化的信息[17, 18]。 SFS光谱变化y(x, t)与光谱变量(x), 外部变量(t)和动态光谱
其中,
同步相关谱图可以定量表示为
基于动态频谱和Hilbert变换正交频谱
在同步相关谱图中, 自动峰和交叉峰分别出现在谱图的主对角线和非对角线位置上。 在异步相关谱图中, 只有交叉峰出现在谱图的非对角线位置, 且无自动峰出现[10, 12, 17]。 在外部扰动条件下, 自动峰代表相关光谱对光谱强度变化的敏感性, 且表示符号总是正值[16, 17]。 同步交叉峰和异步交叉峰分别代表两个光谱变量(v1和v2)的光谱强度变化和连续变化顺序, 且表示符号是正值或负值[17, 19]。 根据Noda判定理论, 若同步和异步相关谱图中交叉峰在给定波长范围内具有相同表示符号, 则变量v1处光谱变化先于变量v2, 否则, 上述判断结果则相反[10, 17]。 其他2D COS谱图规律的判别原则参照Noda理论[17]。 以溶液pH值变化为外部扰动条件, FA3-FA13的10组SFS数据分别进行2D COS分析, 得FA3-FA13的同步和异步相关谱图。
在偏碱性pH值范围内, 假定结合位点(L)与质子形成1:1化学模型, 其质子结合反应为
在偏碱性pH值条件下, FA亚组分中非均相结合位点的Ka值表述为
其中, [HL]表示偏碱性pH值条件下质子结合平衡浓度; [L]表示在偏碱性pH值条件下不参与反应的配体平衡浓度。
假定FA亚组分在荧光滴定过程中具有一致的荧光特性, 其荧光强度、 配体总浓度(cL)和[HL]之间关系表示为
其中, F和F0分别表示特定pH值和荧光滴定开始时的荧光强度; Fend是滴定结束时的荧光强度。
在偏碱性pH值条件下, 由式(5)和式(6)得
令
修正Stern-Volmer模型拟合偏碱性pH值条件下FA亚组分的Ka值得[15, 20]
利用SigmaPlot 12.5软件, 通过F0/Δ F和1/[H]关系图来求算f和Ka值。 FA亚组分中质子结合位点的差异性导致其荧光组分表现出不同的荧光特征。 基于FA亚组分的同步和异步相关谱图中主要相关峰的波长数据, 利用修正Stern-Volmer模型来拟合其荧光组分pKa值(pH 7.0~11.5)。
在偏碱性pH值条件下, FA3-FA13的SFS表现出Peak A(240~280 nm), Peak B(360~380 nm)和Peak C(420~480 nm)三个主要荧光峰(表1)。 研究表明[10], DOM的SFS荧光特征能够反映DOM中类蛋白, 类富里酸和类腐殖酸组分, 且类蛋白中含有类酪氨酸(200~250 nm)和类色氨酸(250~310 nm)组分[21]。 基于光谱峰Peaks A-C的波长位置, Peaks A-C分别表示FA3-FA13中类蛋白, 类富里酸和类腐殖酸组分(表1)[10, 21]。 FA3-FA13间Peak A的荧光强度差异性大于Peak B和Peak C的荧光强度差异性(表1)。 FA3和FA5中Peaks A-C的荧光强度相近, 而FA7-FA13中Peak A的荧光强度(248.8~2 009.0 a.u.)大于Peak B和Peak C的荧光强度(20.7~241.3 a.u.)。 FA亚组分中荧光峰的强度差异表明FA7-FA13比FA3和FA5含有更多含量的类蛋白组分, 且荧光峰的强度受溶液pH值变化的影响较为明显。
| 表1 FA亚组分SFS中荧光峰的类型及位置 Table 1 Types and locations of fluorescence peaks in SFS of FA sub-fractions |
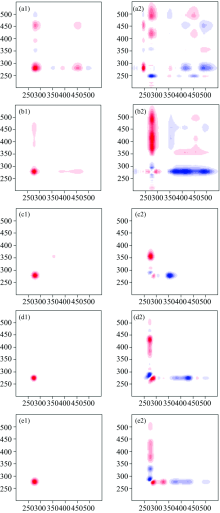
在偏碱性pH值条件下, 2D-COS解析FA亚组分中荧光组分的动态变化得同步和异步相关谱图。 同步和异步相关谱图中交叉峰以对角线为轴心对称出现, 且以对角线左下方的交叉峰特性进行分析。 同步和异步相关谱图中红色和蓝色代表自峰或交叉峰的符号分别为正和负, 颜色越深表示符号特征或变化强度越明显(表2和图1)。 FA3的同步相关谱图在Peak A和Peak C波长范围内表现出两个主要的正自峰(275/275和450/450 nm)和一个正交叉峰(450/275 nm)(图1 a1), 表明FA3中类蛋白和类腐殖酸组分因pH值变量扰动而产生相同的变化方向。 FA5-FA13的同步相关谱图均在对角线处表现出一个主要的正自峰(275/275 nm), 表明FA5-FA13中类蛋白、 类富里酸和类腐殖酸组分的光谱变化随溶液pH值变化而产生相同的变化方向。 同时, FA3和FA5的同步相关谱图中还存在弱的正或负交叉峰(图1 a1-b1), 表明FA3和FA5中荧光组分的光谱变化较为复杂且部分变化趋势不明显。 FA3的同步相关谱图中对角线波长约275/275 nm处的正自峰强度略高于FA5-FA13(图1 a1), 可能与类蛋白峰的波长漂移和峰强差异有关。
| 表2 FA亚组分与质子相结合的同步和异步相关谱图中典型峰的参数和符号 Table 2 Parameters and signs of specific peaks in synchronous and asynchronous maps of FA sub-fractions with proton binding |
FA3的异步相关谱图中交叉峰分布复杂且无规律, 表明FA3中荧光组分受pH值变化的影响较大且荧光特性变化复杂, 与其同步相关光谱分析结果相一致。 FA5的异步相关谱图中负交叉峰主要出现在v1波长350~550 nm范围和v2窄波长250~300 nm范围内, 其中v1/v2波长360~500/350~355 nm范围内出现弱的正交叉峰。 FA7的异步相关谱图中交叉峰分别出现在v2窄波长250~300 nm范围内。 FA9和FA13的异步相关谱图中交叉峰出现在v1波长260~500 nm范围和v2窄波长250~300 nm范围内。 FA3-FA13的同步和异步相关谱图中自峰和交叉峰的复杂分布与荧光组分质子键合的多相性有关。 Hur和Lee等[18]利用光谱学结合2D COS探究DOM与Cu2+相互作用机理时发现两者结合位点也存在多相性分布的特点。
FA亚组分的异步相关谱图能够揭示v1和v2波长随pH值变化的规律与联系。 FA3的异步相关谱图中分别在对角线下方波长275/250, 425/275, 450/250, 490/275和490/450 nm处表现出五个明显的负交叉峰(图1a2)。 基于Noda判定原则[17], FA3中荧光组分的波长连续变化顺序为250 nm→ 275 nm→ 425 (490) nm和250 nm→ 450 nm→ 490 nm, 表明FA3中质子结合位点的多相性分布同时体现在不同荧光组分间和同一荧光组分中。 因此, FA3中荧光组分的光谱变化顺序为类酪氨酸→ 类色氨酸→ 类腐殖酸。 FA5的异步相关谱图中对角线下方波长375/275, 410/275和495/275 nm位置出现三个主要的负交叉峰和弱的正交叉区域(360~500/350~355 nm)(图1 b2)。 FA7的异步相关谱图中对角线下方波长350/275 nm位置出现一个明显的负交叉峰(图1 c2)。 基于Noda判定原则[17], FA5和FA7中荧光组分的波长连续变化顺序分别为275 nm→ 375~495 nm→ 350~355 nm和275 nm→ 350 nm, 说明FA5和FA7中荧光组分的光谱变化顺序分别为类色氨酸→ 类腐殖酸→ 类富里酸和类色氨酸→ 类富里酸。 在波长275~495 nm范围内, FA5和FA7中不同荧光组分间也存在着质子结合位点的多相分布。 FA9的异步相关谱图中出现一个明显的正交叉峰(280/270 nm), 以及负交叉区域(355~450/275 nm)内出现两个波长为375/270和425/270 nm的负交叉峰(图1 d2), FA13的异步相关谱图中出现一个正交叉区域(280~345/265 nm)和一个负交叉区域(360~450/265 nm)(图1 e2), 表现出波长280/275和325/275 nm的明显正交叉峰, 以及375/275和425/275 nm的主要负交叉峰。 因此, FA9和FA13中荧光组分的波长连续变化顺序分别为275 nm→ 290~400(455) nm和280~345→ 265→ 360~450 nm, 表明FA9和FA13中荧光组分的光谱变化顺序分别为类色氨酸→ 类富里酸(类腐殖酸)和类富里酸→ 类酪氨酸→ 类腐殖酸。 结果表明, SFS-2D COS方法具有降低光谱重叠率和捕获光谱波长连续变化的优势, 为深入探究荧光组分与化学物质的相互作用机理提供技术手段和理论支撑。
基于2D COS同步和异步相关谱图中出现的自峰和交叉峰的波长数据, 利用修正Stern-Volmer模型拟合得FA亚组分中荧光组分的pKa值(6.11~10.65)和f值(0.12~1.00)(pH 7.0~11.5, R> 0.854)(表3)。 2D COS结合修正Stern-Volmer模型拟合所得FA亚组分中荧光组分的pKa值与前期研究中基于三维荧光光谱数据所得DOM的pKa值相近[2]。
| 表3 修正Stern-Volmer模型拟合的质子结合参数 Table 3 Proton binding parameters fitting by the modified Stern-Volmer equation |
FA3-FA13中类酪氨酸、 类色氨酸、 类富里酸和类腐殖酸的pKa值范围分别是6.11, 8.93~10.12, 9.32~10.65和9.70~10.63(表3)。 FA亚组分中类色氨酸、 类富里酸和类腐殖酸具有相近的pKa值, 且与碱性条件下羟基苯和氨基酸的pKa值(8.0~12.02)相近[22], 结果表明类色氨酸、 类富里酸和类腐殖酸具有相似的质子亲和力, 且酚基官能团和氨基酸组分在其与质子相互结合中起到主要作用。 FA3中波长250 nm处的类酪氨酸的pKa值(6.11)低于其他荧光组分的pKa值(8.93~10.65)(表3)。 FA亚组分中相邻芳香族羧基或羧酸基官能团, 以及相邻酚基官能团的荧光特性受溶液pH值变化影响较大[23]。 因此, FA3中类酪氨酸可能含有更多含量的芳香族结构和相邻酚基官能团, 从而导致FA3中类酪氨酸与质子结合能力更强。 FA亚组分中荧光组分间的不同pKa值同样表明其质子结合位点存在多相性的特点(表3)。 基于结合常数(logK), Hur等[24]所研究的DOM与Cu2+相互作用过程中其荧光组分也存在类似的金属结合位点的多相性特征。
FA亚组分中特定波长处的荧光组分的pKa值大小与2D COS分析中荧光组分的波长连续变化的顺序相一致。 结合异步相关谱图和Noda判断规律[17], FA3中特定波长250~275 nm处的类酪氨酸和类色氨酸的pKa值(6.11~9.16)小于特定波长425~490 nm处的类腐殖酸的pKa值(9.70~9.97)(表3), 与波长连续变化的顺序250 nm→ 275 nm→ 425~490 nm相一致(图1)。 FA5和FA7中特定波长275 nm处的类色氨酸的pKa值(8.93~9.70)依次小于特定波长375~495 nm(9.88~10.16)和350 nm(10.65)处的类富里酸和类腐殖酸的pKa值(表3)。 FA5和FA7中荧光组分的pKa值递增顺序与波长连续变化的顺序275 nm→ 375~495 nm→ 350 nm相一致(图1)。 FA9中特定波长270~280 nm处的类色氨酸的pKa值(10.08~10.12)小于特定波长375~425 nm处的类富里酸和类腐殖酸的pKa值(10.35~10.63)。 同时, FA13中特定波长275~280 nm处的类色氨酸和特定波长325 nm处的类富里酸的pKa值(9.32~9.80)均小于特定波长375~425 nm处的类富里酸和类腐殖酸的pKa值(10.06~10.13)(表3)。 FA9和FA13中荧光组分的pKa值递增顺序分别与波长连续变化的顺序275 nm→ 290~400 nm和265~345→ 360~450 nm相一致(图1)。 另外, FA13中同一类富里酸组分内的波长和pKa值存在325 nm(9.32)→ 375~425 nm(10.06~10.13)的连续变化顺序。 FA亚组分中不同荧光组分间和同一荧光组分(如FA13中类富里酸)内的不同pKa值也表明其质子结合位点的多相性特征同时体现在不同荧光组分间和同一荧光组分内。 另外, FA3中波长490 nm处的类腐殖酸的pKa值无法准确拟合(表3), 可能与其荧光强度具有较小的变化差异值有关。
(1)FA3-FA13含有类蛋白(类酪氨酸和类色氨酸), 类富里酸和类腐殖酸组分。 不同荧光峰存在峰强度差异性, 且受溶液碱性pH值变化的影响较为明显。 FA7-FA13比FA3和FA5含有更多含量的类蛋白组分。
(2)利用SFS-2D COS结合修正Stern-Volmer模型定量拟合偏碱性条件下FA3-FA13中荧光组分的pKa值。 FA3-FA13中荧光组分的pKa值和f值范围分别是6.11~10.65和0.12~1.00(R> 0.854)。 类色氨酸(8.93~10.12)、 类富里酸(9.32~10.65)和类腐殖酸(9.70~10.63)的pKa值相近, 且与羟基苯和氨基酸的pKa值(8.0~12.02)相近, 表明类色氨酸、 类富里酸和类腐殖酸具有相似的质子亲和力, 且酚基官能团和氨基酸组分起到主要作用。 类酪氨酸的pKa值(6.11)低于其他荧光组分的pKa值(8.93~10.65), 与类酪氨酸含有更多含量的芳香族结构和相邻酚基官能团有关。
(3)FA3-FA13中荧光组分的波长连续变化顺序与特定波长处的荧光组分的pKa值大小顺序相一致, 表明不同荧光组分间和同一荧光组分内存在质子结合位点的多相性特征。 FA3中特定波长处的类酪氨酸和类色氨酸的pKa值小于类腐殖酸, 与波长连续变化顺序250 nm(6.11)→ 275 nm(9.16)→ 425~490 nm(9.70~9.97)相一致。 FA5-FA13中特定波长处的类色氨酸的pKa值小于类富里酸和类腐殖酸, 与波长连续变化顺序275 nm(8.93~9.70)→ 375~495 nm(9.88~10.16)→ 350 nm(10.65)(FA5和FA7), 275 nm(10.11)→ 290~400 nm(10.35)(FA9)和265~345 nm(9.32~9.80)→ 360~450 nm(10.06~10.13)(FA13)相一致。 同时, FA13中同一类富里酸组分内的pKa值差异性也与波长连续变化顺序325 nm(9.32)→ 375~425 nm(10.06~10.13)相一致。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|