作者简介: 林青锋, 1995年生, 福州大学化学学院本科生 e-mail: 1076420135@qq.com
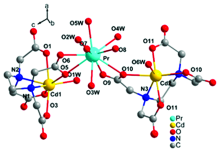
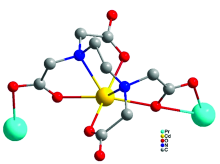
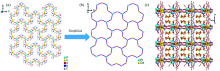
利用水热合成法, 以柔性的乙二胺四乙酸(H4EDTA)为配体、 氧化镨以及氯化镉为金属源合成了一种镨-镉异金属-有机配合物[Pr2Cd3(EDTA)3(H2O)11]·14H2O (1)。 通过X射线单晶衍射确定化合物1的结构, 该化合物属单斜晶系的 C2空间群, a=16.154(3) Å, b=14.863(3) Å, c=14.875(3) Å, β=115.855(3)°, V=3214.2(9) Å3, Z=2, 化合物1的结构中存在纳米尺寸大小的“心形”Pr6Cd6O12轮簇。 其中Cd2+的配位数为7, 采取单帽三棱柱的配位构型, 而Pr3+采取十配位双帽四方反棱柱的构型。 EDTA4-配体的四个羧基全部去质子化, 与一个Cd2+和两个Pr3+配位, 其中4个羧基氧原子和2个氮原子都与Cd2+配位, 两个羧基分别桥连1个Pr3+。 Pr3+和Cd2+通过μ2-O氧原子交替连接形成Pr6Cd6O12轮簇, 每个Pr6Cd6O12轮簇与附近的6个Pr6Cd6O12轮簇共边连接, 从而形成一个二维(6, 3)层状结构。 二维层再通过…AAA…类型的堆积方式形成三维超分子结构。 游离水分子填充在二维层空隙中, 与羧基以及配位水分子之间形成比较强的O—H…O氢键, 这些氢键有利于结构的稳定。 通过热重分析、 稳态荧光光谱、 热微扰二维红外相关光谱(2D-IR COS)、 固体紫外-可见漫反射光谱等手段进一步对化合物1的谱学性能进行表征。 在红外光谱上, 由于存在大量的氢键, 化合物的红外光谱在3 680~2 640 cm-1波数范围内出现宽而强的吸收谱带。 同时配体H4EDTA中的羧基脱去了质子氢, 并且与金属离子发生配位, 因此化合物1中羧基的C=O双键的伸缩振动吸收峰与未配位配体中的C=O双键的伸缩振动吸收峰相比, 向低波数移动, 在1 527 cm-1波数处出现吸收峰。 固体荧光测试显示在325 nm的紫外光照射下, 配合物1能发出强的360 nm左右的荧光, 主要是由能量在Cd2+和EDTA4-之间发生明显的LMCT跃迁转移引起的, 因此化合物1可作为一类潜在的发光材料。 热微扰下的二维红外光谱显示, 由于水分子与羧基及水分子之间存在氢键, 使得O—H的伸缩振动吸收峰对热的微扰响应比较敏感。 紫外-可见光谱测试显示化合物1在位于216 nm处出现很强的紫外吸收峰, 归属于化合物1中EDTA4-配体的中 n→ σ*跃迁及π→π*, 位于444, 468和484 nm的弱吸收峰, 归属为Pr3+的 f— f跃迁。
A 2D Pr-Cd heterometal-organic compound, [Pr2Cd3(EDTA)3(H2O)11]·(H2O)14(1) (H4EDTA=ethylene diamine tetraacetic acid) has been successfully prepared by the H4EDTA ligand, Pr6O11 and CdCl2·2.5H2O. The structure of 1 was determined by X-ray single-crystal diffraction. Compound 1 crystallizes in the monoclinic space group C2, a=16.154(3) Å, b=14.863(3)Å, c=14.875(3)Å, β=115.855(3)°, V=3 214.2(9)Å3, Z=2. There are nanosized heart-like Pr6Cd6O12 wheel-clusters in the structure. The coordination geometries for the two seven-coordinated Cd2+ ions are both close to that of a monocapped trigonal prism. The Pr3+ ion is ten-coordinate and described as seriously distorted dicapped square antiprism. The completely deprotonated EDTA4- ligand link one Cd2+ and two Pr3+ ions. Four carboxylate O and two N atoms of the EDTA4- ligand are all coordinated to the Cd2+ cation and the remaining carboxylate groups connect one Pr3+ ion, respectively. The Pr3+ and Cd2+ cations are bridged by2-O alternatively to form a Pr6Cd6O12 wheel-clusters. Each Pr6Cd6O12 is linked to six surrounding wheels by sharing Pr3+, forming a highly ordered layered network. The 2D layers are further packed in …AAA… stacking mode and the free water molecules are suspended between the layers. There are strong O—H…O hydrogen-bond interactions between water molecules and carboxylate groups, and the O…O distance ranges from 2.666 to 3.050 Å. The hydrogen-bond interactions play an important role in stabling the structure. At the same time, PXRD, TG/DSC, IR and 2D IR correlation spectroscopy, solid Luminescent spectrum and UV-Visible absorption spectrum are studied. Because there are strong O—H…O hydrogen bonds, the IR spectrum of compound 1 shows broad bands around 3 680~2 640 cm-1. The four carboxylic acid groups of EDTA4- ligand are completely deprotonated, The C=O stretching vibrations peak of carboxylate groups of compound 1 shift lower wavenumber compared to H4EDTA ligand. Compound 1 shows emission peak at 360 nm that can be assigned to LMCT transition of between Cd2+and EDTA4- when it is excited at 325 nm. Compound 1 is a potential luminescent material. 2D IR correlation spectrum of 1 indicates that the stretching vibrations of O—H are sensitive with the thermal perturbation because of strong hydrogen-bond interactions between water molecules and carboxylate groups. The UV-Visible absorption spectrum of compound 1 shows the absorption bands of n→ σ* and π→π* transitions of EDTA4- ligand and f→ f transition of Pr3+.
由于具有迷人的结构以及在分子磁性, 分子识别, 荧光材料和半导体方面的广泛应用, 镉及镧系金属有机配合物的设计和合成受到很大程度的关注[1, 2, 3, 4, 5]。 稀土-金属有机发光材料因为本身稀土离子特殊的电子结构而成为一类性能优良的发光材料。 但由于镧系金属离子的f→ f跃迁是宇称禁阻的, 因此需要有机配体或过渡金属离子敏化镧系金属离子发光, 大量的配体可以作为天线, 同样地, 在体系中引入过渡金属离子, 合成异金属配合物, 过渡金属离子也可以作为天线敏化稀土离子发光。 CdⅡ 对于合成异金属配合物是个很好的选择, 因为CdⅡ 的配位聚合物在蓝光和绿光区域有很好的发光性质, 与镧系金属离子的发射态能量接近, 从而可以提供能量转移。 同时, CdⅡ 的配位数通常在6~8之间, 从而允许CdⅡ 与配体形成新颖结构。 因此, 把CdⅡ 引入到稀土配合物中, 可以为合成d— f异金属配合物提供一个很有前景的方法[6, 7, 8, 9, 10, 11, 12]。 根据“ 硬酸优先与硬碱结合, 软酸优先与软碱结合” 的软硬酸碱(HSAB)理论以及分类原则, 镧系稀土(Ln3+)离子属于硬酸, 较优先与属于硬碱的羧酸根结合配位, 而镉(Cd2+)离子属于软酸, 优先与属于软碱的氮或者硫等配原子结合。 因此, 采用同时含羧酸氧和含氮的有机配体, 有利于合成同时含有镧系金属离子和镉离子的异核金属配位聚合物。 乙二胺四乙酸即H4EDTA是经典的柔性螯合型配体, 同时含有软硬配位点, 分别为4个羧基(硬碱)和两个氮原子(软碱), 共12个配位原子, 故H4EDTA配体能同时与软、 硬金属离子形成很强的配位键, 因此对稀土金属离子和镉离子都有很强的螯合作用, 所以可选择H4EDTA作为合成镧系-镉异金属有机配合物的有机配体[13]。 基于以上的考虑, 我们采用乙二胺四乙酸作为主要配体, 镧系金属氧化物和氯化镉为金属源, 采用水热法合成得到了一个镨-镉异金属-有机配合物: [Pr2Cd3(EDTA)3(H2O)11]· 14H2O (1, H4EDTA=乙二胺四乙酸)。 化合物1的晶体结构中存在12元环构筑的Pr6Cd6金属轮状簇结构单元, 其二维层是由Pr6Cd6金属轮状簇结构单元共边拼合连接而成, 该二维层也可看作是由镧系稀土金属离子(Pr3+)和氧原子形成的螺旋链再通过镉离子(Cd2+)连接而成。 本文同时研究了化合物1的红外光谱、 热微扰二维红外相关光谱、 荧光光谱和紫外可见光谱等谱学性能。
CdCl2· 2.5H2O, H4EDTA均为分析纯。 X射线单晶衍射测试采用的是布鲁克Apex DUO2衍射仪, 红外光谱是在Nicolet iS50 红外光谱仪上用ATR测定的, 元素分析选用Elemental Analysis Vario EI Ⅲ 仪器, 荧光光谱采用Edinburgh-Instrument F920荧光光谱仪测定, 紫外-可见光谱使用Cary500 Scan型紫外可见-近红外分光光谱仪, 扫描波长范围为200~800 nm。
将称取的Pr6O11 (0.082 1 g, 0.083 mmol), CdCl2· 2.5H2O (0.218 g, 1 mmol), H4EDTA (0.145 0 g, 0.5 mmol) 混合物放置于特制反应容器中, 量取10 mL去离子水加入到容器中, 放在常温下持续搅拌1 h, 接着放入不锈钢外衬中, 封好后, 放入恒温170 ℃的烘箱中, 在烘箱中反应6 d后, 用坩埚钳取出, 放在实验台上冷却, 打开反应容器, 将混合物抽滤, 同时用去离子水洗涤3次, 可以获得绿色长柱状晶体。 干燥, 产率约为: 50%(化合物1)(以Pr6O11的量计算)。 化合物1(C30N6O49H86Cd3Pr2)的元素分析实验值(计算值)Wt%为: C 18.67(18.63); H 4.42(4.45); N 4.31(4.34)。
在293 K下, 以石墨单色化的Mo— Kα 射线(λ =0.710 73 Å )作X-Ray射线源, 采用ω -2θ 扫描方式在一定的范围(3.17° < 2θ < 27.59° )内记录衍射点位置, 然后采用CrystalClear程序将衍射点位置进行还原处理得到单晶衍射数据。 使用Olex2.0程序对单晶衍射数据进行解析, 先采用直接法(direct methods)解析确定出重原子Pr和Cd的坐标位置, 然后反复多次运用差傅里叶函数确定出C, N及O等其他非氢原子, 对除H以外的Pr, Cd, C, N及O原子进行各向异性精修, 所有碳原子进行理论加氢。 晶胞参数: C30N6O49H86Cd3Pr2, Mr=61 934.06, 单斜晶系, 空间群为Cc, a=16.154(3), b=14.863(3), c=14.875(3) Å , β =115.855(3)° , V=3214.2(9) Å 3, Z=2, ρ =1.901 g· cm-3, F(000)=1936, GOF=1.071, R1 (wR2)=0.037 2 (0.108 5)。
化合物1属于单斜晶系的C2空间群。 其不对称单元含有1.5个晶体学上独立的Cd2+, 1个Pr3+, 1.5个EDTA4-配离子, 5.5个配位水分子和7个游离的水分子(图1)。 其结构中2种Cd2+的配位数都是7, 采取单帽三棱柱配位构型, 分别与来自于1个EDTA4-配体的2个N原子和4个羧基
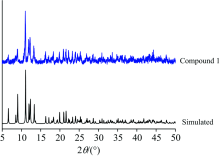
X射线粉末衍射(PXRD)图显示的实验数据谱图和通过X衍射实验数据分析模拟的谱图是基本吻合的, 这说明制备的化合物1是纯相(图4)。
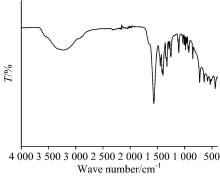
化合物1的红外谱图如图5所示, 在3 680~2 640 cm-1波数范围内出现宽而强的吸收谱带是结构中水分子的O— H和配体的C— H的伸缩振动吸收峰, 说明存在着大量的氢键。 1 572 cm-1归于羧基的C=O双键的伸缩振动吸收峰, 化合物1结构中C=O双键的吸收峰与未配位配体中的C=O双键的伸缩振动吸收峰相比, 向低波数移动, 说明配体H4EDTA中的羧基脱去了质子氢, 并且与金属离子发生配位。
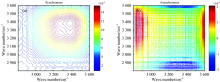
在温度为50~120 ℃范围内测量化合物1的2D-IR COS, 以10 ℃为梯度进行FTIR红外光谱的测试, 将收集到不同温度下的动态热红外谱图利用OMNIC软件进行吸光度转换, 平滑, 基线校准和纵坐标归一化进行数据的处理。 然后利用MATLAB 7.0软件绘图, 从而得到600~800和2 800~3 600 cm-1波数范围内两组热微扰二维红外相关光谱图(图6和图7)。 从图6中可以看出, 在其对角线上, 在648和689 cm-1出现强的自动峰, 这归属于羧基的面内弯曲振动, 说明羧基是螯合配位的, 而且起到桥连作用。 同样地, 在图7中, 在2 800~3 600 cm-1波数范围内的热微扰二维红外相关光谱谱图上, 沿着对角线方向在3 430 cm-1波数处有一个很强很宽的自动响应峰, 该峰是由于化合物1中水分子的O— H键的伸缩振动引起的。 由于在结构中水分子与羧基及水分子之间存在很强的氢键, 使得O— H的伸缩振动吸收峰对热的微扰响应比较敏感。
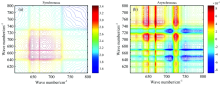 | 图6 化合物1在600~800 cm-1和温度50~120 ℃下的热微扰下的二维红外光谱Fig.6 Synchronous and asynchronous 2D correlation spectra of compound 1 between 600 and 800 cm-1 with the temperature in the range of 50~120 ℃ |
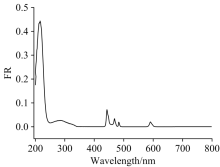
在室温下, 对化合物1进行固体紫外-可见(UV-Vis)漫反射光谱的测试, 如图8所示, 位于216 nm 处很强的紫外吸收峰归属于化合物1中EDTA配体的N原子上的孤对电子的反键轨道跃迁, 即n→ σ * 跃迁以及羧基π → π * 引起的。 由于化合物1是浅绿色的, 444, 468和484 nm的弱吸收峰, 可以归属为Pr3+的f— f跃迁引起。
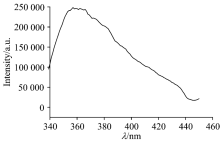
对化合物1在视温下进行稳态荧光光谱实验, 其谱图见图9。 在激发波长为325 nm下, 化合物1的发射光谱存在一个范围为340~380 nm的宽的发射峰, 发射峰波长主要位于360 nm, 该发射峰可能是能量在Cd2+和EDTA4-之间发生明显的LMCT跃迁转移引起的。
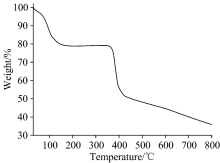
化合物1的热重分析(TG)和差热分析(DSC)是在氩气氛围中测试的, 温速率是10 ℃· min-1, 得到的热重和差示扫描量热(DSC)曲线见图10。 在30~800 ℃的范围内出现了两次失重过程: 首先在30~155 ℃的温度范围内, 化合物1质量逐渐下降, 对应失去框架外的14个游离的水分子和5个配位水分子, 占化合物1总重量的17.20%, 理论计算值为17.68%。 然后是在155~660 ℃范围内, EDTA4-有机配体在这个温度范围内开始分解, 整个化合物的有机框架开始坍塌直至变成无机氧化物。 经理论计算化合物1最后剩余的残渣物质应该为1/3Pr6O11· 3CdO粉末, 实验中观察到的残渣物质显暗红色, 实验值39.54%, 理论计算值是37.52%。 同时差示扫描量热曲线(DSC)显示, 在温度为100 ℃时出现吸热峰, 归属于化合物1失去游离水分子吸热导致, 紧接着失去配位水分子, 同时晶态发生转变, 因此出现较强的吸热峰。 随后温度继续升高, 化合物发生分解反应, 在620 ℃出现强的吸热峰印证了化合物1在发生分解时的热量变化。
通过水热合成法, 以常见螯合型H4EDTA为配体, 在同一反应体系中实现了与镧系金属离子(Ln3+)和镉离子(Cd2+)同时配位, 得到了一种2D层状镧系-镉异金属有机配合物。 化合物1中存在由Pr和Cd交替桥连氧原子构筑的12元金属轮状簇, 这在以往的报道中是比较少见, 二维层再通过…AAA…类型的堆积方式形成三维超分子结构, 水分子与羧基以及水分子之间存在强的氢键作用。 另外通过粉末X射线衍射、 热重分析、 稳态荧光光谱、 热微扰二维红外相关光谱(2D-IR COS)、 固体紫外-可见漫反射光谱等手段进一步对其谱学性能进行表征。 配合物1能发出强的360 nm左右的荧光, 主要是由能量在Cd2+和EDTA4-之间发生明显的LMCT跃迁转移引起的, 热微扰下的二维红外光谱显示, 由于水分子与羧基及水分子之间存在氢键, 使得O— H的伸缩振动吸收峰对热的微扰响应比较敏感。 紫外-可见光谱测试显示化合物1在位于216 nm处出现很强的紫外吸收峰, 归属于化合物1中EDTA配体的中n→ σ * 跃迁及π → π * , 位于444, 468和484 nm的弱吸收峰, 归属为Pr3+的f— f跃迁。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|