作者简介: 林学亮, 1992年生, 福建师范大学光电与信息工程学院硕士研究生 e-mail: 837827803@qq.com
表面增强拉曼光谱(SERS)技术是一种快速、 有效、 无损的光学诊断方法, 能提供生物分子成分和结构的指纹特征。 人的唾液包含多种能反应人体健康状况的生物标志物。 采用纳米银溶胶为增强基底的SERS技术, 从46位鼻咽癌患者、 30位鼻炎患者和48位健康人的唾液样本中采集了208条高质量的SERS。 研究结果表明鼻咽癌患者、 鼻炎患者和健康人的唾液SERS之间存在明显差异。 利用主成分分析结合线性判别分析(PCA-LDA)对采集的唾液SERS进行诊断研究, 获得灵敏度分别为89.5%, 93.0%和100%, 特异性分别为94.6%, 96.7%和97.7%。 研究结果表明: 唾液SERS技术结合PCA-LDA分析方法可能快速、 有效区分鼻咽癌、 鼻炎患者与正常人的唾液样本, 具有鼻咽癌无损检测和临床筛查的潜能。
Surface Enhanced Raman Spectroscopy (SERS) technique is a fast, convenient and nondestructive optical diagnose method that can provide specific fingerprints of biomolecular compositions and structures. Human saliva contains many biomarkers that can reflect health condition. In this paper, we employed SERS methods based on nanometer silver colloid to obtain high quality SERS of 208 saliva samples from 46 patients with nasopharyngeal carcinoma (NPC), 30 patients with rhinitis and 48 healthy volunteers. The results showed there were great differences in SERS pattern among these three subjects. Principal component analysis-linear discriminant analysis (PCA-LDA) was utilized to analyze and classify the saliva spectra from NPC, rhinitis and healthy subjects. The diagnostic sensitivity was 89.5%, 93.0% and 100% respectively, and meanwhile the specificity was 94.6%, 96.7% and 97.7% respectively. The research showed that saliva SERS combined with PCA-LDA can rapidly and effectively distinguish three saliva groups, and this technique has great potential to be a non-destructive and clinical screening method for nasopharyngeal carcinoma detection.
鼻咽癌是发生在头颈部的恶性肿瘤之一, 主要发生在中国的福建省、 广东省、 香港、 东南亚和亚洲的一些国家[1, 2]。 因为鼻咽癌早期无明显症状、 鼻咽位于头颈部的深处, 所以早期的鼻咽癌难以被发现。 超过70%鼻咽癌患者在确证时已经处于中晚期。 鼻炎是某些病毒、 变应原、 各种理化因子以及一些疾病引起的鼻腔黏膜的炎症。 早期鼻咽癌与鼻炎患者表现出的症状相似, 患者只有头痛、 鼻塞、 鼻涕中和痰中带血丝等类似症状, 经常被忽视。 经常性鼻炎复发, 也会发展为鼻咽癌。 早期鼻咽癌患者的生存率超过90%, 晚期患者的生存率却低于30.3%[3, 4, 5]。 因此, 鼻咽癌的早期诊断成为治疗鼻咽癌的关键。 常规的诊断方法包括: 组织活检、 鼻咽镜检查、 磁共振成像(MRI)、 计算机断层扫描(CT)等等, 但是这些方法存在着费用高、 时间久、 具有二次损伤, 还需要依赖于医生的临床经验等缺点, 并且很难做到对鼻咽癌的早期诊断[6, 7]。
表面增强拉曼光谱技术(surface enhance Raman spectroscopy, SERS)是一种快速、 无损、 有效的光学诊断技术, 具有低检测极限、 谱峰窄且尖锐、 强特异性、 高灵敏度等优势[8, 9]。 SERS已将被广泛地运用于人类样品(包括组织、 细胞、 血液、 尿液、 DNA、 RNA等)对癌症的检测[10, 11, 12, 13, 14]。 同时, 主成分分析法(PCA)结合线性判别分析法(LDA)也得到广泛的应用[15, 16]。
与血液相比, 唾液的成分与血液相似, 同时极大减少样品收集时对患者的创伤, 此外还能避免与血液相关的疾病传播。 因此, 本文利用高灵敏度的SERS技术对46位鼻咽癌患者、 30位鼻炎患者和48位健康人的唾液样品检测分析。 首先对采集到的高质量唾液SERS光谱进行对比分析, 再利用主成分分析法结合线性判别分析法(PCA-LDA)对唾液SERS光谱进行多元统计诊断判别。
正常、 鼻炎和鼻咽癌患者的唾液样品取自福建省肿瘤医院, 收集唾液样品前: (1) 已经确认仅患有鼻炎或者鼻咽癌; (2) 还未接受任何治疗。 (3) 与患者签订知情同意书; 据此, 收集到46位鼻咽癌患者、 30位鼻炎患者和48位健康人的唾液, 详细信息见表1。
| 表1 鼻咽癌患者、 鼻炎患者和健康人的临床信息 Table 1 NPC patient, rhinitis patient and healthy volunteer clinical information |
为避免食物唾液样品的干扰, 每位志愿者经过10个小时的禁食, 然后在早上6:30— 8:30采集志愿者自然流出的唾液样品于1.5 mL的离心管(约0.5 mL)。 最后在温度为4 ℃, 转速为13 900 r· min-1的速度下离心10 min, 取上层清液, 冷藏于-80 ℃冰箱待测。
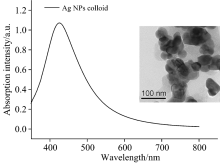
银胶制备采用盐酸羟胺还原硝酸银方法[17, 18]。 将9 mL 0.1 mol· L-1氢氧化钠溶液加到10 mL 0.06 mol· L-1盐酸羟胺中, 再将该混合液迅速加入180 mL 0.001 1 mol· L-1硝酸银溶液中, 加入后均匀搅拌, 直至获得均匀乳灰色溶液。 然后制备的银胶溶液经10 000 r· min-1离心10 min后去除上清液即获得3 mL的浓银胶。 最后室温下避光封存。 制成的银胶纳米颗粒在418 nm有一个最大的吸收峰(如图1), 其透射电镜如图1的插图, 该银胶纳米颗粒直径约为35 nm。
用移液枪移取2 μ L唾液与2 μ L浓银胶在干净的铝片上混合均匀, 在室温下等到样品自然风干。 然后样品通过雷尼绍共聚焦显微拉曼光谱仪(Renishaw, Great Briain)进行光谱采集, 其中激发波长为785 nm半导体激光, 曝光时间10 s。 最后将所有采集到光谱进行扣荧光背景, 导入origin软件做差谱图, 导入SPSS软件结合PCA-LDA进行数据分析。
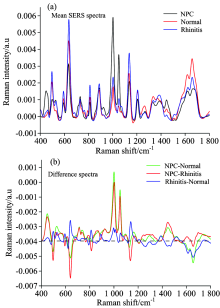
在采集所有的光谱前, 都采用硅片对硅的520 cm-1拉曼峰进行校准, 使每次测试都在相同的条件下进行。 本次实验从46位鼻咽癌患者、 30位鼻炎患者和48位健康人的唾液样本中采集了208条高质量的SERS, 然后除去每条SERS的荧光背景, 把光谱归为三类, 分别取自为鼻咽癌患者、 鼻炎患者和健康人。 图2(a)是三类样品的SERS的平均光谱。
图2(a)可观察到三组唾液SERS光谱在447, 496, 590, 635, 725, 810, 889, 1 004, 1 052, 1 136, 1 204, 1 270, 1 135, 1 445, 1 615, 1 662 cm-1的特征峰。 但是, 鼻咽癌、 鼻炎和正常人之间的唾液SERS谱峰强度却有着明显的变化, 差谱图2(b)可直观地表现出这些变化。 其中鼻咽癌和鼻炎的SERS差谱与鼻咽癌和正常人的SERS差谱非常相近, 但是比较鼻炎和正常人鼻咽癌患者的唾液SERS又有明显的区别。 鼻咽癌的唾液SERS光谱在447, 729, 1 004, 1 052和1 270, 1 445 cm-1信号更强于鼻炎患者和正常人的SERS强度。 与鼻咽癌患者的SERS强度相比, 鼻炎患者和正常人在496, 635, 1 134和1 662 cm-1有更强的拉曼信号。
这些主要峰强度的变化, 说明鼻咽癌患者、 鼻炎患者和健康志愿者唾液的生化成分发生变化, 表2列出唾液SERS光谱的谱峰位置与相应的物质归属[1, 10, 19, 20, 21, 22]。 我们小组在血浆SERS光谱研究中, 发现了宫颈癌患者苯丙氨酸和色氨酸的峰强高于健康志愿者[23], 结肠癌患者L-酪氨酸和核酸的峰强低于腺瘤性息肉患者和健康志愿者[24]。 相关文献也表明, 位于1 445 cm-1 SERS峰被认为是诊断癌症的特征峰[10]。 唾液中某些特定生化成分的差异表明唾液SERS分析有希望发展为一种无损筛查鼻咽癌的临床诊断工具。
| 表2 SERS谱峰的振动模式与谱峰归属 Table 2 SERS peak positions and tentative vibrational mode assignments |
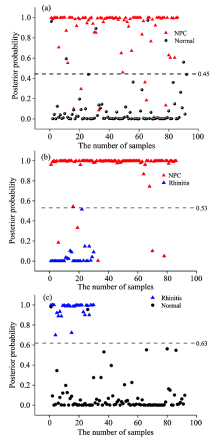
以上分析是简单的峰强度分析, 只利用了SERS峰的有限信息, 为了进一步挖掘唾液SERS光谱存在的全部信息。 我们利用PLA-LDA诊断算法来提高唾液SERS技术检测鼻咽癌的效能。 PCA-LDA诊断算法已经被广泛于各种人体样本的拉曼光谱分析(例如组织、 血液等)。 在SPSS 15.0软件中, PCA可以将鼻咽癌、 鼻炎和正常唾液高维光谱数据进行降维处理(其中将鼻咽癌SERS和鼻炎SERS、 鼻咽癌SERS和健康SERS、 鼻炎SERS和健康SERS分别归为三类进行降维处理), 再对计算出来的所有PC进行独立变量T检验, 从这些主成分中选择最具有显著性差异的3个PC(p< 0.05), 进一步利用线性判别分析(LDA)建立诊断算法模型。 经过PCA-LDA多元统计分析算法后的概率分布显示, 在图3(a), (b), (c)中当诊断线所对应的概率分别为P=0.45, P=0.53和P=0.63时, 可获得最佳的诊断灵敏度分别为89.5%, 93.0%和100%; 最佳的特异性分别为94.6%, 96.7%和97.7%。
为了进一步验证唾液SERS光谱结合PCA-LDA算法的效能, 我们利用ROC曲线(receiver operating characteristic curve)对其进行评价。 ROC曲线指受试者工作特征曲线是用纵坐标表示灵敏度和横坐标表示1-特异性的线性关系, 每个灵敏度都有与之相对应的特异性, 并且只有ROC曲线下的面积值大于0.5(AUC> 0.5)才有诊断意义, AUC越临近1, 说明诊断效果越好。 图4(a), (b), (c)分别是鼻咽癌SERS和鼻炎SERS、 鼻咽癌SERS和健康SERS、 鼻炎SERS和健康SERS三类的ROC曲线图, ROC曲线面积分别为0.977, 0.991, 0.993。 这些结果进一步说明了唾液SERS光谱结合PCA-LDA诊断算法技术对于鼻咽癌的检测具有较高的诊断能力。
利用基于银纳米粒子的SERS技术开展鼻咽癌患者唾液检测研究。 鼻咽癌患者唾液与健康人唾液、 鼻咽癌与鼻炎患者唾液、 鼻炎患者与健康人唾液的SERS光谱存在明显的差异, 这些差异主要由人体病变时体内蛋白质和核酸的总量发生变化而引起, 而PCA-LDA多元诊断统计方法能区分判别鼻咽癌患者、 鼻炎患者和正常人的唾液SERS光谱数据, 并给出较高的诊断准确性。 结果表明: SERS技术结合PCA-LDA多元统计方法有可能快速、 有效地区分鼻咽癌、 鼻炎与正常人的唾液样本。 该方法的进一步探索有望发展成为鼻咽癌临床诊断与筛查的辅助新工具。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|