作者简介: 高 浩, 1991年生, 南京航空航天大学自动化学院硕士研究生 e-mail: Gao_Hao@live.com
为探讨原位条件下关节软骨及下骨组织成分含量变化等深层次微观信息, 采用拉曼光谱技术结合组织光透明技术来研究软骨组织的光透明效果。 选用甘油、 碘海醇作为光透明剂, 对在不同光透明剂浓度和浸渍时间下的犬膝关节股骨端软骨样本进行拉曼光谱采集。 通过计算磷酸基团(920~960 cm-1 ) 和酰胺Ⅰ带(1 595~1 700 cm-1)的积分强度, 获得拉曼强度比(磷酸基团/酰胺Ⅰ), 探索在不同浸渍时间(10~60 min)、 不同浓度下(甘油40%, 60%, 80%和100%, 碘海醇50, 150, 250和350 mg·mL-1)组织光透明的规律, 即寻找合适的透明浓度和透明时间。 结果显示: 相比于无透明剂情形, 两种透明剂均使该强度比信号增强。 在同一时间范围内, 甘油和碘海醇分别在60%和150 mg·mL-1 浓度下能获得较好的透明效果; 而在不同浓度下, 甘油的透明效果均在20 min最强, 而碘海醇的透明效果一般是在50 min后开始增强。 在光透明剂的作用下激发光透过软骨可以直接探测到软骨下骨的拉曼光谱信息, 这为研究骨关节炎深层次病因提供了方法和思路。
To investigate deeper microscopic information of articular cartilage and subchondral bone components in situ, Raman spectroscopy combined with tissue optical clearing technique was used to study the clearing effect of articular cartilage. Raman spectra of the cartilage adhered on femur ends in canine knees were collected after they were impregnated at different time and different concentrations of clearing agents, glycerol and iohexol. The integrated Raman intensity ratio of phosphate group (920~960 cm-1) to the amide Ⅰ band (1 595~1 700 cm-1) was obtained to seek the rule of tissue optical clearing at different impregnating time (10~60 min) and different concentrations of clearing agents (40%, 60%, 80% and 100% for glycerol, 50, 150, 250, 350 mg·mL-1 for iohexol), which is to get the optimum concentration and time. It was found that the both agents could enhance the Raman signal compared to the case of no clearing agent. With equal time for impregnating, glycerol and iohexol were able to obtain good results at 60% and 150 mg·mL-1, respectively. Under different concentrations, the clearing effect of glycerol was the strongest in 20 min, while that of iohexol was enhanced after 50-min impregnation in general. In conclusion, the Raman scattering information of subchondral bone can be directly detected when the clearing agents penetrating through cartilage, which will provide a novel way and a potential solution into study on osteoarthritis etiology in depth.
目前, 骨关节炎(osteoarthritis, OA)的病理学组织评估被认为是确定骨关节炎存在和严重程度的黄金标准[1]。 病理学属于形态学科, 现今的研究手段超出传统的形态学观察。 病理学组织评估是对组织切片形态学观察的主观描述。 组织切片用染料染色以显示分子的存在或不存在, 如Safranin-O被用作关节软骨中蛋白聚糖分子的染色剂, 该技术应用于实验室以及临床检查。 但组织病理学也有缺点: 侵入性和样品间的变异性会引入误差[2]。 如今经常使用成像方式(例如X-Ray, CT, MRI, 超声)为临床提供独特且互补的信息[3], 然而这些方式未能在分子水平上提供有关细胞及基质生化成分的关键信息。 软骨内生物化学变化虽可以与临床中的宏观特征相关联, 但这些宏观特征在疾病的早期阶段却难以以常规手段有效观察到, 即缺乏可以在疾病早期阶段检测分子水平变化的有效技术。
近年来发展起来的光谱技术, 如红外[4]与近红外光谱[5], 荧光光谱[6], 拉曼光谱[7]等, 已经应用于研究关节软骨内生化成分和相关分子的化学环境。 拉曼光谱是该领域的新兴应用, 它能够非侵入性地分析软骨组织, 且不受组织当中水的影响[8]。 本研究旨在进一步发展该技术的应用, 开拓临床和基础研究思路。
在骨关节炎早期阶段, 会发生软骨下骨受力改变, 引起代偿性骨重塑, 矿化程度增加, 形成骨赘、 骨刺等结构, 这些变化继而引发关节软骨损伤, 或者先于关节软骨退变[9]。 生物组织具有自体荧光和高散射特性, 高散射性限制光在组织中的穿透深度, 使得传统拉曼只能检测到组织的表层区域。 光透明技术(optical clearing)的提出能够在某种程度上解决上述两个问题[10]。 Ghosh等[11]使用光透明技术结合荧光显微成像进行OA严重程度的原位表征, 而不需要依靠传统的组织切片。 Bykov等[12]采用光学相干断层成像技术结合光透明技术可明显地分辨出软骨和软骨下骨界线, 而该界线的厚度跟早期骨关节炎症状有相关性。 Morris等[13]将甘油涂抹在鼠胫骨端皮表面后采集拉曼光谱。 相比与未加透明剂情形, 皮肤下方的骨组织拉曼信号得到有效提高。 且与采集骨头暴露时的信号情况下存在相关性, 说明透明剂的加入可以直接获得经皮下拉曼光谱。 骨关节炎病程中, 对于软骨下骨与关节软骨病变先后顺序依旧存在争议。 以往很多研究探讨了两者病变发生的先后关系, 但最终得到不一致的结论, 主要在于不能从整体上研究软骨与软骨下骨相互病变过程。 拉曼光谱技术与光透明技术结合则可研究关节软骨和软骨下骨之间交互作用, 即骨-软骨处分子变化。 为临床骨关节炎的诊断治疗提供新的思路, 也为目前骨关节炎药物研究提供新的作用靶点。
软骨样本来自有轻微关节功能退变的两条比格犬(江苏亚东动物研究院, 动物伦理委员会许可)。 选取膝关节股骨端软骨样本(软骨表面完整性较好), 编号分别为S1和S2。 透明剂分别采用甘油和碘海醇。 甘油购自国药集团化学试剂有限公司, 纯度> 99.9%(分析纯), 分别配置浓度100%, 80%, 60%和40%各45 mL。 碘海醇, 由通用电气药业(上海)有限公司提供, 规格350 mg· mL-1(常以碘含量表征浓度), 分别配置规格350, 250, 150和50 mg· mL-1各45 mL。
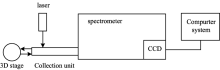
实验所用拉曼光谱仪是本实验室自行搭建的拉曼光谱系统[14], 结构示意图见图1, 包括785 nm激光器(IPS)、 制冷型CCD检测器(Andor)、 信号收集单元、 三维移动平台、 计算机, 拉曼光谱仪(光栅(Newport)刻痕密度1 200 lp· mm-1, 狭缝(Thorlab)50 μ m)。 光谱扫描范围为500~2 200 cm-1, 分辨率为3 cm-1。
S1实验组中, 右后腿股骨端膝关节整体软骨沿中线剖开后分别浸渍在80%和100%浓度的甘油溶液中, 左后腿股骨端同样位置剖分后顶端软骨分别浸渍在40%和60%浓度甘油中, 每隔十分钟后取出, 取12个点进行采集(后取平均值), 浸渍计时60 min。 S2实验组与S1实验组操作相同, 其中50和150 mg· mL-1的碘海醇溶液用于左腿股骨端软骨, 250和350 mg· mL-1用于右腿股骨端软骨, 计时60 min, 时间间隔为10 min。 样品置于三维样品平台上室温下进行光谱采集, CCD曝光时间20 s。
相应的背景扣除和光谱采集是在CCD自带Andor Solis软件下完成。 采用Vancouver Raman Algorithm 软件[15]对光谱进行荧光背景分离; 由Origin Pro软件进行10点平滑处理(五次多项式)并计算相应拉曼带面积。 采用特征带强度比(磷酸基团与酰胺Ⅰ 带积分面积比值)来定性表征软骨内矿物质与有机组分的变换及光透明效应[16]。
图2给出了在350 mg· mL-1下碘海醇浸渍60 min后测得的关节软骨平均光谱图(波数范围800~1 750 cm-1)。 图中标记了主要的矿物质和有机物的谱带: 1 250~1 320 cm-1(代表酰胺Ⅲ ), 1 600~1 700 cm-1(代表酰胺Ⅰ ), 1 400~1 470 cm-1(代表亚甲基团), 而磷酸基团(P
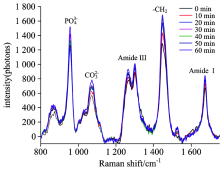 | 图2 以350 mg· mL-1碘海醇浸渍不同时间的关节软骨样本的平均光谱图注: 0 min表示未加透明剂情况下, 下同Fig.2 The average spectra of cartilage impregnated with 350 mg I· mL-1 iohexol for different time |
2.1.1 碘海醇浸渍时间的影响
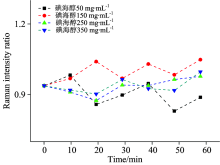
图3所示的是在不同碘海醇浓度下特征峰拉曼强度比(即磷酸基团峰与酰胺Ⅰ 峰的积分面积比值)随浸渍时间的变化趋势, 并以此矿物质与有机物特征峰面积比值来反应光透明效果。 由图可得, 在50 min内光透明效果不明显, 总体上强度比值较未加透明剂之前低或变化不大, 尔后增大, 透明效果明显。 生物组织散射强以致激发光穿透深度浅, 拉曼强度比不明显。 生物医学光子学已理论证实生物组织高散射性是源于散射颗粒与背景介质光学折射率不匹配[17]。 这其中散射颗粒就包括细胞和细胞器等(折射率1.39~1.42[18]), 背景介质则主要有细胞间液和内液两种组分(折射率1.34~1.36[18])。 由复合介质折射率的Gladstone-Dale定律[19], 碘海醇(折射率1.45[12])进入软骨基质后可视为软骨细胞间液, 与软骨基质折射率1.35不匹配, 导致50 min内拉曼强度比轻微波动。 通过50 min平衡后, 碘海醇浸入软骨基质使其折射率得到匹配, 拉曼强度比增高。 软骨内基质主要由蛋白多糖与胶原纤维组成, — CH2基团特征峰强度除了来自蛋白多糖和胶原蛋白外主要来源于松质骨[20], 经光透明过后的软骨拉曼光谱中— CH2基团特征峰强度的增长明显快于磷酸基团特征峰, 见图2所示。 以上结论表明经碘海醇的光透明效应, 激发光可经关节软骨(厚度约1 mm)探测到软骨下的松质骨, 说明碘海醇光透明效果能达到软骨下骨; 也说明随着时间的延长, 软骨光透明效果逐渐变好。 同时从另一方面也暗示了— CH2基团特征峰强度变化也可作为碘海醇光透明效果检测的另一手段。
由图3还可观察到: 0 min时, 即无透明剂作用时, 各浓度碘海醇即将浸渍的位置所测拉曼强度比相当。 经过透明50 min之后, 150 mg· mL-1条件下拉曼强度比明显最高; 350 mg· mL-1条件下的比250和50 mg· mL-1下的略大, 250 mg· mL-1条件下比50 mg· mL-1下的略大。 由此可知, 在整个浸渍时间范围内, 150 mg· mL-1碘海醇使软骨透明程度提高, 以致软骨内绝对探测深度较深, 从而该比值增大[21]。
碘海醇是常用于临床的一种非离子型造影剂, 含碘量约40%, 渗透压和粘稠度与血浆接近。 主要分布在间质腔中, 也不被吸收和代谢, 测不到任何代谢产物光谱。 高浓度碘海醇的高渗透压可能使组织脱水, 导致软骨细胞与软骨基质间折射率匹配更好以致组织散射性降低[10], 光透明效果也更好。 当激发光能穿透软骨抵达钙化区及软骨下骨, 该区域磷酸基团特征峰较强[22], 故拉曼强度比值也越高。
以上两个方面研究说明经较高浓度碘海醇作用后, 激发光可探测到软骨下骨, 但是150 mg· mL-1浓度碘海醇透明剂获得透明效果更佳。
2.2.1 甘油浸渍时间的影响
图4所示的是在不同甘油浓度下特征峰拉曼强度比随浸渍时间的变化趋势。 从图可以看出, 加入甘油后拉曼强度比迅速增大, 说明甘油能增强拉曼强度比信号, 并在第20 min时拉曼强度比(光透明效果)达到最强。 20 min后拉曼强度比减弱, 这可能和甘油与软骨组织的相互作用方式有关。 甘油分子的— OH基团能够较快与胶原分子形成氢键(并达饱和稳定), 破坏了胶原-胶原间的连接氢键, 使胶原纤维解离, 被破坏后的氢键与甘油的— OH 结合形成水分子, 使得软骨脱水收缩并实现折射率的匹配, 厚度变薄[23, 24]和组织光透明, 最终使激发光能穿透软骨区(磷酸基团特征峰强度较低)到达钙化区及软骨下骨(磷酸基团特征峰强度高), 因此拉曼强度比增强。 软骨收缩后组织间隙变得紧凑, 激发光和信号穿过软骨区域几率变小, 所以在20 min后的拉曼强度比出现了轻微降低。 更高浓度的甘油粘度高则难于被吸收, 透明效果反而较不明显。
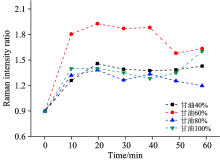 | 图4 不同甘油浓度下拉曼强度比(P |
2.2.2 甘油浓度的影响
由图4还可见, 甘油浓度为60%时, 磷酸基团峰与酰胺Ⅰ 的拉曼强度比最高, 获得的透明效果最好。 40%浓度甘油使软骨的透明效果稍好于100%浓度。 由于甘油是中间代谢产物, 低浓度的甘油可能被吸收, 从而更容易改变软骨细胞与软骨基质、 软骨细胞基质的折射率, 使得软骨内散射颗粒与背景介质折射率匹配更快, 从而在60%浓度下实现最佳的软骨光透明效果。 对于80%浓度的甘油, 不被组织吸收导致可能需要更长的作用时间完成折射率匹配从而实现软骨光透明。
以上研究可见, 不同的透明剂对软骨光透明的影响是不同的。 高浓度的甘油、 碘海醇的软骨光透明效果不一致。 碘海醇自身粘度低, 较高浓度下, 其光透明效果会较好[24], 且组织不易变形。 高浓度的甘油由于固有的高粘度则限制了其对组织的渗透, 导致其光透明效果减弱。 在加入甘油和碘海醇的60 min之内, 两者透明效果有相反趋势, 甘油会较快增强软骨透明效果, 碘海醇则在60 min内透明效果稍有波动。 共同之处则是透明剂所具有的渗透特性导致软骨组织脱水, 此时的甘油或碘海醇取代了低折射率的软骨基质液, 使软骨中各种成份折射率得到匹配, 降低散射, 从而提高了软骨的光透明效果。
本研究同时考虑到透明剂自有光谱对测量结果的影响。 经拉曼光谱检测发现, 碘海醇试剂的特征拉曼峰并没有出现在其浸渍的软骨组织的拉曼光谱中, 而甘油试剂特征峰则出现在824, 855和1 469 cm-1。 为了尽量减少光透明剂对样品光谱数据造成特征峰误判, 光谱分析选用磷酸基团和酰胺Ⅰ 特征带来进行数据分析[21]。 磷酸基团特征带最早出现是在钙化区, 如果加入光透明剂之后就能获得更强的磷酸基团特征带, 就此可判定激发光到达钙化区及以下的软骨下骨。 另一方面, 也是为了避免每次光谱采集过程中可能出现的激发光照射或聚焦平面位置的偶然误差[16], 实验分析采用了同一测量谱线中磷酸基团和酰胺Ⅰ 的特征峰积分强度比来表征光透明效果。
采用拉曼光谱中无机物与有机物拉曼强度比, 探究了不同光透明剂的透明规律, 发现了光透明剂使软骨组织达到最佳光透明状态的最适浓度和最适浸渍时间。 在60 min作用时间内, 对于甘油, 60%为最适浓度, 20 min为最适浸渍时间; 对于碘海醇, 350 mg· mL-1为最适浓度, 60 min为最适浸渍时间。 且根据此次实验得出的实验结果来看, 碘海醇的透明效果可达软骨下骨附近, 但时间较长, 而甘油在20 min就能使软骨透明且明显。 总之在光透明剂的作用下, 可透过软骨直接探测到得软骨下骨的拉曼光谱信息, 这为深度研究骨关节炎在软骨和软骨下骨之间的致病因果变化关系提供了崭新的思路和方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|