作者简介: 谢凤英, 女, 1975年生, 东北农业大学食品学院讲师 e-mail: spxfy@163.com
黑米花色苷易受外部环境影响发生降解致使局部分子结构破坏而使营养价值和保健功能有所下降。 利用有机酸提供酰基对黑米花色苷进行修饰来提高花色苷结构的稳定性。 利用红外光谱分析经咖啡酸酰化修饰黑米花色苷的结构变化。 结果表明: 黑米花色苷酰化修饰前后于官能团区3 650~3 200和1 680~1 620 cm-1处均有吸收峰, 且其于指纹区1 282.68和1 277.51 cm-1处出现酚羟基吸收峰, 于1 056.07和1 054.03 cm-1处出现醇羟基吸收峰, 719.90和719.71 cm-1处出现苯环上C—H面外弯曲振动吸收峰。 由此可见, 黑米花色苷酰化修饰后主要结构框架仍为花色苷的芳环结构。 此外, 黑米花色苷酰化修饰前后于1 900~1 650 cm-1间1 714.28和1 728.13 cm-1处均出现共轭羰基的特征吸收峰, 对应于可直接连接在苯环上的α-羰基结构, 由此说明黑米花色苷结构中存在着酰基基团。 黑米花色苷经酰化修饰后红外图谱于1 517.20 cm-1处出现新吸收峰, 其正好处于1 800~900 cm-1双键(不含氢)伸缩振动区, 指纹区876.65 cm-1处亦出现了苯环上的C—H面外弯曲振动吸收峰。 与之相呼应在经二阶导数处理后红外光谱图中在2 500~2 000 cm-1间出现了新的波动, 此波段为累积双键伸缩振动区, 而官能团区3 650~3 200 cm-1间3 370.20 cm-1处的吸收峰正好处于多分子缔合区。 由此可见, 在咖啡酸作为酰基供体, 酰化修饰黑米花色苷时由于分子间的重新缔合于结构中引入了新的酰基基团而呈现出一种双酰化的空间结构。 黑米花色苷酰化结构中有机酸与糖链相连, 将有机酸置于2-苯基苯并吡喃骨架的表面, 这种堆积作用模式可以较好地抵抗水的亲核攻击和其他降解反应进而提高黑米花色苷结构的稳定性。
The black rice anthocyanins are vulnerable to degradation due to the external environment, resulting in the destruction of local molecular structure, which reduces the nutritional value and health function. The stability of anthocyanin structure was improved by modifying anthocyanins with acyl groups provided by organic acids. The structural changes of anthocyanins modified by caffeic acid acylation were analyzed with Fourier transform infrared spectroscopy (FTIR). The results showed that the absorption peaks of functional group in 3 650~3 200 and 1 680~1 620 cm-1 were the same between both before and after anthocyanins modified, the phenolic hydroxyl absorption peak appeared in the fingerprint area of 1 282.68, 1 277.51 cm-1, and the alcoholic hydroxyl absorption peak appeared at 1 056.07, 1 054.03 cm-1, the absorption peak of C—H surface bending vibration in benzene ring appeared at 719.90 and 719.71 cm-1. It can be seen that the major structural framework of acylated black rice anthocyanins is still the aromatic ring structure of anthocyanins. In addition, the characteristic absorption peaks of conjugated carbonyl all appeared at 1 714.28 and 1 728.13 cm-1 in the area of 1 900~1 450 cm-1 both before and after the modification of anthocyanins, which corresponded to α-carbonyl structure in benzene ring, thus indicating the presence of acyl groups in the structure of the black rice anthocyanins. The new absorption peaks of modified anthocyanin appeared at 1 517.20 cm-1 in the infrared spectrum, which is right located in the stretching vibration zone of 1 800~900 cm-1 double bond (no hydrogen), the absorption peak of C—H surface bending vibration in benzene ring appeared at 876.65 cm-1 in the fingerprint region. At the same time, new fluctuations were observed at 2 500~2 000 cm-1 in the infrared spectrum after the second derivative treatment, which is the cumulative double bond stretching vibration region. The absorption peak of functional group at 3 370.20 cm-1 between 3 650~3 200 cm-1 is located in the multimolecular association region. It can be seen that when caffeic acid is used as acyl donor, the acylated modified black rice anthocyanins present a double acylated spatial structure due to the re-association of the molecules with the introduction of new acyl groups in the structure. The organic acid was linked to the sugar chain in the structure of black rice anthocyanin, and it was placed on the surface of 2-phenyl benzo pyran skeleton. This stacking model can resist water nucleophilic attack and other degradation reactions, which can improve the stability of black rice anthocyanin structure.
黑米花色苷是由花青素与一个或多个葡萄糖、 鼠李糖、 半乳糖等通过糖苷键连接以糖苷形式存在于果皮和种皮中黄酮类物质。 花色苷色调丰富, 可作为天然着色剂或膳食功能因子应用于医药、 食品加工等领域[1, 2, 3, 4]。 花色苷易受外部条件影响发生降解致使局部分子结构破坏而使营养价值和保健功能有所下降。 因此, 花色苷稳定性的研究成为花色苷应用领域的热点问题之一[5]。 目前, 花色苷稳定性提高的途径有辅色作用、 结构修饰、 生物工程技术及封装技术等。 其中结构修饰方法中酰基化修饰有机酸提供酰基出现于花色苷结构中可阻止花青素从红色的黄盐阳离子水解成无色的查耳酮或蓝色的醌酮, 进而提高花色苷的稳定性。 此外, 从花色苷被肠道微生物降解的产物来看, 花色苷在人体内起抗氧化等生理活性作用的主要物质为酚酸等小分子的花色苷代谢产物[6, 7]。 由此可见, 黑米花色苷酰化修饰引入到花色苷结构中酰基在花色苷代谢过程中会提高酚酸类代谢产物含量进而提高黑米色苷生物活性。 在酰化修饰过程中, 酰基的性质、 数目和结合位置都将对花色苷稳定性产生不同影响。 因此, 具有高度特征性、 取样量小、 简便快捷的红外光谱(FTIR)在花色苷分子结构和化学键类型鉴定方面就体现出自身的优势。 例如, Jantasee和Ozturk等[8, 9]分别对黑米和饮料中的花色苷组分进行了红外光谱分析并建立了较为可靠的快速检测方法。 可见花色苷结构中引入新的基团时, 在掌握该化合物红外特征吸收谱带的基础之上, 按峰区指认各谱带的归属并结合指纹区的有关谱带, 建构出该化合物新引入基团的结构是可行的。
研究旨在探讨利用红外光谱的宏观指纹特征对酰化修饰黑米花色苷结构进行分析, 进而探明黑米花色苷酰基结构修饰与稳定性之间的相关性为黑米花色苷在食品加工领域稳态化利用提供理论依据。
称取10.0 g经万能粉碎机粉碎过60目筛黑米粉于烧杯中, 按料液比1:10 g· mL-1加入70%乙醇溶液, 于55 ℃条件下搅拌提取3.5 h, 离心, 取上清液浓缩、 冻干即为黑米花色苷样品。
精确称取0.015 g黑米花色苷冻干样品, 花色苷与咖啡酸以质量比1:5混合, 溶于10 mL, 70%乙醇溶液中, 超声振荡10 min充分溶解后, 于45 ℃条件下水浴5.0 h进行酰化反应, 反应中止干燥后以不加咖啡酸花色苷为空白组, 进行红外光谱分析。
Spectrum GX型傅里叶变换红外光谱仪(美国PerkinElmer公司), DTGS检测器, 光谱范围为4 000~400 cm-1, 分辨率2 cm-1, 扫描信号累加次数为32次, 扫描时扣除了水和二氧化碳的干扰。 二阶导数谱是取原始谱图各点的二阶导数, 以13点平滑处理获得。
取适量的黑米花色苷和酰化修饰花色苷粉末, 与溴化钾均匀混合压片后, 利用红外光谱法对酰化修饰黑米花色苷进行结构分析。
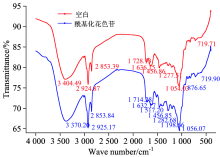
黑米花色苷酰化修饰红外波谱如图1所示。 谱峰及谱峰的指认见表1。 从中我们可以看出, 酰化修饰花色苷和黑米花色苷于官能团区3 650~3 200 cm-1间在3 370.20和3 404.49 cm-1处有宽且强的吸收峰, 对应于花色苷结构中的糖基及芳香环酚结构中的大量羟基, 由于羟基间氢键的形成致使红外吸收峰波数下降形成宽峰[10]。 与此相对应1 300~650 cm-1指纹区于1 282.68和1 277.51 cm-1存在酚羟基, 于1 056.07和1 054.03 cm-1处出现醇羟基吸收峰。 在波长1 680~1 620 cm-1间于1 632.17和1 636.15 cm-1处出现苯环骨架振动吸收峰, 相对应于900~650 cm-1间719.90和719.71 cm-1处出现苯环上C— H面外弯曲振动吸收峰。 由此可见, 黑米花色苷酰化修饰后主要结构框架仍为具有各种类型取代基的花色苷芳环结构。 此外, 从图中我们可以看出酰化修饰前后的黑米花色苷于1 900~1 650 cm-1间1 714.28和1 728.13 cm-1处均出现共轭羰基的特征吸收峰, 对应于可直接连接在环上的α -羰基或醌式结构。 由此证实了黑米色素中除花色苷成分外还含有酚酸。 与空白对照红外波谱图比较发现, 黑米花色苷酰化修饰后在碳氧双键的伸缩振动范围1 900~1 650 cm-1间1 517.20 cm-1处出现一个新的吸收峰, 且该吸收峰处于1 800~900 cm-1双键(不含氢)伸缩振动范围, 与此相对应在900~650 cm-1指纹区876.65 cm-1处出现苯环上的C— H面外弯曲振动吸收峰, 基于这些数据推测咖啡酸对黑米花色苷酰化修饰在未破坏原花色苷基本结构基础之上, 可能于花色苷芳环结构中引入酰基基团使其呈现出双酰化空间结构, 为进一步加以确认对酰化修饰黑米花色苷红外波谱求二阶导数。
| 表1 黑米花色苷的红外光谱特征峰 Table 1 Characteristic peaks of infrared spectra of black rice anthocyanins |
经二阶导数处理后红外光谱图中特征吸收峰差异将进一步扩大并可消除因吸收峰叠加而引起的误差, 利于进一步验证花色苷酰基化后分子结构发生的变化, 使试验结果更加直观明显。
 | 图2 黑米花色苷酰化修饰红外光谱二阶导数谱图Fig.2 Secondary derivative FTIR spectra of acylated modified black rice anthocyanins |
从酰化修饰黑米花色苷二阶导数波谱图中我们可以看出, 酰化修饰黑米花色苷的二阶导数曲线与空白对照相比, 在2 500~2 000 cm-1间出现了新的波动。 结合图1可知此波段为累积双键伸缩振动区, 而其官能团区3 650~3 200 cm-1间3 370.20 cm-1处的吸收峰正好处于多分子缔合(多聚体)区。 由此可见, 在咖啡酸作为酰基供体, 酰化修饰黑米花色苷时由于分子间的重新缔合于结构中出现了Yoshida等[11]所证明的“ 三明治” 结构。 此酰化花色苷结构中有机酸与糖链相连, 将有机酸置于2-苯基苯并吡喃骨架的表面, 这种堆积作用可以较好抵抗水的亲核攻击和其他降解反应。 从化学结构来看, 黑米花色苷组成中矢车菊素-3-葡萄糖苷、 矢车菊素-3-槐糖苷、 矢车菊素-3-阿拉伯糖苷和芍药素-3-半乳糖苷、 芍药素-3-阿拉伯糖苷均为3-O-糖基化, 它是黑米花色苷进一步修饰的前提物质基础, 这种修饰作用有助于提高花色苷结构的稳定性。 因此, 酰化花色苷中有机酸能有效地保护花色苷母核阳离子免受水分子的攻击而失色, 可在较广pH范围内表现出极强的稳定性[12, 13]。
利用红外光谱结合二阶导数波谱图对化学修饰后花色苷结构进行鉴定时, 可在掌握花色苷红外特征吸收谱带的基础之上, 按峰区指认各谱带的归属并结合指纹区的有关谱带, 即可构建出新引入基团的结构。 此时, 红外光谱法可以对花色苷修饰物的结构进行快速、 准确、 有效的鉴别。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|