作者简介: 陈 婧, 1993年生, 中国科学院青海盐湖研究所硕士研究生 e-mail: 343403540@qq.com
利用甘露醇法测定硼、 双指示剂法测定总碱度, 同时借鉴血清中HC
Basingthe titration to analyze the total boron, total alkalinityand made references to the determination of serum bicarbonate, we have developed a new method by combining UV spectrophotometry and titration to determine C
青藏高原富硼锂盐湖卤水中硼酸盐、 碳酸盐和碳酸氢盐的分析一直沿用甘露醇滴定法和双指示剂法。 双指示剂法是测定混合碱的主要方法之一[1], 该方法简单实用, 是实际生产和研究中经常用到的一种分析方法, 广泛应用于不含硼或硼为微量元素的盐湖卤水碱度-C
鉴于含硼体系中C
本文对以酚红为显色剂分析总碳浓度的分光光度法进行了显色剂用量、 pH、 显色体系稳定性、 显色反应温度等测试条件较为详细的研究, 确定了分光光度法测定含硼盐卤体系中C
通过对比不同分析方法所得到的结果发现: 化学滴定是根据酸碱反应的原理, 所得结果可以准确得出含硼碳酸盐卤水中的总碱浓度AT[如式(1)]; 由甘露醇法可以准确分析出样品中c(B2O3)(总硼浓度); 酚红分光光度法所测得结果为总碳浓度cT[如式(2)], 基于AT和cT的差异, 即可求出C
分光光度法中所用的显色剂酚红是一种弱有机酸, 其酸型(HIn)呈黄色, 碱型(In-)呈红色, 通过实验发现, 碱型(In-)吸收峰吸光度值与HC
TU-1910紫外-可见分光光度计(北京普析通用仪器有限责任公司); BSA2245s-CW型电子天平(北京赛多利斯仪器系统有限责任公司); 数显恒温水浴锅(上海双舜实业有限公司); S975 Seven Excellence pH测量仪(梅特勒-托利多公司)。
基准Na2CO3溶液: 将基准Na2CO3在300℃下烧至恒重后, 置于硅胶干燥器中冷却, 准确称取15.990 0 g, 用水溶解并转入100 mL容量瓶中定容、 摇匀, 得到浓度为1.00 mol· L-1的Na2CO3储备液, 用时稀释至所需浓度。
酚红溶液: 称取0.209 4 g酚红, 用热水溶解并转入100 mL容量瓶中, 待冷却后定容、 摇匀, 得到浓度为5.6 mmol· L-1(0.2%)的显色剂。
磷酸氢二钠-磷酸二氢钾缓冲溶液(PB缓冲溶液): 称取9.08 g磷酸二氢钾, 加水溶解, 稀释到1 000 mL, 混匀; 称取9.47 g无水磷酸氢二钠, 加水溶解, 稀释至1 000 mL, 混匀; 按比例混合磷酸二氢钾溶液和磷酸氢二钠溶液, 至pH为8.4左右。
Tris缓冲溶液: 在注入约500 mL水的1 000 mL容量瓶, 溶入6.057 g三羟甲基氨基甲烷和0.5 g苯酚, 再用蒸馏水稀释至刻度, 用盐酸(6M)调节pH至8.4左右。
硼砂-盐酸缓冲溶液: 称取76.2 g硼砂, 加水溶解。 稀释至1 000 mL, 混匀即得0.2 mol· L-1硼砂溶液; 吸取8.3 mL浓盐酸与预先盛有适量水的1 000 mL容量瓶中, 用水稀释至刻度, 混匀; 按比例混合硼砂溶液和盐酸溶液至pH为8.4左右。
盐酸标准溶液(0.05 mol· L-1): 准确移取22.5 mL浓盐酸(12 mol· L-1)于5 L广口瓶中, 加水, 摇匀备用, 其浓度用0.039 7 mol· L-1基准Na2CO3溶液进行标定。
氢氧化钠标准溶液(0.02 mol· L-1): 准确吸取5.4 mL饱和NaOH溶液, 用无CO2的水稀释至5 L, 摇匀备用, 其浓度用0.030 8 mol· L-1邻苯二甲酸氢钾基准溶液进行标定。
实验中所用试剂均为分析纯(除Na2CO3为基准试剂)。 实验用水均为除过CO2的二次水, 电阻率大于17 MΩ · cm。
采用试剂空白为参比溶液, 用1 cm石英比色皿进行所有实验, 对Na2CO3和NaHCO3溶液进行光谱扫描以确定最大吸收波长。 以6 mmol· L-1基准Na2CO3溶液为样品, 分别研究被测溶液体系的吸光度值随显色剂的用量、 缓冲溶液种类的变化, 同时考察了温度、 酸度及共存离子对本方法的影响。
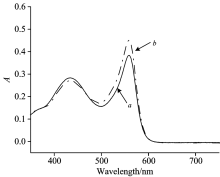
对2 mmol· L-1 Na2CO3溶液和2 mmol· L-1 NaHCO3溶液进行光谱扫描, 其吸收光谱如图1所示。 由图可知, 以酚红为显色剂时, 最大吸收波长与溶液中无机碳的存在形式无关, 均在558 nm处; 随着波长增加至700 nm处时, 吸光度趋于零, 因此在实验过程中, 选择主波长为558 nm, 基线波长为700 nm。
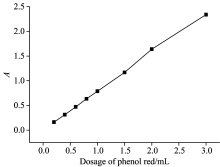
当显色剂酚红用量过少时, 体系作用不完全, 吸光度值过低; 随着酚红用量增加, 吸光度逐渐增大, 1 mL以内吸光度值与酚红用量呈线性增加(如图2); 酚红用量过大, 空白值增大, 误差增加。 综合仪器稳定性、 实验误差, 本实验选择5.6 mmol· L-1(0.2%)酚红溶液用量1 mL。
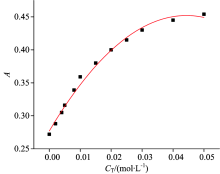
从图1可看出在最大吸收波长处, 浓度相同的Na2CO3溶液吸光度值大于NaHCO3溶液吸光度值, 为确定这种差异原因, 测定了不同pH条件下酚红水溶液吸光度值, 结果如表1所示。 从表1数据可知: 558 nm处酚红水溶液吸光度值随pH增大而增大, 当pH≤ 7时, 酚红在558 nm处无吸收, 此时吸光度基本为0; 当pH≥ 10时, 吸光度受pH影响很小; pH在6~10范围内酚红水溶液吸光度值受pH影响较大。 随后测定了一系列浓度的Na2CO3溶液在不同pH下吸光度值的变化, 结果如图3所示。 由图3可知: 随着pH值增加, 吸光度值变化随cT变化越来越小; 当pH大于10时, 溶液中的碳酸盐均以C
在硼砂-盐酸缓冲体系下测定不同温度下6 mmol· L-1 基准Na2CO3溶液在558 nm处吸光度值, 结果如图6所示。 在0~60 ℃范围内, 吸光度随温度升高会有所降低, 但其影响并不大, 因此选择室温即可。
在硼砂-盐酸缓冲体系下测定0~50 mmol· L-1范围内的一系列基准Na2CO3溶液的吸光度, 并绘制曲线(图7)。 实验表明cT含量在0~10 mmol范围内溶液吸光度与浓度呈良好线性关系, 线性拟合方程为A=4.85cT+0.271 3, R2=0.999 8, 平均摩尔吸光系数ε =144 cm2· mol-1。
为确定检出限, 连续20次测定空白溶液的吸光度, 得出吸光度的标准偏差d=4.1× 10-4, 根据iupac推荐的检出限公式DL=3d/k (k为标准曲线的斜率), 计算出该方法检出限为2.53× 10-3 mmol· L-1。
除C
| 表1 pH对酚红吸光度的影响 Table 1 Effect of pH on absorbance of phenol red |
| 表2 卤水中常见共存离子的影响 Table 2 Effect of common ions in brine |
将Na2CO3, NaHCO3和Na2B4O7· 10H2O按不同比例混合, 混样编号为Y1— Y3, 通过分光光度法测定总碳浓度cT, 盐酸滴定测定总碱浓度AT, 甘露醇法测定总硼浓度c(B2O3), 并按照式(3)计算出C
| 表3 混合样品测定结果 Table 3 Analytical results of synthetic samples |
| 表4 加标回收率测定结果 Table 4 The recovery of standard addition |
取浓度为0.019 96 mol· L-1基准Na2CO3溶液分别采用紫外可见分光光度法分别测定其中C
| 表5 显著性检验结果 Table 5 Results of significance testing |
在原有理论和实验基础上, 建立了分光光度-滴定分析联用方法, 分别采用甘露醇滴定法测定分析体系中总硼浓度c(B2O3)、 酸碱滴定法确定被测体系总碱度浓度AT、 分光光度法确定被测体系中总碳浓度cT; 再通过计算分别得到C
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|