作者简介: 胡华玲, 女, 1983年生, 天津大学环境科学与工程学院博士研究生 e-mail: olivehhl@sina.com
土壤汞污染对水稻的生长、 发育以及稻米的品质均产生重要影响, 目前, 应用红外光谱研究汞对水稻植株中有机物分子结构的影响尚不深入。 采取大田低、 中、 高三种汞污染水平下的水稻植株样品, 应用傅里叶变换-红外光谱法(FTIR)测定水稻根、 茎叶、 籽粒三个器官的特征吸收峰, 研究不同程度土壤汞污染对植株傅里叶红外光谱特征的影响。 结果表明: 土壤汞污染导致了汞在水稻植株中的累积, 其含量分布为: 根>茎叶>籽粒。 水稻根、 茎叶在3 428, 2 922, 2 851, 2 364, 2 344, 1 750~1 500和1 150~935 cm-1等波数均受汞污染的影响, 而汞污染下的水稻籽粒仅在3 426, 2 361, 2 335和1 750~1 300 cm-1波数发生了变化。 综合分析水稻植株各器官的FTIR光谱特征, 可能说明: 汞胁迫降低了水稻根、 茎叶和籽粒中碳水化合物, 刺激了根中羧酸、 半乳糖、 饱和脂类和茎叶中多种多糖的生成。 水稻根和茎叶是阻抑汞迁移与侵害的主要器官。 根部似乎是在茎叶加强多糖类物质的生成并向根部转运营养物质的基础上通过分泌有机酸和增强细胞壁、 膜的形成, 使其与Hg螯合和吸附, 阻止汞向根内的迁移来实现抗汞胁迫的。 可以通过加强根与茎叶的抗汞过程来降低汞对水稻尤其是稻米的侵害。 在种植管理中不仅要重视汞在稻米中的积累, 还应当重视汞对水稻生长发育和稻米品质的影响。
Soilmercury (Hg) contamination may affect the growth of rice plant and rice quality. However, little information has been available so far on the effect of Hg pollution on the molecular structure of nutrientcomponents in rice by Fourier transform-infrared spectroscopy(FT-IR). This study aimed to detect the effect of soil Hg pollution on the FT-IRcharacteristics of rice plant organs through a FT-IR scanning of riceroot, stalkplus leaf, and seed collected from rice field under low-, medium-, high-Hg contamination. Results showed that soil Hg resulted in an accumulation in rice organs with an Hg allocation: root >stalk plus leaf>seed. FT-IR signals of root and stalk plus leaf at 3 428, 2 922, 2 851, 2 364, 2 344, 1 750~1 500, 1 150~935 cm-1 were under influence of Hg stress. Meanwhile, FT-IR spectra of rice seed seemed to be affected by Hg pollution at 3 426, 2 361, 2 335 and 1 750~1 300 cm-1. FT-IR analysis may indicate that Hg stress reduced absorbance of carbohydrate in all rice organs and stimulated the production of carboxylic acids, galactosum, and saturated lipids in root and the synthesis of polysaccharides in stalk and leaf. Root, stalk and leaf were the main organs to resist Hg stress for rice plant. Root may secrete organic acids to chelate Hg and enhance the formation of cytoderm to adsorb Hg, which may withhold Hg transportation from root surface to rice plant. It is supposed that an appropriate utilization of such mechanism of Hg resistance may reduce the harm to rice plant. Attention should be paid not only on the content accumulation of Hg in rice but also the effect of Hg contamination on rice growth and rice quality.
汞是一种在自然界多介质中广泛存在的重金属, 具有生物富集性和极强的神经、 肾毒性, 已被许多机构评定为优先控制污染物。 通过食用有汞累积的大米是人群摄入汞的重要途径之一, 而在汞环境背景值较高的汞矿区更是主要途径[1]。 水稻土壤中汞的主要赋存形态(Hg(Ⅱ ), Hg(0), 有机汞等)均可通过各种途径迁移至水稻植株中, 并影响水稻生长发育的生理特性和稻米的品质[2]。 我国是水稻种植与消费大国, 全国有60%以上人口以大米为主食。 研究汞对水稻植株生长发育的影响对保证大米品质与食品安全具有重要的意义。 但目前的研究多集中于汞在水稻植株中的汞累积含量与形态上, 而在汞对水稻植株中有机大分子的影响及水稻对汞的抗性机制方面的研究较少。
土壤汞污染对水稻生长发育的影响主要有根系生长、 养分运输与吸收、 抑制光合作用等[3]。 高浓度汞胁迫下, 叶片中的叶绿素a和根系分蘖受到显著抑制, 导致叶片光合作用降低和根系发育迟缓。 同时, 低浓度的汞胁迫对水稻株高、 穗重和叶绿素a反而有一定的促进作用, 且亦未发现其对根系的显著影响。 对汞污染地区水稻品质变化的调查发现: 土壤汞污染降低了水稻的光合作用效率, 影响了水稻的物质合成与转化, 使得稻米籽粒中淀粉、 粗蛋白含量降低[4]。 较低的汞胁迫下, 稻米的蛋白质、 直链淀粉含量无显著降低, 但对脂肪酸有抑制作用。
应用傅里叶变换红外光谱(FTIR)可以通过表征有机物分子中官能团与极性键振动的特征峰来分析有机物分子的组成, 被广泛用于大分子有机物的结构解析。 而植株中的有机大分子, 如糖类、 脂类、 蛋白质等, 具有特征性的官能团和分子振动和转动方式, 可以通过FTIR识别[5]; 还可通过分析特征吸收峰强度、 宽度以及吸收峰频率的移动等, 来研究植物体内的有机大分子的官能团组成对环境因子、 营养缺乏、 重金属胁迫等的微观响应机制[6]。 高丽丽等[7]应用FTIR研究缺钙胁迫对花生苗期植株的化学结构的影响, 发现: 钙缺乏会导致花生植株体内糖类、 蛋白质和脂类的显著降低。 薛生国等[5]应用FTIR识别出蛋白质、 氨基酸、 糖类、 羧酸等物质在低铅胁迫的紫茉莉中的渗透调节作用, 并揭示出紫茉莉根部通过有机物组分的变化阻止了铅向地上部的迁移。 但目前, 应用FTIR研究水稻各器官中有机物分子结构对土壤汞污染响应机制的报道很少。 本研究通过采集野外不同程度汞污染样地的土壤和水稻植株样品, 应用FTIR技术测定土壤和水稻根、 茎叶、 籽粒的特征吸收峰, 识别特征峰位置、 强度变化等来分析汞污染对水稻植株不同器官的影响。 为研究植物对汞污染的响应机制提供线索并可以为食品安全风险管控提供理论依据。
在贵州省万山汞矿区设置三个野外水稻(Oryza. sativa L.)种植小区: 低汞样地(总汞为0.3 mg Hg kg-1、 水溶汞为0.16 μ g Hg kg-1)、 中汞样地(总汞为3.3 mg Hg kg-1、 水溶汞为0.40 μ g Hg kg-1)与高汞样地(总汞为34.1 mg Hg kg-1、 水溶汞为0.88 μ g Hg kg-1)。 三块样地土壤理化性质相似: 土壤pH范围为5.60~6.32, 呈弱酸性。 土壤含2.7%~3.8%黏粒、 23.0%~32.5%粉粒和63.8%~74.3%砂粒, 为粉砂壤。 样地土壤含全氮(2.2± 0.2) mg· g-1、 有机质(44.2± 2.1) mg· g-1、 全磷(0.62± 0.10) mg· g-1、 有效磷(13.3± 1.2) mg· kg-1、 全钾(8.2± 0.6) mg· g-1、 速效钾(19.6± 2.2) mg· kg-1。 种植时, 三块样地均采用相同的水分与养分管理。 水稻成熟后, 在三块样地分别随机布三点, 采取完整植株样品, 封入自封袋中迅速运回实验室。 将植株分为根、 茎叶、 籽粒三部分以去离子水洗净、 略晾干后, 取部分置于液氮中研磨过0.15 mm尼龙筛以备测定。
1.2.1 营养元素与汞含量
应用元素分析仪(Elementar, 德国)测定植株中C, N, H, S的含量。 称取约0.1 g研磨过0.15 mm筛的植株样于25 mL比色管中, 加入5 mL浓HNO3, 置于(95± 2) ℃中水浴消解3 h, 加入0.5 mL新制BrCl。 冷却后, 加入超纯水至25 mL。 静置2 h后, 取20 mL以0.45 μ m PTFE滤膜过滤并加入0.2 mL 10%(m/V)盐酸羟胺溶液。 摇匀、 定容至25 mL后稍静置, 以原子荧光光度计(PSA, 英国)测定消解液中的总汞含量。 分别使用7%(V/V)HCl, 2%(m/V)SnCl2作为载流与还原剂, 消解与测试分析用所有试剂均为优级纯。 同时, 设置大米质控样品QC-RI-001中总汞的测定。 回收率为93.9%~106.8%, 表明: 测试数据可靠。 水稻植株各器官中营养元素和汞含量应用SPSS V20.0软件进行差异性分析。
1.2.2 傅里叶变换红外光谱分析
称取0.5~2 mg过0.15 mm尼龙筛的植株粉末样, 将样品与KBr粉末以1:100的比例混合于玛瑙研钵中, 充分研磨、 混匀, 压片机压片后, 迅速置于傅里叶红外光谱仪(Tensor Ⅱ , 德国布鲁克)上测定。 扫描范围为4 000~400 cm-1, 分辨率为2 cm-1, 扫描次数为64次。 测得的傅里叶红外光谱谱图中的特征吸收峰与官能团鉴定参考文献[7, 8, 9, 10, 11]。 对各谱图进行吸光度归一化后, 应用OPUS V7.5软件(德国布鲁克)分析特征吸收峰的峰高与位移等信息。
不同汞污染水平样地的水稻根中氮含量分布在0.63%~0.83%, 低于茎叶(0.77%~1.22%)和籽粒(1.18%~1.57%)(表1)。 同时, 茎叶和籽粒中碳(35.24%~40.68%)和氢(5.06%~6.16%)也高于根中的碳(16.79%~20.87%)和氢(2.40%~3.15%)。 但硫似乎主要分布在水稻茎叶中。
| 表1 水稻植株各器官中的营养元素含量与C/N比值(质量比) Table 1 The contents of nutrient elements in rice organs |
比较不同汞污染水平下水稻植株各器官的营养元素, 发现: 各元素与植株各器官对汞污染胁迫的响应是不同的。 根中氮含量随汞胁迫增强而升高, 但茎叶和籽粒中氮却随土壤汞含量升高而显著降低。 这可能意味着: 根作为水稻直接吸收汞的器官, 在受到汞胁迫时加强了蛋白质或氨基酸的生成以降低侵害。 而茎叶和籽粒在汞累积下蛋白质或氨基酸受到抑制而发生降低。 植株中的碳含量对汞胁迫的敏感性较差, 仅根中碳在土壤汞污染时升高, 但随污染程度的升高, 变化不显著(表1)。 高汞样地与中汞样地的水稻根中氢同样显著高于低汞样地, 但茎叶和籽粒并未表现同样的趋势。 茎叶中的硫在发生汞胁迫时含量降低, 但根与籽粒中的硫含量并未显著改变, 这可能表明: 汞污染同样抑制了含硫基团的生成, 并可能对营养转运或光合作用产生影响。
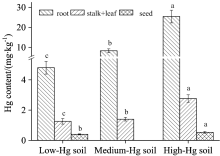
在三个汞污染水平样地中, 水稻根部、 茎叶和籽粒中的汞含量范围分别为4.80~25.39, 1.26~2.76和0.40~0.53 mg· kg-1, 表明: 在水稻植株中, 根中汞含量最高, 茎叶其次, 籽粒中含量最低(图1)。 这可能表明水稻根部阻止了汞向地上部分的迁移, 而茎叶也抑制了汞最终在籽粒中的累积。 土壤中汞污染水平与水稻各组织中的汞含量均具有显著正相关性(p< 0.01)。 即: 随着土壤汞污染程度升高, 根、 茎叶和籽粒中的汞含量均升高。 对比发现: 各汞污染水平下的稻米中汞含量远高于国家食品安全标准的汞限定量(0.02 mg· kg-1, GB-2762— 2012), 说明: 汞污染导致了水稻籽粒中较高水平的汞累积。 低汞样地籽粒中的总汞平均也达0.40 mg· kg-1, 可能与当地较高浓度的大气汞直接进入水稻叶片并被转运至籽粒中有关。
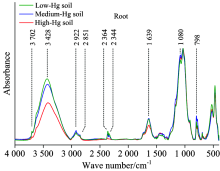
不同汞污染水平下水稻根的傅里叶变换红外光谱的官能团特征峰位置未发生显著改变(图2)。 但在3 428, 2 364和2 344 cm-1, 吸光度随汞胁迫增强而降低。 一般地, 在波数3 428 cm-1附近的特征峰是由糖类、 半纤维素、 纤维素等碳水化合物中的缔和O— H和蛋白质、 氨基酸、 核酸等中的N— H伸缩振动引起的。 而2 364和2 344 cm-1是不饱和脂类物质中的C=C双键的特征峰[10]。 红外谱图表明: 汞污染致使水稻根中碳水化合物、 不饱和脂类的生成受到较强的抑制, 表现出汞对植株体的毒害作用[9]。
2 922和2 851 cm-1附近是羧酸类物质中的O— H和脂类化合物饱和— CH2中的C— H伸缩振动特征峰, 主要是细胞膜、 细胞壁等组织的成分[11]。 中汞胁迫下, 该特征峰吸光度较低汞胁迫时高, 可能表明根部应对汞胁迫产生了抗性, 分泌了有机酸或者细胞壁上的O— H直接与Hg发生螯合, 降低了汞侵害。 但在高汞胁迫下, 汞毒害作用增强, 减弱了根分泌有机酸的能力, 随着与Hg的不断螯合, 有机酸逐渐降低, 最终降低了该特征峰吸光度[12]。 1 280 cm-1特征峰(P=O基团)随汞污染程度升高而先升高后降低, 表明了: 核酸在中汞下大量生成但在高汞下受抑制, 这可能也印证了根对汞的抗性机制。
1 750~1 500 cm-1波数的特征峰是蛋白质、 氨基酸、 多肽类物质的C=O键伸缩振动以及N-H弯曲振动[10]。 1 296~1 352 cm-1范围的特征峰是蛋白质中— CH2, — CH3的弯曲振动。 其吸光度随汞含量升高而降低, 表明了在高汞胁迫下的水稻根中蛋白质含量的减低[8]。 相比中汞与低汞胁迫, 在高汞胁迫下的1 750~1 500 cm-1峰吸光度显著降低。 这可能表示多肽类物质对汞污染具有一定的抗性。 1 296~1 352 cm-1的特征峰在中汞与高汞污染时, 吸光度升高。 这可能表明: 汞对水稻根中不同种类蛋白质、 氨基酸和多肽的影响是不同的, 某些蛋白质在汞胁迫时水解, 但某些蛋白质在汞刺激下含量升高, 以产生汞抗性。
1 088和1 055 cm-1波数附近特征峰是C— O和C— C的伸缩振动峰, 主要来自于多糖类的碳水化合物。 总体来讲, 中汞和高汞污染可能导致刺激了水稻根半乳糖的合成, 但未见汞显著影响根中葡萄糖[11]。 相比低汞水平, 在中、 高汞水平下半乳糖的红外信号升高, 可能表明了较高的汞胁迫提高了根部的运输效率, 更多的多糖从茎叶运输至根部以应对汞胁迫。
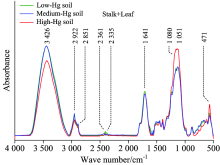
在高汞污染水平下, 3 428, 2 922和2 851 cm-1波数附近的特征峰吸光度较中、 低汞水平低, 表明茎中碳水化合物和饱和脂类受汞的抑制(图3)。 但对中汞水平下水稻茎叶该特征峰吸光度并未显著低于低汞水平, 这可能意味着水稻茎叶对汞的一定抗性。 同样地, 在2 361和2 335 cm-1波数所代表的不饱和脂类则在汞污染下受到阻抑。 但不同于水稻根的是, 1 300~1 750 cm-1范围的蛋白质特征峰在汞污染下, 含量变化不显著。 这可能意味着, 在水稻植株中, 茎叶中蛋白质、 氨基酸类物质应对汞污染时不敏感。 而935~1 149 cm-1范围所代表的一簇多糖类, 包括半乳糖、 葡萄糖、 果糖、 麦芽糖等, 在高汞胁迫下其吸光度增高, 说明高汞刺激了茎叶中多糖类物质的生成与运移, 从而应对汞的侵害。 这可能也印证了在汞侵害下, 根中部分多糖类物质含量的上升。 但总体上, 水稻茎叶具有一定对汞的抗性, 进一步阻抑了汞的运移。
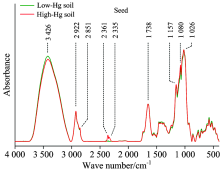
水稻籽粒的红外光谱特征与水稻根部及茎叶存在一定差异。 与低汞样地相比, 高汞水平污染下的水稻籽粒在3 426 cm-1波数特征峰降低, 表明土壤汞污染导致水稻籽粒的碳水化合物的含量下降。 但在2 361和2 335 cm-1波数的特征峰反而在汞胁迫下吸光度增强, 表明汞污染刺激了籽粒中不饱和脂类的生成。 在1 300~1 750 cm-1范围的蛋白质特征峰在高汞污染下仅略有下降, 表现出其受汞影响较小。 与此同时, 相比低汞水平, 高汞胁迫下籽粒在2 292, 2 851, 1 738, 1 157, 1 080和1 026 cm-1波数的特征峰吸光度无显著变化, 这表明: 汞胁迫并未影响籽粒中的饱和脂类、 氨基酸类、 多糖类等物质。 从总体上讲, 在根部、 茎叶阻抑汞迁移后, 水稻籽粒对汞的阻抑作用似乎较弱, 根和茎叶转运来的汞累积在籽粒中。
通过野外低、 中、 高汞污染水平的水稻不同器官的营养元素和汞含量及红外光谱的分析, 得到如下结论:
(1)水稻各器官中的汞含量均与土壤中汞含量呈显著正相关(p< 0.01), 汞在水稻植株各器官中的分配表现为: 根> 茎叶> 籽粒。 而各器官中的各营养元素对汞污染的响应是不同的。
(2)汞污染影响了水稻植株根、 茎叶和籽粒的傅里叶红外光谱特征, 说明汞污染导致水稻根、 茎叶和籽粒中碳水化合物的降低, 但对其他物质的影响是不同的。 汞胁迫刺激了根中羧酸、 部分多糖和饱和脂类的生成, 但降低了不饱和脂类的含量。 同时, 茎叶中的饱和及不饱和脂类均受汞污染影响而降低, 但提高了多糖的含量。 与根和茎叶不同的是, 汞胁迫对籽粒中多糖、 蛋白质、 饱和脂类的影响较小, 但增强了不饱和脂类的生成。
(3)水稻植株各器官响应汞污染的机制可能是不同的。 水稻根和茎叶是阻抑汞迁移与侵害的主要器官。 根部似乎是通过分泌有机酸和增强细胞壁、 膜的形成, 使其与Hg螯合和吸附, 从而将Hg排斥在根外或积累在细胞壁中阻止汞进一步向根内的迁移来实现抗汞胁迫的。 而茎叶则可能主要通过加强多糖类物质的生成及其向根部转运营养物质而降低汞侵害的。 同时, 籽粒对汞污染的阻抑作用较小。
(4)总体来讲: 受土壤汞污染影响, 水稻籽粒中碳水化合物减少, 降低了大米的品质。 而籽粒较弱的汞抗性, 使得大量汞累积在籽粒中, 增加了人群食用的风险。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|