作者简介: 龚含情, 女, 1992年生, 上海师范大学生命与环境科学学院硕士研究生 e-mail: 1942048359@qq.com
4-乙基-2-甲氧基苯酚是一种被广泛应用的食品添加剂, 但它也具有一定的毒性, 为了探究4-乙基-2-甲氧基苯酚对人体的影响, 将多种光谱技术与分子模拟等技术结合起来对4-乙基-2-甲氧基苯酚与人血清白蛋白Human Serum Albumin(HSA)之间的相互作用进行了较全面的研究。 紫外吸收光谱的结果说明, 4-乙基-2-甲氧基苯酚与人血清白蛋白之间形成了新的复合物。 荧光光谱的结果说明了4-乙基-2-甲氧基苯酚的存在, 可以增加人血清白蛋白的荧光强度。 通过15 nm的同步荧光光谱同时结合荧光增强效应方程可以计算出4-乙基-2-甲氧基苯酚与人血清白蛋白之间的结合常数, 且它们之间的结合常数随着温度的升高而减小。 热力学参数表明, 4-乙基-2-甲氧基苯酚主要靠氢键和疏水作用力与人血清白蛋白结合在一起。 同步荧光光谱、 三维荧光光谱和圆二色光谱的结果说明人血清白蛋白的构象会随着4-乙基-2-甲氧基苯酚的作用而发生一定的变化。 分子对接得到结果说明4-乙基-2-甲氧基苯酚键合在人血清白蛋白的IB区域。
4-Ethyl-2-methoxyphenol is a widely used food additive, but it also has toxicity. In order to investigate the effect of 4-Ethyl-2-methoxyphenol on the body, the interaction between 4-Ethyl-2-methoxyphenol and human serum albumin (HSA) was studied by combining a variety of spectroscopic techniques and molecular simulation techniques in this paper. UV absorption spectra results indicated that 4-Ethyl-2-methoxyphenol formed a new complex with human serum albumin. In addition, the fluorescence spectra results showed that the presence of 4-Ethyl-2-methoxyphenol can enhance the fluorescence intensity of HSA. 15 nm synchronous fluorescence and fluorescence enhancement effect equations can be used to calculate the binding constants between 4-Ethyl-2-methoxyphenol and HSA, and their binding constants decreased with the increasing of temperature. Thermodynamic parameters showed that 4-Ethyl-2-methoxyphenol was mainly bonded with HSA by hydrogen bonding and hydrophobic interaction. Moreover, synchronous fluorescence, three-dimensional fluorescence and circular spectra revealed that 4-Ethyl-2-methoxyphenol modified the conformation of HSA. The molecular docking technique demonstrated that 4-Ethyl-2-methoxyphenol was bonded in the IB hydrophobic region of HSA.
4-乙基-2-甲氧基苯酚, 是一种油状液体, 颜色为无色或淡黄色, 可从木材的蒸馏液中提取出, 具有草药似的香气、 暖并且甜的香辛料味, 可用作食品添加剂及香体。 它还能够增香, 防腐, 杀菌等, 所以酱油和酒等产业常选它作为重要的食品添加剂[1]。
人血清白蛋白(HSA), 存在于人体的血浆中, 而且是含量最多的人血浆载体蛋白[2], 具有585个氨基酸。 常被选择作为研究小分子和蛋白质之间相互作用的模型蛋白, 因为它具有维持血浆的渗透压、 调节血液pH等作用, 同时又可以存储、 转运许多外源性、 内源性物质的优点[3]。 人血清白蛋白对于贮存、 转运小分子到达被吸收部位和发挥效力有着非常重要的作用, 因此研究小分子与HSA的相互作用有着特殊的意义。
目前, 已有很多学者对4-乙基-2-甲氧基苯酚的提取与合成做了大量研究[4], 但对其在人体内的相互作用, 特别是4-乙基-2-甲氧基苯酚与血清蛋白的结合研究甚少, 作用机制也不明确。 本工作对4-乙基-2-甲氧基苯酚与人血清白蛋白的相互作用进行了研究, 采用了光谱法和分子对接技术相结合的方法。 这对于探索食品添加剂和HSA的作用机制具有重大意义, 可以为评估食品添加剂的健康风险提供更多的参考信息。
光谱法作为最常用的方法之一, 常用来研究蛋白质和小分子的相互作用, 并且已被大量报道[5]。 因此, 我们在体外模拟的生理条件下, 研究了HSA与4-乙基-2-甲氧基苯酚反应的光谱变化, 采用紫外-可见光谱和荧光光谱法, 得到了HSA与4-乙基-2-甲氧基苯酚的结合常数、 热力学参数和结合的作用力类型等信息, 同时通过同步、 三维荧光光谱和圆二色光谱的方法, 测定了4-乙基-2-甲氧基苯酚对HSA微环境和构象的影响。 为进一步研究4-乙基-2-甲氧基苯酚在体内的转运、 分布、 代谢、 排泄等方面提供了一定的理论依据。
荧光分光光度计, 安捷伦Cary Eclipse (美国Varian公司); 双光束的紫外可见光分光光度计, TU-1901型(北京普析通用仪器有限公司); J-815型圆二色光谱仪(JASCO公司)。
4-乙基-2-甲氧基苯酚(上海瑞永生物科技有限公司)纯度≥ 99% ; 人血清白蛋白(上海源叶生物科技有限公司), 纯度96%~99%; 其他试剂都是分析纯, 实验用二次蒸馏水。
以pH 7.40 Tris-HCl缓冲溶液配制浓度为1.0× 10-4 mol· L-1的HSA贮备液和将4-乙基-2-甲氧基苯酚溶于乙醇溶液中配成1.0× 10-3 mol· L-1的贮备液, 置于4 ℃以下冰箱保存备用。
1.2.1 光谱法测定
在10 mL的一系列试管中, 分别加入100 μ L HSA储备液(HSA的最终浓度为1.0× 10-6 mol· L-1)和不同体积的4-乙基-2-甲氧基苯酚储备液, 用Tris-HCl缓冲溶液定容。
在298 K, pH 7.4时, 测定体系的紫外光谱, 在200~350 nm的范围内。 在最佳激发波长280 nm的激发下, 测定体系的荧光光谱, 在300~500 nm的波长范围内, 设置的激发与发射的荧光狭缝宽度均为5.0 nm。 分别测定15和60 nm下200~350 nm波长范围的同步荧光光谱, 同时分别测定303和308 K下15 nm时的同步荧光光谱。 分别测定 HSA 与4-乙基-2-甲氧基苯酚-HSA 混合物的三维荧光光谱, 激发波长设置在200-350 nm的范围内, 发射波长设置在200~500 nm的范围内, 步长和狭缝都设置为5 nm。 测定4-乙基-2-甲氧基苯酚与HSA混合前后体系在200~350 nm的波长范围内的CD光谱。
1.2.2 计算机模拟
HSA的晶体结构(PDB ID: 1H9Z)来自(http://www.rcsb.org/pdb) Brookhaven蛋白质库。 采用Sybyl 8.0软件对蛋白与小分子进行分子对接。
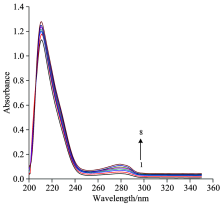
在紫外光谱区HSA有两个特征性的蛋白吸收带, 220 nm处的吸收峰主要是由于肽键上的羰基n— π * 电子跃迁导致的; HSA分子中有2个色氨酸及20个酪氨酸残基, 它们的芳杂环会发生π — π * 与n— π * 电子跃迁, 从而使得在280 nm处可以观察到吸收峰[6]。
图1为4-乙基-2-甲氧基苯酚-HSA体系的紫外吸收光谱图, 可以看出峰型较尖锐, 并有两个吸收峰; 随着不同浓度小分子的加入, HSA在220和280 nm处的吸收带表现为增色效应。 说明了4-乙基-2-甲氧基苯酚和HSA之间存在相互作用, 并形成了复合物, 同时也说明了4-乙基-2-甲氧基苯酚的加入使得HSA的微环境发生了变化。
HSA中含有可以产生内源荧光的氨基酸残基, 其中产生最大荧光强度的是色氨酸, 它对周围环境的变化特别敏感[7]。 人血清白蛋白在280 nm的最佳激发波长下, 最大荧光发射峰会在343 nm处产生[8]。 图2为4-乙基-2-甲氧基苯酚与HSA相互作用的荧光光谱图。
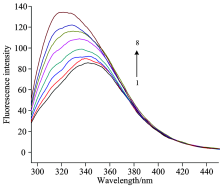 | 图2 4-乙基-2-甲氧基苯酚-HSA体系的荧光光谱图Fig.2 Fluorescence spectra of 4-Ethyl- 2-methoxyphenol-HSA system (1): cHSA=1× 10-6 mol· L-1, (2— 8): c4-ethyl-2-methoxy-Phenol/cHSA=1, 3, 5, 7, 9, 11, 13; T=298 K, pH=7.4 |
从图2中可见, 随着加入的小分子浓度增大, HSA的荧光在最大发射波长处出现了明显的蓝移, 并且强度也逐步变大, 强度增强及蓝移现象表明, 4-乙基-2-甲氧基苯酚的加入使得蛋白质微环境的极性减小, 疏水性增强。
Δ λ 为60 nm时表示色氨酸残基的荧光光谱, Δ λ 为15 nm时可代表酪氨酸残基的荧光光谱[9], 常常用它们测定蛋白质的内部结构变化情况。 可根据最大发射波长的变化来判断蛋白质中对应氨基酸残基所处的微环境和极性的变化。
由图3(a)能够看出随着加入的4-乙基-2-甲氧基苯酚浓度的增大, 峰强度逐渐增大, 最大发射峰表现为稍微的蓝移, 表明色氨酸残基周围的环境, 发生极性减小, 而疏水性增大, 肽链更加伸展等现象。 与此相反[图3(b)], 酪氨酸残基的最大发射峰无明显红移或蓝移现象, 说明在4-乙基-2-甲氧基苯酚与HSA相互作用过程中, 酪氨酸残基四周的环境没有产生显著地改变。
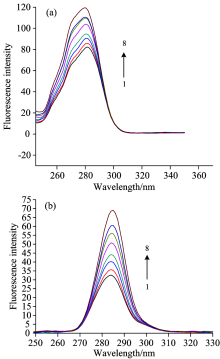 | 图3 4-乙基-2-甲氧基苯酚-HSA体系的同步荧光光谱图Fig.3 Synchronous fluorescence spectra of HSA in the absence and presence of 4-Ethyl-2-methoxyphenol (a): Δ λ =60 nm; (b): Δ λ =15 nm |
2.4 4-乙基-2-甲氧基苯酚-HSA结合常数的计算
Δ λ =60 nm时, 不同浓度的4-乙基-2-甲氧基苯酚与HSA混合后体系的同步荧光光谱如图3(a)所示, 随着加入小分子浓度的增大, 荧光强度也逐渐增强, 但同步荧光光谱发生略微的蓝移, 不宜进行结合参数的计算。
Δ λ =15 nm时, 不同浓度的4-乙基-2-甲氧基苯酚与HSA混合后体系的同步荧光光谱如图3(b)所示, 随着4-乙基-2-甲氧基苯酚不断加入体系荧光强度明显增加, 且峰值不随浓度增加而发生变化, 适于进行4-乙基-2-甲氧基苯酚-HSA结合常数的计算。 测定在三种不同温度(298, 303, 308 K)下, pH=7.4时, HSA与各个浓度的4-乙基-2-甲氧基苯酚混合后, 体系在Δ λ =15 nm时的同步荧光光谱。
假设蛋白质与小分子相互作用存在单一结合位点的情况, 应用荧光增强效应方程。 可计算4-乙基-2-甲氧基苯酚与HSA相互作用的结合常数[10]。 荧光增强效应方程
式(1)中Δ F=F-F0; Fmax=F∞ -F0; F0为HSA的初始荧光强度(即未加4-乙基-2-甲氧基苯酚时蛋白的荧光强度); F为Δ λ =15 nm时4-乙基-2-甲氧基苯酚一HSA体系的荧光强度。 Fmax为4-乙基-2-甲氧基苯酚与HSA相互作用达饱和状态时的荧光强度, K表示它们之间的结合常数, [Q]表示4-乙基-2-甲氧基苯酚的最终体系浓度。 根据1/Δ F对1/[Q]作图, 得到的直线斜率可求得4-乙基-2-甲氧基苯酚与HSA的结合常数, 得到的线性直线图可证明小分子与蛋白质相互作用的位点是一对一的关系。
图4为不同温度下4-乙基-2-甲氧基苯酚-HSA体系的1/Δ F对1/[Q]图, 可以看出呈现出良好的线性, 由此说明4-乙基-2-甲氧基苯酚与HSA的作用位点数大约为1。 可以依照式(1)计算出它们的结合常数, 并将其列于表1中。 表明结合常数会随着温度的升高而下降, 它们之间可能形成了复合物, 这与紫外光谱分析的结果相同。
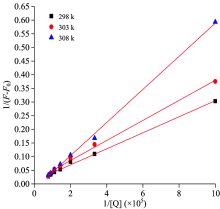 | 图4 4-乙基-2-甲氧基苯酚-HSA体系的荧光增强曲线Fig.4 Fluorescence enhancement curve for 4-Ethyl-2-methoxyphenol-HSA system |
| 表1 不同温度下4-乙基-2-甲氧基苯酚-HSA体系的热力学参数 Table 1 Parameters of 4-ethyl-2-methoxy phenol-HSA system at different temperatures |
蛋白质会以不同的作用力与不同小分子相结合形成复合物。 依照热力学参数的变化, 可以大致判断它们的作用力类型[11]。 在温度的改变很小时, 焓变能够当做常数, 根据Van’ t Hoff定律
式(2)— 式(4)中K是结合常数, R是气体常数。
由此可以计算出体系的热力学常数, 计算结果列于表1中, 可知Δ G< 0, 表明反应是自发进行的。 Δ H< 0, Δ S> 0, 说明4-乙基-2-甲氧基苯酚与HSA间主要的作用力是氢键与疏水作用力。
CD圆二色光谱是最常用的一种判断蛋白质构象变化的技术, 对构象变化较敏感, 测定速度快、 方法简便, 在蛋白质的构象研究中已经被普遍应用[12]。
CD光谱中, HSA有两个特征吸收峰, 在208和222 nm处出现, 它们表示蛋白质中的α -螺旋, HSA的α -螺旋结构如果发生改变, CD光谱也会发生相应的变化[13]。 图5为室温下加入不同浓度的4-乙基-2-甲氧基苯酚后HSA的CD光谱图。
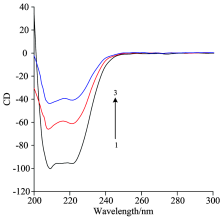 | 图5 4-乙基-2-甲氧基苯酚-HSA体系的CD光谱图Fig.5 CD spectra of HSA in the absence and presence of 4-Ethyl-2-methoxypheno |
由图5可见当加入的4-乙基-2-甲氧基苯酚与HSA的摩尔比分别为(1)1∶ 0, (2)1∶ 5, (3)1∶ 10时, 对应的HSA的α -螺旋含量分别为45.42%, 25.18%, 11.70%。 表明4-乙基-2-甲氧基苯酚会使HSA 中的α -螺旋含量出现减少的现象, 同时CD光谱的形状和峰尖的位置无明显变化, 可以认为体系中的二级结构还是以α -螺旋结构为主。 说明HSA二级结构的变化主要是由于其α -螺旋结构含量的降低。
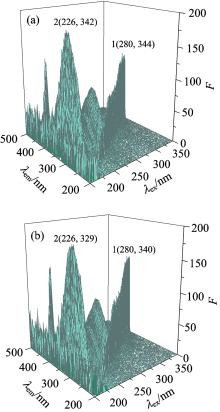
蛋白质中一般含有可以发出荧光的氨基酸残基, 它们对四周环境的变化特别敏感。 因此研究三维荧光光谱不仅能够看到蛋白的荧光强度变化, 而且可以根据荧光变化看出蛋白的构象变化[14]。
由图6可知加入4-乙基-2-甲氧基苯酚后peak 1(λ ex=226 nm, λ em=342 nm)强度的增强并且蓝移, peak 2(λ ex=280 nm, λ em=344 nm)的强度基本不变但也发生了蓝移, 表明, 4-乙基-2-甲氧基苯酚的加入改变了Trp 214残基周围的微环境, 极性降低、 疏水性随之增大。
HSA中含三个类似的结构域, 分别是DomainⅠ (1~195), DomainⅡ (196~383), DomainⅢ (384~585), 每个结构域中具有不同的两个亚域, 亚域A和亚域B, 三个亚结构域形成疏水性的圆筒状[15]。
分子对接可以直接揭示小分子与靶点之间的相互作用, 也可为构效关系的研究提供最为合理的活性构象[16]。 为了获得更多关于4-乙基-2-甲氧基苯酚与HSA作用的信息, 采取分子对接的方法, 进而研究两者之间相互的作用。
图7分子对接结果表明HSA中有足够的空间可以容纳4-乙基-2-甲氧基苯酚, 而且4-乙基-2-甲氧基苯酚可以结合在HSA的IB区域, 同时也可以看出氢键和静电作用力是4-乙基-2-甲氧基苯酚与HSA结合的主要作用力。
利用多光谱法和分子对接法研究4-乙基-2-甲氧基苯酚与HSA的相互作用。 荧光光谱研究结果表明, 4-乙基-2-甲氧基苯酚的存在能够增加HSA的荧光, 且形成了复合物; 298 K测得的反应结合常数Ka为3.74× 104 L· mol-1; 4-乙基-2-甲氧基苯酚主要靠氢键和疏水作用力与HSA结合。 通过对紫外, 同步, 三维荧光和圆二色光谱研究表明, 4-乙基-2-甲氧基苯酚可以改变HSA的二级构象。 分子对接得到的结果表明4-乙基-2-甲氧基苯酚键合在HSA的IB区域, 作用力和结合位点与光谱法一致。 研究结果为更深入地探究食品添加剂对人体的影响, 尤其是对HSA结构的影响提供了可信依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|