作者简介: 张兰兰, 1991年生, 东北师范大学物理学院硕士研究生 e-mail: zhangll812@nenu.edu.cn
氧化锌纳米粒子(ZnO NPs)是应用非常广泛的一种多功能无机材料, 主要应用于化妆品、 涂料、 抗菌等领域。 ZnO纳米粒子的大量使用增加了与生物接触的机会, 可能会对生态环境产生一定的影响。 芦荟是百合科常绿多肉质草本植物, 具有重要的观赏和药用价值。 芦荟大黄素(Aloe-emodin, AE)是芦荟中重要的色素分子, 也是芦荟作为药用植物的重要有效成分。 因此, 以芦荟为实验对象, 利用荧光显微镜通过纵向切片的方法观察了AE在叶片中的分布, 较横向切片法更为全面、 清晰地揭示了AE在叶片中的分布情况。 通过荧光光谱结合颜色变化研究了ZnO纳米粒子与AE的相互作用。 结果表明, 在黑暗条件下, ZnO纳米粒子处理后溶液颜色由淡黄色逐渐变成橙色; 紫外光照射使得AE溶液颜色变化加快, 在相同的作用时间内, 溶液颜色变得更深, 由淡黄色逐渐变成橙红色。 光谱研究发现, AE的荧光光谱有四个发光峰, 分别是500, 540, 580与630 nm, 与对照组相比, ZnO纳米粒子引起芦荟大黄素540和580 nm两个荧光峰的相对强度发生变化, 随着ZnO纳米粒子作用时间的增加, I540/ I580比值逐渐增大。
Zinc oxide nanoparticles (ZnO NPs) have unique physical and chemical properties and important application values in many fields, which has also been resulted the consequence that it was released into different environment, and increased the interaction with creatures, which is the most important aspect of the toxic effects of ZnO NPs. Aloe is a lily family of evergreen and fleshy herbs, which has important ornamental and medicinal value, Aloe-emodin (Aloe emodin, AE) is an important pigment molecule in aloe, which is also an important active ingredient of aloe as a medicinal plant. In this work, from a new perspective, the distribution of AE in leaves was investigated through the longitudinal slicing method with fluorescence microscopy, and which was comprehensively understood, and then the interaction between ZnO NPs and AE was studied. The changes of the color of AE and its fluorescence spectra under the influence of ZnO NPs were observed and analyzed. The results showed that the trend of the color change of AE solution was from light yellow through orange yellow, orange to orange red; moreover, compared with the control group, the ZnO NPs accelerate the changes of the relative intensity of the main the emission peaks located at 540 and 580 nm, increased the ratio of I540 /I580. The above results indicate that ZnO NPs have obvious negative effects on AE, which provides more information for a comprehensive evaluation of the bio-risks of ZnO NPs on aloe and other related plants.
纳米材料是指至少有一个维度处于1~100 nm之间的材料, 由于晶粒的细微化, 其表面电子结构和晶体结构发生变化, 产生了宏观材料所不具有的表面效应、 体积效应、 量子尺寸效应和量子隧道效应等特点[1]。 纳米材料在许多方面都显示出特殊的性能, 因此被广泛地应用于力学、 磁学、 电学、 热学、 光学和生命科学等方面[2], 产品涉及到橡胶、 涂料、 化妆品、 纺织等众多领域[3]。 纳米粒子通过水、 大气、 土壤等途径释放到环境中的可能性也在增加, 对生态系统造成不可预知的影响[4]。 植物是生态系统的重要组成部分, 研究纳米粒子对植物的影响至关重要[5]。
氧化锌纳米粒子(ZnO NPs)是应用最为广泛的一种纳米材料[6], 随着其在多种领域的开发和利用, 它的生物安全性逐渐成为国内外关注的热点。 芦荟是百合科常绿多肉质草本植物, 具有重要的观赏和药用价值[7], 芦荟大黄素(aloe emodin, AE)是其主要的活性成分。 芦荟大黄素在芦荟叶中的分布情况一直以来都是人们关注的问题。 最早Bruni[8]利用荧光显微镜观察芦荟叶横切面的显微结构, 发现在365 nm紫外光照射下, AE呈微小液滴状分布在细胞内, 发出强烈的橙黄色荧光。 后来又有Liao等[9]在透射电子显微镜下对AE的产生、 运输和储存过程进行了研究, 发现AE在同化组织的质体中产生, 经过细胞器的一系列运输, 转移到维管束外侧的大型细胞内储存。 但是上述研究观察的都是芦荟叶的横切面, AE沿着维管束方向的分布尚不清楚。 Balasundram等[10]发现酚类物质的抗氧化活力取决于其结构, 特别是羟基的位置和数目以及苯环上取代基的性质, 而且抗氧化强度通常随着羟基个数的增加而增加。 ZnO纳米粒子是一种宽禁带半导体材料, 具有一定的光催化活性, 在水溶液中经紫外光照射后, 粒子表面会产生超氧自由基和羟基自由基, AE可能与之发生相互作用, 使得AE分子结构中的羟基和羰基的数目和位置发生变化, 影响AE的抗氧化性能, 而这方面的研究目前尚未见报道。 但Ali[11]等利用了芦荟叶提取物(ALE)合成ZnO纳米粒子, 发现ALE中存在的蛋白质和酚类化合物对于ZnO纳米粒子的成核和稳定性有作用。 这在一定程度上说明ZnO纳米粒子可能与AE发生相互作用。
利用荧光显微镜通过纵向切片的方法观察AE在芦荟叶片中的分布, 更全面地揭示了AE沿着维管束的分布情况。 然后从AE溶液颜色和荧光光谱的角度研究了ZnO纳米粒子对AE的影响, 并从ZnO纳米粒子作用下AE分子结构变化的角度对上述变化的机制进行了解释。 本研究对于准确地了解AE在叶片中的分布以及全面地评价ZnO纳米粒子对AE的影响具有重要的现实意义。
透射电子显微镜(JEOL-2100F, 日本电子株式会社), X射线衍射仪(D/MAX-2500, 日本Rigaku公司), 荧光光谱仪(Edinburgh FLSP920, 英国Edinburgh Ins), 荧光显微镜(BX51, Olympus), 优普系列超纯水器(UPH-IV-10T, 四川优普超纯科技有限公司), 分析天平(XS205DU, Switzertand), 数控超声波清洗器(KQ-250DB, 昆山市超声仪器有限公司), 恒温加热磁力搅拌器(CL-2, 巩义市予华仪器有限责任公司), 电热恒温鼓风干燥箱(DHG-940A, 巩义市予华仪器有限责任公司), 台式离心机(DTS-4A, 上海安亭科学仪器厂), 回流装置(蒸醇/回流用冷凝管, 500 mL三颈瓶, 烧杯铁架台, 软管, 三角锥瓶, 温度计)。
醋酸锌(Zn(CH3COO)2· 2H2O, 99.0%, 北京化工厂), 氢氧化锂(LiOH· H2O, 90.0%, 天津市化学试剂三厂), 乙醇(CH3CH2OH, 99.7%, 北京化工厂), 正己烷(C6H14), 碘(I2, 北京化工厂), 镁条(Mg), 芦荟大黄素(C15H10O5, 97.0%, 梯希爱(上海)化成工业发展有限公司), 所有溶液的配置均使用超纯水, 芦荟的品种是库拉索芦荟。
1.2.1 ZnO 纳米粒子的制备与表征
ZnO纳米粒子的制备使用溶胶-凝胶法: 将打磨好的镁带剪成小段与适量的碘混合, 放入三颈瓶中, 倒入100 mL普通乙醇。 升温70 ℃搅拌加热, 至溶液反应呈灰白色时, 加入400 mL普通乙醇, 继续搅拌加热温度设置为85 ℃, 得到绝对乙醇密封保留。 取绝对乙醇100 mL与一定量的醋酸锌一同放入已经固定好的三颈瓶中, 80 ℃搅拌回流3 h, 至溶液透明澄清, 得到醋酸锌的醇溶液。 取100 mL绝对乙醇与适量的氢氧化锂冰水浴超声, 至完全溶解, 得到氢氧化锂的醇溶液。 将已制得的LiOH醇溶液按照摩尔比1.4: 1的比例加到Zn(CH3COO)2醇溶液中, 冰水浴超声约20 min, 得到氧化锌胶体, 按体积比4: 1的比例加入正己烷, 静置产生沉淀。 去除上清液, 将沉淀离心、 清洗、 干燥, 最后在研钵中研磨得到ZnO纳米粒子。 利用透射电子显微镜和X射线衍射仪来表征ZnO纳米粒子的形貌和尺寸。
1.2.2 荧光显微镜观察AE分布
用刀片切取新鲜库拉索芦荟叶片, 纯净水连续冲洗几次, 去掉芦荟叶肉中透明的储水组织, 通过徒手切片法分别采用横向和纵向的方式切取芦荟叶片薄片, 长约10 mm, 宽约5 mm, 厚约200 μ m, 放在干净的载玻片上, 立即置于荧光显微镜下, 分别在白光(下照明)、 蓝光(460~490 nm)和紫外光(330~385 nm)下观察AE等蒽醌类化合物在芦荟叶片中的分布并拍照。
1.2.3 ZnO纳米粒子对AE颜色的影响
切下一片库拉索芦荟叶片放到烧杯里, 收集芦荟叶片同化组织的渗出物, 这种物质的主要成分是AE。 加入一定比例的纯净水将AE稀释, 得到新鲜的AE溶液。 分别配置6和10 mg· L-1的ZnO纳米粒子悬液, 超声30 min, 与AE溶液按一定比例混合作为实验组。 没有加ZnO NPs悬液的AE溶液是对照组。 将对照组和实验组排列在一起, 先后置于紫外灯(254 nm, 30 W)和黑暗条件下, 6 h内每隔一定时间拍照观察其颜色的变化情况。
1.2.4 ZnO纳米粒子对AE光谱的影响
配置10 mg· L-1的AE溶液, 放入搅拌子超声5 min, 加热30 min至几乎完全溶解, 温度设定为50 ℃, 研究表明此温度几乎不会使芦荟苷遭到破坏[12]。 另配置10 mg· L-1的ZnO纳米粒子悬液, 超声30 min。 将ZnO纳米粒子与AE溶液混合作为实验组, AE溶液作为对照组, 在日光灯下放置, 隔一小时测试一次荧光光谱, 设置激发光波长是460 nm, 波长范围选择480~800 nm。
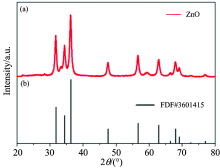
图1(a)是溶胶-凝胶方法获得的ZnO纳米粒子的XRD图, 图1(b)是六角纤锌矿结构的ZnO纳米粒子的标准图谱(PDF#36-1415)。 通过对比可以发现, 我们制备的ZnO纳米粒子为六角纤锌矿结构。
图2(a)为溶胶-凝胶法得到的ZnO纳米粒子的TEM图, 图2(b)是局部放大图, 从图中可以看出, 制备的ZnO纳米粒子均呈球形结构, 分散性良好, 晶体粒径的大小约为5 nm左右, 这与Scherrer公式从XRD计算得到的结果基本是一致的。
在荧光显微镜下, 芦荟叶片的横切面分别经白光(下照明)、 蓝光和紫外光照射, 显微图像如图3(a), (b)和(c), 可以观察到白光下芦荟叶片的储水组织接近透明无色; 向储水组织凸起的部分是维管束, 呈现深褐色; 组成同化组织的绿色细胞清晰可见, 细胞内部是近似透明的, 因为内部有大型的液泡结构。 在蓝光照射下, 芦荟叶片中同化组织细胞发出红色的荧光, 这是因为其内部含有叶绿体, 维管束发出亮黄色荧光, 储水组织几乎无色。 图3(b)可以清晰地看到维管束和靠近维管束一侧的同化组织与储水组织的交界处有发亮黄色荧光的小球点, 但是与维管束周围的荧光相比要弱, 维管束处黄色荧光最强。 这是因为同化组织细胞被认为是AE等蒽醌类物质合成的场所, 然后转移到维管束周围的大型细胞内储存, 即所谓的芦荟素细胞[13]。 图3(c)是在紫外光照射下, 可以看到维管束细胞内发出橙色的荧光, 同化组织和储水组织的接触面以及一些同化组织细胞中也会有橘色的荧光, 但是强度比维管束外侧细胞内的弱。
 | 图3 荧光显微镜下观察芦荟叶片中AE的分布Fig.3 The distribution of aloe-emodin in aloe leaves under fluorescence microscope |
在荧光显微镜下, 芦荟叶片的纵切面分别在白光(下照明)、 蓝光和紫外光照射下, 显微图像如图3(d), (e)和(f), 发现同化组织发红色的荧光, 维管束均呈现带状分布, 在白光下是深褐色带状[图3(d)], 蓝光下是亮黄色带状分布[图3(e)], 紫外光下维管束周围有发橙色荧光的小球点[图3(f)]。 与横切面不同的是, 从纵切面的角度观察可以更清晰全面地了解AE在叶片中的分布情况。
2.3.1 暗处理
在暗条件下经ZnO纳米粒子处理后AE溶液颜色的变化情况如图4。 对照组是不加ZnO纳米粒子的AE溶液, 呈现淡黄色, 随着时间增加, 颜色几乎没有发生变化。 加入6与10 mg· L-1的ZnO 纳米粒子的AE溶液, 随着时间的增加, 颜色变化趋势是淡黄色、 橙黄色、 橙色。 不同的是, 加入10 mg· L-1的ZnO纳米粒子的AE溶液的颜色在放置3 h后就变成了橙色, 颜色的变化速度更快。 说明ZnO纳米粒子与AE发生了相互作用, 导致溶液的颜色由淡黄色渐渐向橙色转变, 并且相对高浓度的ZnO 纳米粒子会加快AE溶液的颜色变化。
 | 图4 暗处理下ZnO 纳米粒子对AE溶液颜色的影响Fig.4 Effect of ZnO nanoparticles on the color of Aloe-emodin solution under dark treatment |
2.3.2 紫外光照射
紫外光照射后AE溶液颜色的变化趋势如图5。 对照组是不加ZnO纳米粒子的AE溶液, 溶液颜色是淡黄色, 随着时间增加, 溶液颜色没有发生变化; 加入ZnO纳米粒子后, 随着作用时间增加逐渐向玫红色转变。 因为溶液的正上方对着紫外灯, 所以从对照组来看, 颜色的变化是从溶液的液面开始, 随后溶液的内部也逐渐变成玫红色。 而加入6和10 mg· L-1的ZnO纳米粒子的AE溶液颜色的变化趋势是淡黄色、 橙黄色、 橙色、 橙红色, 与对照组相比, 颜色改变在溶液内部和表面同时发生, 说明ZnO纳米粒子是导致溶液颜色发生变化的原因。 而且对照组溶液颜色随时间增加变成了玫红色, 实验组溶液颜色随着时间增加变成了橙红色, 即不加ZnO纳米粒子的AE溶液与加入ZnO纳米粒子的AE溶液的颜色变化趋势不同, 说明ZnO纳米粒子能够导致AE溶液的颜色发生变化, 并且与紫外光引起的颜色变化是不同的。
 | 图5 紫外光照射下ZnO 纳米粒子对AE溶液颜色的影响Fig.5 Effect of ZnO nanoparticles on the color of Aloe-emodin solution under ultraviolet light |
对比黑暗条件与紫外光处理后AE溶液颜色的变化情况, 我们发现黑暗条件下, 不加ZnO纳米粒子的AE溶液颜色不随时间变化。 紫外光照射时, 由于AE结构的特点[14], 导致其性质不稳定, 在紫外光的作用下, 与溶解氧发生如下反应:

分子结构中的酚羟基被氧化成羰基, 结果导致溶液颜色由淡黄色变成玫红色。
但是加入ZnO 纳米粒子后, 黑暗条件下, 溶液颜色随时间增加由淡黄色变成橙黄色; 紫外光处理后, 溶液颜色的变化趋势是淡黄色、 橙黄色、 橙色、 橙红色。 可以发现此时ZnO纳米粒子是导致AE溶液颜色变化的主要原因, 但是紫外光照射会加快溶液颜色的变化。 这可能是因为ZnO 纳米粒子在水溶液中溶解形成氢氧根离子, 可以与AE发生如下反应:
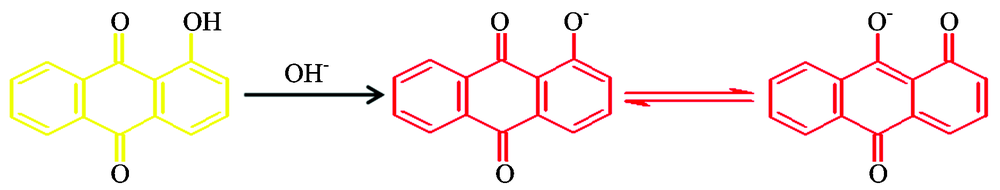
分子中的酚羟基变成— O— , 导致溶液颜色呈现上述变化。 在紫外光的照射下, ZnO纳米粒子可能发生光催化, 使其表面产生更多的羟基自由基, 加快AE分子结构中的酚羟基的反应。
上述两种变化都会使得AE苯环上的羰基与酚羟基的数目和位置发生变化, 因为羰基是AE的生色团, 酚羟基是AE的助色团, 它们的变化都会导致AE发生变色反应。 颜色变化的大致规律是助色团愈多, 颜色愈深。 以上说明AE与ZnO纳米粒子发生反应后, 可以减少溶液中的超氧自由基和羟基自由基, 起到抗氧化的作用, 所以在实际应用中, AE也被广泛地用作抗氧化剂的成分[15]。
对于酚类物质的抗氧化性质之前也有过报道。 Ignat等[16]发现酚类物质的抗氧化活力取决于其结构, 特别是羟基的位置和数目以及苯环上取代基的性质。 而且抗氧化强度通常随着羟基个数的增加而增加, 芳族羟基化合物的抗氧化效果具有很大的研究价值与应用价值[17]。 Lien等[18]也发现不同的黄酮类物质的抗氧化能力主要由黄酮类物质分子上羟基的数量和匣置决定。
图6是AE水溶液在空气中放置0, 1, 2, 3, 4, 5和6 h后的发射光谱。 其中图6(a)是AE溶液的发射光谱随时间的变化规律, 图6(b)是将得到的光谱分峰拟合后的结果, 图6(c)是540与580 nm处的荧光峰比值随时间的变化规律。 可以发现, 随着时间增加, 荧光峰的位置基本没有发生变化, 分别是500, 540, 580和620 nm, 但是强度发生了相对变化。 虽然540 nm处的峰值与580 nm处的峰值均在逐渐升高, 但是540 nm处的峰值升高的幅度大于580 nm处的峰值, 即540与580 nm处的荧光峰比值逐渐增加。 由于AE与氧发生反应, 使得分子中的羟基变成羰基, 由C─O变成了C=O , 这些基团中含有π 电子, 可以发生π → π * 跃迁。 芦荟大黄素的荧光光谱中, 540 nm处的荧光峰是由于C=O 形成的大共轭π 电子结构, 发生π → π * 跃迁产生的。 而580 nm处的荧光峰是由于— O— 的非成对n电子被激发后, 发生n→ π * 跃迁到激发态, 再发生辐射跃迁产生荧光。 因此, 随着时间增加, 540与580 nm处荧光强度的比值增加的原因可能是AE苯环上C=O 增多, 导致π → π * 跃迁增加, 进而540 nm处的发光峰强度增加。
经ZnO纳米粒子处理0, 1, 2, 3, 4, 5和6 h后, AE溶液的荧光光谱如图7。 图7(a)是在ZnO纳米粒子作用下, 随着时间增加, AE溶液发射光谱的变化趋势, 图7(b)是将得到的光谱分峰拟合后的结果, 图7(c)是540与580 nm处的荧光峰的比值随时间的变化规律。 从光谱中可以发现, 有四个荧光峰, 分别为500, 540, 580和630 nm, 与没有加入ZnO纳米粒子的AE溶液相比, 540和580 nm处的峰值强度比值均随时间的增加而增加, 但是强度比不加ZnO纳米粒子的情形大。 我们发现ZnO纳米粒子使AE溶液颜色发生变化的同时, 溶液的PH值也在增大, 说明ZnO纳米粒子在溶液中发生光催化, 粒子表面产生羟基和超氧自由基, 这些基团具有强氧化性, 可以催化芦荟大黄素发生氧化反应, 使得AE分子中产生更多的羰基, 羰基中的C=O 含有π 电子结构, 增加π → π * 跃迁, 最终导致540 nm处的荧光峰强度增加。
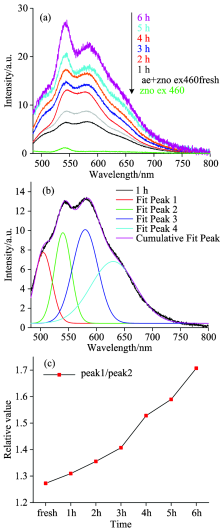 | 图7 ZnO 纳米粒子作用下AE的荧光光谱Fig.7 Fluorescence spectra of aloe-emodin under the action of ZnO nanoparticles |
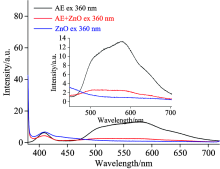
将激发波长设定为360 nm时, AE溶液、 ZnO纳米粒子处理后的AE溶液与ZnO纳米粒子悬液的荧光光谱如图8。 从图中可以明显地看出, ZnO纳米粒子作用于AE溶液后, 与AE溶液的荧光峰比较, 500~630 nm间的荧光峰强度均减弱; 并且540与580 nm峰值相比接近于1, 而不加ZnO纳米粒子的峰值相比小于1, 变化幅度很大, 说明ZnO纳米粒子会使AE溶液540与580 nm处的荧光峰比值增大, 可能是因为ZnO纳米粒子与AE发生氧化反应, 导致助色团与生色团的数量和位置发生变化。
通过纵向徒手切片法得到芦荟叶片的薄切片(厚约200 μ m), 利用荧光显微镜观察AE在叶片中的纵向分布; 与横向切片法相比, 更清晰全面地揭示了AE在芦荟叶片中的分布情况。 通过溶胶-凝胶法制备ZnO 纳米粒子, 将它与AE溶液作用, 研究ZnO纳米粒子对AE溶液颜色的影响; 发现ZnO纳米粒子使溶液颜色发生淡黄色、 橙黄色、 橙色、 橙红色的变化。 进一步研究ZnO纳米粒子处理后AE溶液的荧光光谱, 发现芦荟大黄素540和580 nm处的荧光峰比值随着作用时间的增加而增加; 可能是由于ZnO纳米粒子的加入增加了AE苯环上的酚羟基与粒子表面由光照产生的羟基和超氧自由基的反应, 导致AE苯环上的酚羟基变成了羰基, 进而使得AE溶液的pH增强, 溶液颜色发生变化, 荧光峰强度也发生相对改变。 上述研究对于详细了解AE在芦荟叶中的分布情况, 揭示AE的产生和储存场所, 以及全面评价ZnO纳米粒子对芦荟的毒性作用具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|