作者简介: 李苑溪, 1992年生, 中国科学院地理科学与资源研究所硕士研究生 e-mail: liyuanxi_bnu@yeah.net
采用5级梯度铜胁迫砂培试验, 通过测定叶片反射光谱曲线和叶绿素含量, 研究铜胁迫对玉米叶片反射光谱与叶绿素含量的影响。 研究表明: 玉米叶片反射光谱的红边位置与铜胁迫浓度显著相关( R2≥0.5755), 且存在明显的“红边蓝移”现象, 即叶片光谱红边位置向短波方向移动。 随着铜胁迫浓度的升高或胁迫时间延长, 红边蓝移程度增加。 不同胁迫浓度之间, 叶绿素a、 叶绿素b含量及二者比值 (Chla/Chlb)均差异显著( p分别为0.002, 0.007和0.001)。 叶绿素a、 b比值(Chla/Chlb)与培养液中铜浓度呈显著负相关( R=-0.898); Chla/Chlb与平均红边波长显著正相关( R=0.814)。 这表明随着铜胁迫浓度升高, Chla/Chlb降低, 叶绿素b相对于叶绿素a升高, 叶片反射光谱的红边位置蓝移。 铜胁迫改变了玉米叶片中Chla和Chlb含量和比值, 由此导致的色素吸收光谱变化, 是铜胁迫导致叶片反射光谱红边蓝移的可能的生理学成因。
The effects of Cuprum stress on reflectance spectra and chlorophyll content of maize leaves were studied by corn planting under 5 different Cu2+ concentration treatment. During the indoor experiment, hyperspectral reflectance and the corresponding contents of chlorophyll of leaves of maize seedling were measured and their changing trends and relationships between Cu2+ concentration, chlorophyll content and red edge position (wavelength of reflection spectra) were analyzed. Results showed that the corn leaf reflection spectra had the obvious “blue shift of red edge” phenomenon, namely the red edge position of leaf spectra moved to short wave. The red edge position significantly correlated to Cuprum concentration ( R=0.76), i. e. the blue shift of red edge increased with Cuprum concentration. In the meanwhile red edge blue-shifts increased with the extension of stress time. The chlorophyll a, chlorophyll b content and their ratio (Chla/Chlb) were significantly different between the five stress treatments ( p=0.002, 0.007, 0.001). The content of chlorophyll covaried with Chla/Chlb. At the same time, Chla/Chlb and the concentration of Cuprum in the culture solution showed negative and significant correlation ( r=-0.898), whilst, Chla/Chlb was significant and positively correlated with the mean red edge position ( r=0.814). These results indicated that the blue shift of red edge of the reflectance spectra in the leaves of maize caused by Cuprum stress should attributed to the increase of chlorophyll b relative to chlorophyll a, which changed the leaf absorption spectrum and altered the red edge position of leaf reflectance.
引 言
铜污染引起土壤污染和食品安全等急需解决的重大问题, 而遥感技术的发展为快速调查植物受害情况和污染影响范围提供了新的途径。 我国矿区和工业“ 三废” 导致的重金属污染土地面积超过1 000万公顷[1], 已经成为威胁我国水土环境质量与食品安全的重大问题, 其中铜污染占有很大比例。 快速准确地掌握污染影响范围与程度, 对于控制污染、 开展修复与治理意义重大。 随着遥感技术不断发展, 利用高光谱技术, 从光谱数据中提取植物参数, 快速监测铜污染区植被受害情况并推断受影响区域, 成为一个新研究手段。
自20世纪90年代起, 国内外学者就开始尝试利用植物高光谱特征监测植物的生理生态状况, 在植物病、 虫、 营养、 水分胁迫及精准农业相关的领域内开展了诸多研究[2, 3, 4, 5, 6], 建立了评估作物受胁迫程度的分类器等[7, 8]。 发现植物叶片在波长690~720 nm之间的反射光谱曲线斜率最大处, 即植被光谱“ 红边” 是绿色叶片最明显的光谱特征[9, 10], “ 红边” 位置变化指示着植被健康状况的异化[11]。 后续研究通过土培白菜[12]、 水培小麦、 土培玉米[10, 11, 12, 13]等试验, 发现重金属胁迫下叶片光谱红边发生有规律的“ 蓝移” (向短波方向移动), 且“ 蓝移” 程度随着土壤或溶液中重金属元素浓度的增加而增强。 因此, 可以借助叶片红边位置与重金属污染程度间的相关关系评估矿山植被受害及土地污染概况[14]。 但是, 迄今为止的大多数研究集中在监测不同重金属含量下叶片光谱特征及叶绿素变化方面, 包括叶片中重金属或叶绿素含量与反射光谱的关系[10, 11, 13]、 重金属积累与总叶绿素及叶绿素a与叶绿素b的比值(Chla/Chlb)间关系[15, 16, 17]等。 对重金属胁迫下的植物光谱特征变化的机理及土壤污染物浓度-植物叶绿素含量与比值-叶片光谱特征变化间的相互联系与定量关系的研究尚较弱。
本文通过玉米室内砂培试验, 测定不同铜胁迫浓度和时间下的玉米叶片反射光谱的红边位置以及叶绿素含量, 分析了红边位置与铜胁迫浓度及胁迫时间的关系, 探讨了铜胁迫浓度、 叶片中叶绿素含量与组成及红边位置之间的关系, 为铜胁迫下农作物高光谱遥感数据的定量解释提供参考。
本研究采用北方春玉米主产区常用的美国先玉355玉米种子, 在中国科学院地理科学与资源研究所水循环与地表过程重点实验室的气候控制室内砂培。 具体过程: 将在0.2 mmol· L-1 CaSO4溶液中浸泡12 h后的玉米种子放置在25 ℃生化培养箱中催芽。 2 d后挑选露白一致且长势旺盛的30颗种子播种在石英砂上。 播种后立即为每套盆加入Hoagland完全营养液1 400 mL, 3 d后回收并重复利用培养液, 再2 d后更换培养液。 整个砂培过程中循环这一供液过程。 培养过程中, 参照2003年夏季北京实测气象数据, 通过总控系统严格控制气候条件: 以专用日光灯为光源, 每天光照12 h, 温度每天分8段或6段按照对应时段的平均温度设置, CO2浓度0.4‰ , 相对湿度60%~50%。
| 表1 试验玉米分组铜胁迫处理及各组植株数量 Table 1 The plant amount in experimental groups and control group |
苗龄10 d时选取生长良好并且生长状况一致的28棵玉米苗, 移栽入11个盆中, 仍然用砂固定。 苗龄27 d时, 在营养液中添加CuSO4· 5H2O, 设置5级梯度铜胁迫处理, 即空白对照(Hoagland完全营养液, 铜浓度0.32 μ mol· L-1, 为植物生长所需)、 20, 50, 80和100 mg· L-1。 每个铜处理浓度下设5株, 分栽在2盆中, 形成5浓度5重复(共10盆, 25株玉米)。 另栽3株作为备份, 按空白对照组处理。 各处理组玉米株数如表1所示。 整个试验持续63天, 直至空白对照组植株抽雄时结束。
1.2.1 叶片反射光谱测定
在苗龄25 d(铜处理前)和铜处理后第20天、 第27天、 第34天, 选取各级铜胁迫浓度下植株上部的展开良好的叶片, 用便携式SVC HR-1024全谱段地物光谱仪(美国Spectra Vista Corporation制造), 配合ASD A122317-355叶片夹及其自带光源, 去除外界光照下测定叶片反射光谱。
测定中, 每30 min加测一次叶片夹白板反射值作为校正, 叶片反射率Rs以二者之比表示, 计算公式如式(1)
式(1)中, Rs为样品反射率, Is为样品反射值, Ir为白板反射值。 用二者之比消除误差。
叶片宽度如果超过叶片夹直径, 取一片叶子测量; 如果小于叶片夹直径, 则选相同处理的相似植株的相似叶片, 用胶带拼接固定后测量, 并尽量不剪下叶片, 测量后复位。 每一胁迫水平下, 至少测2片(组)。 若同一胁迫浓度下玉米叶片颜色出现分化, 则每种颜色的叶片都采集一次。 例如铜胁迫浓度20 mg· L-1组, 出现绿色、 黄色、 黄绿条纹3种叶片, 则至少测量3次。 对一片(组)叶子采集光谱时, 多次测量, 对照正常玉米叶片反射光谱曲线, 选取形状正常、 反射率合理、 彼此相近的曲线1~3条, 编号记录。 整个试验过程共成功采集了不同铜胁迫浓度下的玉米叶片反射光谱曲线64条。
1.2.2 叶绿素含量测定
在砂培试验结束的前一天, 即铜胁迫处理后第35天, 摘取前一天测量了光谱的叶片, 每级胁迫浓度下4~6叶(5 g左右), 共11份, 分别用密封袋包装, 送至北京农业质量标准与检测技术研究中心, 用直接干燥-重量法测定水分含量, 95%乙醇浸提后用分光光度法比色测定叶绿素a(chla)、 叶绿素b含量(chlb)。
1.3.1 红边位置计算
从SVC HR-1024光谱仪导出玉米叶片反射光谱数据, 以波长为x坐标、 反射率为y坐标, 绘制光谱曲线。 根据光谱曲线的形状和数值范围, 舍弃有明显错误及光谱值过高或过低的曲线, 选取能代表各级胁迫水平下叶片光谱特征的曲线。 进而对选取的光谱曲线对应数据进行一阶微分, 以确定红边位置。
式(2)中, ρ '(λ i)为波长λ i位置的反射率一阶微分值, λ i+1和λ i-1分别是在λ i之后和之前的波长, ρ (λ i+1)和ρ (λ i-1)为对应波长的反射率, Δ λ 为波长间隔。 受光谱仪影响, 得出的光谱曲线中Δ λ 约为1 nm, 且各波段间距不相等, 而整条光谱曲线波长范围2 164 nm, 相比之下Δ λ 近似为0, 因此将式(2)近似为式(3)计算导数。
得到一阶导数后, 根据红边定义, 截取叶片反射光谱一阶导数在670~780 nm的数值, 在Excel中排序, 找出导数最大值并得到对应的红边波长位置。
1.3.3 统计分析
使用SPSS19软件进行试验数据统计分析。 通过单因素方差分析, 检验不同胁迫浓度下的红边位置差异显著性。 首先进行方差齐性检验, 若显著性水平p> 0.05, 则说明各级铜胁迫浓度间红边位置的方差具有齐次性, 可以进行F检验; 若F检验的显著性水平p< 0.05, 则说明不同胁迫浓度下的红边位置有显著差异。 并建立红边位置与铜胁迫浓度的线性相关关系。
5级铜胁迫浓度下的叶绿素a含量、 叶绿素b含量及其比值Chla/Chlb均不能通过方差齐性检验。 因此采用Jonckheere-Terpstra非参数差异检验方法, 验证5级胁迫浓度下的叶绿素含量及比值是否有单调性差异。 以p< 0.05作为差异显著标准。
采用配对样本T检验, 利用SPSS19的成对样本均值比较功能, 比较铜胁迫20, 27和34 d的各级胁迫浓度下红边波长平均值是否有显著差异。
利用铜胁迫第34天采集的光谱数据和次日摘取的对应叶片的叶绿素含量数据, 通过计算Spearman非参数相关系数(不要求方差齐性), 分析叶绿素含量与铜胁迫浓度及铜胁迫浓度、 红边位置与Chla/Chb的非参数相关性, 并分别建立Chla/Chlb与铜胁迫浓度、 Chla/Chlb与红边波长间的相关模型。
不同铜胁迫浓度下玉米叶片反射光谱的红边位置如表2, 随着铜胁迫浓度的升高, 红边位置向短波方向移动(即红边蓝移), 而且不同胁迫时间下的红边位置有差异。 铜胁迫20和34 d的红边位置数据, 分别通过了方差齐性检验和F检验(方差F检验的显著性水平分别为0.001和0.002), 表明铜胁迫对叶片光谱红边位置有显著影响。 试验中单次测量红边位置最低为687.1 nm(铜胁迫浓度100 mg· L-1), 最高为711.3 nm(对照组), 极差达24.2 nm。 土培条件下的研究也表明, 随着铜污染程度的加深, 红边位置可从无污染的718 nm过渡到污染最严重的687 nm。 与砂培试验所得红边位置变化范围近似, 只是土培更接近玉米的自然生长状态, 其空白对照组发育更好, 红边位置更高。
| 表2 各级铜胁迫浓度下的平均红边位置(nm) Table 2 Average positions of red edge (nm) |
将铜胁迫34 d的红边位置数据按胁迫浓度分组(见图1), 齐性检验的显著性水平p=0.136> 0.05; F检验的显著性水平p=0.002< 0.05, 证明不同铜胁迫水平下的红边位置存在显著差异。 铜胁迫20, 27和34 d时红边位置与铜胁迫浓度呈负相关(如表3), 其中第27天的相关性最好(R2=0.630 7)。 说明红边的蓝移能够在一定程度上反映玉米受铜胁迫的程度。
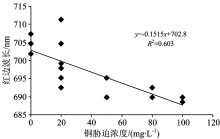 | 图1 铜胁迫浓度与红边位置的关系以铜胁迫34天数据为例, 其他时间的结果与此类似Fig.1 The correlation between the red edge position of corn leaf spectra and cuprum concentration on the 34th day of exerting cuprum stress |
| 表3 红边位置与铜胁迫浓度线性相关关系 Table 3 The linear correlation of red edge position and cuprum concentration |
不同胁迫时间长度下红边位置的差异显著性检验结果见表4, 铜胁迫20与34 d的红边波长平均值之差为1.32 nm, p=0.037差异显著, 即铜胁迫34 d时红边相较于胁迫20天时进一步蓝移。 表明随着铜胁迫时间的延长, 玉米受铜的毒害作用加深, 叶片反射光谱的红边位置蓝移程度增加。 另外, 铜胁迫20 d与27 d、 27 d与34 d的红边位置差异并不显著, 说明胁迫时间间隔可能存在阈值, 间隔超过此阈值, 红边蓝移程度才能显著增加。 相关研究中也发现, 重金属胁迫时间的延长会导致植物叶绿素含量和红边位置的变化加强。 如宋鹏飞对处在Pb, Cu, Zn复合污染中的灰化苔草的研究, 发现叶片反射光谱红边位置在苗期时 “ 蓝移” 了 5 nm, 伸长期时最多“ 蓝移” 了 15 nm, 成熟期时达到最高的“ 蓝移” 量, 为20 nm。 有研究发现, 镉胁迫空心菜15天时, 较高浓度处理组(10和20 mg· kg-1)的叶绿素a、 总叶绿素含量显著降低; 随着胁迫时间的延长, 在胁迫30天时, 中浓度处理组(5 mg· kg-1)的叶绿素a和总叶绿素含量也开始降低。
| 表4 铜胁迫20与34 d红边位置差异显著性检验 Table 4 Paired-samples T-test about red edge position under cuprum stress for 20 and 34 d |
2.3.1 叶片叶绿素含量和Chla/Chlb随胁迫浓度的变化
不同铜胁迫浓度下的叶绿素含量通过了Jonckheere-Terpstra检验。 在5级胁迫浓度中, 叶绿素a、 叶绿素b及全叶绿素含量的显著性水平分别为0.002, 0.007和0.002, 均小于预设的置信水平0.05, 说明各级胁迫浓度之间叶绿素含量差异显著, 且差异呈单调性, 意味着铜胁迫浓度越高则叶绿素含量越少。 非参数相关的Spearman相关分析表明, 叶绿素a、 叶绿素b、 全叶绿素含量与铜胁迫浓度均显著负相关, 相关系数分别为-0.871, -0.796和-0.871。
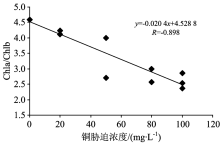
5级铜胁迫浓度下的Chla/Chlb同样通过了Jonckheere-Terpstra检验, 显著性水平p=0.001。 说明各试验组的Chla/Chlb随着铜胁迫浓度的加大而显著降低, 即铜胁迫可以使叶绿素a比例降低而叶绿素b比例升高。 同时, Chla/Chlb与铜胁迫浓度呈显著负相关(R=-0.898), 说明铜胁迫浓度越大, 叶绿素a比例越小、 叶绿素b比例越高(图2)。 国外已有对莎草属、 藜属、 马唐属植物[15]、 浮萍属植物[16]及藻类[17] 的相关试验研究, 结论一致认为重金属积累导致植物总叶绿素降低, 同时会使叶绿素a与叶绿素b的比值Chla/Chlb降低, Chla/Chlb可作为植物受重金属污染的早期预警指标[18]。
重金属胁迫使植物叶片Chla/Chlb降低, 主要是因为叶绿素a与叶绿素b在胁迫条件下的响应机制存在差异。 有关研究发现, 在环境胁迫下, 叶绿素a的水解率升高快于叶绿素b[17, 19, 20]。 叶绿素a 与叶绿素b相比, 它既是光反应的中心色素, 又是天线色素[21]。 在重金属胁迫下, 叶绿素a受影响也会更强。 重金属铬对小麦叶绿素的影响试验[25]、 复合重金属(铅、 锌、 镉、 铜)胁迫尖叶走灯藓的试验也都表明, 叶绿素a对外界环境反应较叶绿素b 敏感, 在重金属处理下, 叶绿素a的降解明显更高。 在高浓度重金属胁迫下, 藓类植物中大量聚光色素尤其是作为光合作用中心的叶绿素a的受破坏程度要高于叶绿素b[22], 叶绿素a损失也更多, 从而导致Chla/Chlb随胁迫浓度增加而降低。
2.3.2 Chla/Chlb与叶片反射光谱红边位置的关系
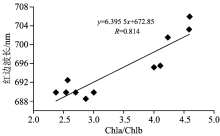
非参数相关分析表明, Chla/Chlb与叶片反射光谱平均红边波长正相关(如图3), 表明随着Chla/Chlb降低, 红边蓝移程度更深。
形成这种相关关系的原因在于, 叶片内含色素通过吸收和反射光来影响叶片的反射光谱, 叶片光谱特征(包括红边位置)变化是色素变化的反映。 叶片光学属性是叶片各种色素吸收系数、 色素含量及其叶片光学属性影响因子的综合表征[23]。 植物叶片对太阳辐照能量的吸收是叶片色素含量的函数[24], 而按照辐照能量守恒原理(反射率+吸收率+透射率=1), 叶片的反射光谱和透射光谱也是色素吸收函数。 叶绿素、 类胡萝卜素和水是叶片吸收光的主要物质, 因此色素(主要是叶绿素和类胡萝卜素)的吸收光谱曲线及含量显著影响着叶片的反射光谱。 Rü hle与Wild发现萃取叶绿素的吸收峰比完整叶片的叶绿素光谱特征峰向短波方向偏移20 nm, 而与活体叶片中吸收光谱曲线的走势相似[25]。 由此可通过色素标准样品在有机溶剂中的吸收光谱特征, 推测叶片中各种色素吸收光谱的特征, 从一定程度上反映叶片反射光谱。
玉米总叶绿素只包括Chla和Chlb, 两者吸收峰位置不同, 对应反射率曲线存在差异, 因此对叶片反射光谱产生不同的影响[26]。 叶片中叶绿素的吸收光谱曲线也存在红边, 而水、 类胡萝卜素的吸收光谱曲线不存在红边, 叶片中其他成分对光的吸收作用小, 所以是叶绿素导致了叶片光谱红边的出现, 叶绿素的变化(包括两种叶绿素的比例变化)也将导致红边的变化。 叶绿素a、 b的光谱吸收峰分别在660~670和645~650 nm之间, 随所采用的溶剂和试验条件不同而有一定变化[26, 27, 28, 29]。 当波长超过吸收峰位置则两种叶绿素的吸收率迅速下降, 对应着反射光谱强度在红光波段内(770~622 nm)的迅速上升[29, 30]。 叶绿素b在红光波段的吸收峰位置比叶绿素a更偏短波, 距离大约16~20 nm[26, 27, 28, 29], 其吸收光谱曲线下降波段也在叶绿素a之前[29, 30]。 又因为红边即是反射光谱曲线上升速率最大、 而吸收光谱曲线下降速率最大处, 因此叶绿素b的红边位置在叶绿素a之前, 即叶绿素b的红边位置比叶绿素a更偏短波。 试验表明叶绿素a的红边大约在662.5~700 nm之间、 叶绿素b的红边大约在645.2~675 nm之间[29, 30]。
在本试验中当Chla/Chlb降低, 即叶绿素b比例升高时, 叶片反射光谱更多地反映叶绿素b的特性, 从而使叶片反射光谱的红边位置更偏短波, 出现红边蓝移现象。 因此玉米叶片Chla/Chlb与反射光谱平均红边位置呈现显著正相关。
在室内砂培条件下, 铜胁迫浓度-玉米叶片反射光谱红边波长-叶片中叶绿素含量之间存在一定的相关关系:
(1)随着铜胁迫浓度升高, 玉米叶片反射光谱红边对应的波长不断显著减小, 铜胁迫34 d显著性水平p=0.002< 0.05, 红边位置向短波方向移动的“ 红边蓝移” 现象明显, 铜胁迫20, 27和34 d的红边波长与铜胁迫浓度均有相关性, R2分别为0.576, 0.631和0.603。 随着胁迫时间的延长, 玉米受铜的毒害作用加深, 叶片反射光谱的红边蓝移程度增加。 铜胁迫34 d的反射光谱红边波长相对于铜胁迫20 d时更低, 差异显著p=0.037, 表明红边出现进一步蓝移。
(2)叶片中叶绿素a、 叶绿素b、 全叶绿素含量随铜胁迫浓度的增加而显著降低, 显著性水平分别为0.002, 0.007和0.002。 叶绿素a、 b比值(Chla/Chlb)随着铜胁迫浓度的加大而单调降低, p=0.001, 相关系数R=-0.898。 同时, 反射光谱的平均红边位置随Chla/Chlb的降低而显著降低, 相关系数R=0.814。 表明铜胁迫浓度越大, Chla/Chlb越低, 叶绿素b比例相对升高, 红边波长趋小。 铜胁迫导致玉米叶片中Chla/Chlb降低、 叶绿素b比例升高是叶片反射光谱红边蓝移可能的生理学原因。
致谢: 试验开展过程中, 得到北京师范大学屈永华副教授、 刘志刚副教授和李晓兵教授、 中国科学院地理科学与资源研究所的乔云峰高级工程师的大力帮助, 谨表谢意。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|