作者简介: 岑海燕, 女, 1982年生, 浙江大学生物系统工程与食品科学学院研究员 e-mail: hycen@zju.edu.cn
作物优良品种选育是实现作物优质高产的关键。 现代育种方法需要获取植株的大量表型信息, 最终选育出性状稳定的优良品种。 近年来, 高通量植物表型分析技术因其快速、 无损、 高效等优势, 为筛选优良作物品种提供了技术保障, 已成为农学、 工程、 计算机科学等多学科交叉研究的热点。 其中, 叶绿素荧光技术作为植物光合作用的探针, 是研究植物逆境胁迫表型的有力工具之一, 能够实现植物生物与非生物胁迫的高效分析, 加快作物优良性状的筛选。 该文旨在阐述叶绿素荧光技术的研究进展和发展趋势, 主要介绍了叶绿素荧光技术的基本原理和成像系统、 叶绿素荧光参数的分析和处理方法, 总结了在植物表型分析研究中的应用情况, 探讨了该技术目前存在的问题和改进的方法, 进一步展望了叶绿素荧光技术在植物表型分析中的应用前景。
Plant breeding is important for increasing the yield and improving the quality of crop. Modern techniques of plant breeding require various phenotypic traits obtained from a large number of crops in order to cultivate varieties with useful traits. Researchers have been interested in developing nondestructive, fast and efficient plant phenotyping techniques, which could bridge the knowledge gap between the plant phenotype and the genotype. The chlorophyll fluorescence imaging can provide information related to the plant photosynthesis as one of the useful tools in the current phenotyping techniques, which can be used in plant responses to biotic and abiotic stresses and promote the selection of useful plant traits. This paper presents a brief introduction of fluorescence imaging system, methods of fluorescence image analysis and applications in plant phenotyping, and demonstrates challenge issues, technical solutions and potential applications of chlorophyll fluorescence imaging in plant phenotyping.
随着人口的急剧增长, 农作物生产和粮食安全问题面临巨大挑战。 优良作物品种的快速筛选是解决全球作物产量问题较为有效的方法之一。 植物表型分析技术是筛选优良作物品种方法中研究植物基因功能和环境效应的关键步骤, 不仅适于研究外观物理特性, 还可以研究植物生长发育过程中基因型与环境因素相互作用所产生的生理生化特性以及植物基因型与表型映射关系, 已受到科研工作者的广泛关注[1]。
截至2017年11月19日, 在Web of Science以“ Phenotyping” 与“ Plant” 为关键词进行检索得到植物表型分析技术的相关文献总数高达1 453篇, 且呈逐年增长趋势。 近年来, 高通量植物表型分析技术通过整合传感器、 自动控制、 环境调控以及数据挖掘等多种先进技术, 有效地解决传统植物表型分析技术中存在的费时费力、 精度低、 适用性弱等问题, 为阐明不同环境因子及基因型对植物生长、 产量、 质量、 生理状态的影响及研究植物不同表型间的关系提供了有效的帮助。 其中, 光学技术以其非接触性、 快速、 无损伤、 高灵敏度、 高分辨率等优势为高通量植物表型分析提供了技术支撑。 光学成像技术主要包括RGB成像、 多光谱/高光谱成像、 叶绿素荧光成像和热红外成像等, 这些技术在获取植物的叶/冠层形态生长模型[2, 3]、 逆境响应[4]、 养分生理[5]、 光合作用[6]、 冠层温度[7]等信息上具有很大的优势。 其中, 叶绿素荧光技术可以通过对叶绿素荧光的探测分析PSII内的生理反应过程, 如光化学反应、 热散失等, 能反映实际生物学意义, 该技术已应用于植物的逆境生理检测[8]、 病虫害检测[9]、 光合作用机理[10]及抗逆性生理[11]等研究。 此外, 结合图像技术, 可以较好地反映植物在叶片和冠层水平的光合生理的空间异质性。 叶绿素荧光图像信息量丰富, 利用数据挖掘、 机器学习等方法可进一步挖掘图像的潜在信息。 由于叶绿素荧光技术的多种优势, 在高通量植物表型分析中的应用也越来越广。
本文以叶绿素荧光技术在植物表型分析中的研究为主题, 介绍了叶绿素荧光技术的概况和叶绿素荧光数据分析方法, 概述了国内外学者利用叶绿素荧光技术在植物表型研究如生物胁迫、 非生物胁迫和作物优良性状筛选的进展, 最后讨论了该技术存在的主要问题和应用前景, 对叶绿素荧光技术在植物表型分析中的应用具有借鉴和指导意义。
绿色植物光合作用能量的转换过程包括原初反应、 电子传递和光合磷酸化和碳同化三个阶段。 其中, 叶绿素荧光在原初反应过程中产生, 它是由叶绿素分子吸收光能后到达激发态重新发射比吸收光波长更长、 能量更低的光子所产生, 如图1。 1931年, Kautsky等发现叶绿素荧光现象, 为研究植物光合作用提供了理论基础。 目前, 叶绿素荧光技术主要以Bulter的光合作用能量竞争模型为基础, 即叶绿素分子吸收的光能通过光合系统的光化学反应、 热散失和叶绿素荧光三个途径释放能量, 通过检测植物的叶绿素荧光能间接反映植物光合系统对光能的吸收、 传递、 耗散和分配。 1986年, 德国乌兹堡大学的Schreiber发明了基于饱和脉冲理论的脉冲振幅调制叶绿素荧光仪, 使得光化学猝灭和非光化学猝灭的测量成为可能, 实现了不同环境状态下植物荧光信号的检测[13]; 随后德国的Walz、 英国的Hansatech、 捷克的Photo Systems Instruments等公司相继开发了商用的叶绿素荧光仪和成像系统。
 | 图1 叶绿素分子的能级变[12]Fig.1 The energy level of the chlorophyll in PSII |
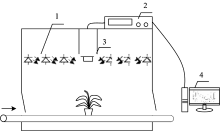
叶绿素荧光成像系统克服了传统荧光仪有限点测量的缺点而被逐渐广泛应用。 系统一般包括激发光源、 滤波片、 检测器、 计算机和控制模块等, 可以获得植物叶片或冠层的叶绿素荧光信号, 结合数字图像处理技术可分析荧光强度在空间的分布情况, 如图2。 不同的测量方案可以获得不同的荧光诱导猝灭曲线, 其中光源和光照模式的设置是方案选择的关键。 光源的主要类型有测量光、 光化光与饱和光。 测量光用于激发暗适应后最小荧光(Fo), 通常选择蓝光或红光; 光化光是一种近似自然光的光源, 光化光的光强与自然光十分相近, 研究人员通常选择蓝光或红光使植物的光合系统产生实质上的光化学反应; 饱和光的光强度超过植物光合系统的捕光能力, 使叶绿素荧光强度达到最高, 通常选择白光(> 8 000 K)[14]。 不同光照模式可以获取不同的光合作用信息: 微秒级或者更小的闪光(Flash)可以观测PSII供体和受体侧电子传递反应; 毫秒级的饱和光脉冲(Pulse)能够得到光合电子传递链(electron transport chain, ETC)的信息; 5~10 min的光照可以获得稳定的光合活性信息[15]。
图3为典型脉冲调制(pulse amplitude modulation, PAM)叶绿素荧光系统获得的叶绿素荧光猝灭曲线, 可以获得大量与光合作用相关联的荧光参数, 详见表1所示。 暗适应后最小荧光(Fo)是植物经过充分暗适应后光合反应中心处于完全开放状态时, 打开测量光后获取的荧光强度。 暗适应后最大荧光(Fm)是植物经过充分暗适应后施加饱和脉冲后使光合反应中心处于完全关闭状态时所获取的最大荧光强度, 根据能量竞争模型, 此时天线色素获取的能量主要转化为荧光和热能, 即光合作用利用率最低。 光适应下最大荧光(Fm')是植物叶片在光适应条件下施加饱和脉冲使光合反应中心处于完全关闭状态时获取的荧光强度。 光适应稳态荧光(Fs)是植物叶片光适应下达到稳定状态时获取的荧光强度。 光适应下最小荧光(Fo')是植物叶片在光适应条件下光合反应中心处于开放最大状态时获取的最小荧光强度。
 | 图3 基于饱和脉冲理论的脉冲振幅 调制的叶绿素荧光猝灭曲线Fig.3 A quenching curve based on the pulse amplitude modulation (PAM) technique |
光化学猝灭反映了PSII原初电子受体QA的还原状态, 可以衡量PSII反应中心的开放程度; 非光化学猝灭反映了天线色素吸收的光能用于热耗散的部分, 可以评估植物的光保护能力。 光化学猝灭参数一般与参数Fm', Fs相关, 包括最大光量子效率(Fv/Fm)、 光量子效率(Φ PSII)、 电子传递速率(ETR)、 稳态光适应光化学猝灭(qP)、 基于Lake模型的稳态光适应光化学猝灭(qL)等。 参数Fv/Fm反映了PSII的最大光化学量子产量, 对逆境胁迫的响应较为敏感, 在正常状态下植物的Fv/Fm维持在0.8~0.84之间。 参数Φ PSII是光照条件下光合反应中心的实际光化学量子产量, 用于衡量植株的实际光合效率。 Φ PSII可以用来计算电子传递速率ETR, 由公式ETR=c· Φ PSII· PPFD得到, 其中系数c表征吸收的光子能量在PSII与PSI之间的分配情况, 当c=0.5时表示吸收的光子能量平均分配给PSII和PSI; PPFD表征吸收光的光量子通量, 单位为 μ mol· m-2· s-1。 参数qP为光适应光化学猝灭, 基于常见的沼泽(Puddle)模型[16], 反映了PSII反应中心的开放程度。 参数qL是基于湖泊(Lake)模型[17]的光适应下的光化学猝灭, 同样反映反应中心的开放程度[18]。 非光化学猝灭参数主要有非光化光系数猝灭(qN)、 非光化荧光猝灭(NPQ)、 非光诱导猝灭(Φ NO)、 光诱导下猝灭的量子产额(Φ NPQ)。 前两者基于Puddle模型, 其中参数NPQ可反映PSII吸收的能量以热耗散形式释放的部分, 检测植物逆境响应的灵敏度高于qN[15]。 后两者基于Lake模型, 参数Φ NO是植株的光合损伤指标, 参数Φ NPQ可以反映植株的光保护能力。
| 表1 常用的叶绿素荧光参数及其概念描述[19] Table 1 List of the commonly used chlorophyll fluorescence parameters and their definitions |
叶绿素荧光成像技术提供了植物叶绿素荧光信号在二维空间上的分布信息, 如图4为拟南芥的叶绿素荧光图像。 叶绿素荧光图像结合数字图像处理技术可以较好地反映出光合作用在叶片或冠层水平上的时空异质性, 已广泛应用于植株非生物胁迫和生物胁迫检测, 如干旱[20, 21]、 冻害[22]、 细菌[9]、 真菌[23]及病毒胁迫[24, 25, 26]等。 2012年, Sperdouli等获取了4周龄不同干旱胁迫程度下拟南芥的Fo, Fv/Fm, NPQ/4等叶绿素荧光图像, 分别从图像中选取了5个感兴趣区域(areas of interest, AOI): 叶片中心、 靠近叶基的两侧、 靠近叶端的两侧, 比较了不同干旱胁迫程度(轻度、 中度、 重度)对PSII的影响[8]。 结果表明, 在干旱胁迫早期(轻度胁迫), 从叶绿素荧光图像中就能够观察到叶片的发病区域。 2015年Bresson等建立了Fv/Fm等图像的荧光强度分布的双峰之间距离的模型S值(S=(μ -μ i)/(2σ i)), 用以量化植株的光合异质性, 实现了干旱条件下植株的表型检测[20, 21]。
通过图像融合方法可以获得更全面的表型信息。 以Matous等在2006年提出的线性融合方法为例[26]: 首先选用序列浮动前向(sequential forward floating search algorithm , SFFS)算法选择特征图像; 然后利用线性判别分类器(linear discriminant classifier, LDC)对实验组植株和对照组植株进行分类, 最后利用线性判别分析(linear discriminant analysis, LDA) 对荧光图像线性融合。 最终得到了实验组植株(病害、 冻害、 干旱胁迫)与对照组植株差异性最大的融合图像, 较于传统的叶绿素荧光参数图像, 融合的图像可以更早地实现病害、 冻害、 干旱胁迫的诊断[26, 27, 28]。 对于结构复杂的植株, 叶绿素荧光成像系统仅能实现局部视角的测量从而损失大量有效信息。 Eguchi等尝试利用叶绿素荧光成像技术结合便携式扫描激光雷达技术获得整个植株的三维叶绿素荧光强度分布, 得到光合信息在整个植株上的空间变化[29]。 该方法为解决因局部视角测量造成的叶绿素荧光信息的损失提供了思路。
非生物胁迫会导致植物的形态、 生理和生化发生变化, 影响植物正常的生长发育。 其中, 干旱胁迫、 盐胁迫及低温/高温胁迫等非生物胁迫能够影响植物的光合作用, 因此叶绿素荧光技术可应用于植物的非生物胁迫检测, 如表2。
| 表2 叶绿素荧光技术在非生物胁迫分析中的相关应用 Table 2 Survey of works on plant response to abiotic stress using chlorophyll fluorescence technique |
分析表2可以看出, 最大光量子效率(Fv/Fm)、 光量子效率(Φ PSII)、 光适应光化学猝灭(qP)、 非光化荧光猝灭(NPQ)等荧光参数对植物非生物胁迫响应具有较好的指示性。 大部分非生物胁迫对植物的影响十分复杂, 集不同组织水平上的跨空间、 跨时间的反应于一体。 Bresson等于2014年指出不同基因型的番茄叶片的叶绿素荧光参数NPQ, Φ PSII, Fv/Fm分别在干旱胁迫的第7, 12, 14天可以检测到野生型与转基因叶片存在的显著性差异; 此外, 参数Fv/Fm也与植株干旱条件下的存活率相关[31]。 表明叶绿素荧光技术可以从时间和空间尺度上实现对植株干旱胁迫的无损检测。 2017年Pompeiano等利用叶绿素荧光技术研究芦竹对盐胁迫的响应, 该研究发现在盐胁迫42天后芦竹的光合效率不受影响, 但参数Φ PSII, Fv/Fm在盐胁迫至49天后出现了下降[32]。 低温或高温胁迫皆会造成植物减产, Mishra等在2014年利用融合图像方法对不同基因型拟南芥在低温胁迫下的表型进行了研究, 通过线性融合经序列浮动前向选择算法选取的三张荧光猝灭过程中不同时间点的荧光图像, 能够加强对照组与实验组的区分度, 可实现耐寒性基因型植株的筛选[33]。
叶绿素荧光技术在生物胁迫研究中应用广泛, 可检测由病毒、 细菌和真菌感染引起的生理状态变化, 如表3。 因此, 对生物胁迫的早期检测可以尽早控制病情发展, 提高农业生产效率并为农作物的品质安全提供保障。
在生物胁迫检测中, 叶绿素荧光参数包括最大光量子效率(Fv/Fm)、 非光化荧光猝灭(NPQ)、 光量子效率(Φ PSII)等对生物胁迫具有较好的灵敏度, 能实现对染病植株与健康植株的早期识别, 也能定量分析植株的染病程度。 2009年Mandal等研究发现轻度感染霜霉病与重度染病的车前草叶片的Fv/Fm值相较于健康叶片分别低了24.39%和44.90%[55]。 2011年Pineda等利用叶绿素荧光成像技术分析了两种毒性不同的烟草花叶病毒对烟草的影响, 通过比较常用叶绿素荧光参数图像与融合的图像对染病叶片的诊断效果, 结果发现, 融合的图像比传统叶绿素荧光参数图像能更早实现对染病烟草的检测[56]。 2011年, 陈兵等利用叶绿素荧光技术检测了棉花叶片黄萎病, 研究表明叶绿素荧光参数与染病程度相关性较好[57]。 同年, Elke等利用叶绿素荧光和高光谱成像技术分析黄色镰刀菌侵染小麦麦穗后对小麦光合作用的影响, 基于参数Fv/Fm建立的线性模型, 可以实现轻度(0~10%)、 中度(40%~50%)和重度(70%~90%)不同染病程度的小麦麦穗的分类, 分类精度最高可达80%, 但该方法不适用于小麦生长81阶段(BBCH代码)后[58]。 2013年Tung等利用叶绿素荧光成像技术检测烟草炭疽病, 以Fv/Fm图像量化分析烟草染病程度(染病、 未显症染病、 健康), 表明叶绿素荧光成像技术可实现染病程度检测[24]。 2017年Cen等探讨叶绿素荧光成像技术诊断柑橘黄龙病的潜力, 文章通过比较不同特征选择方法(随机蛙跳算法、 顺序前进法、 蒙特卡罗无信息变量消除法)获得荧光特征对柑橘黄龙病的灵敏度, 将所选荧光参数作为支持向量机分类器的输入变量, 建立了柑橘叶片黄龙病诊断模型(健康、 染病、 缺素), 模型诊断精度最高可达97%[59]。
| 表3 叶绿素荧光技术在生物胁迫分析中的相关研究 Table 3 Survey of works on plant response to biotic stress using chlorophyll fluorescence technique |
分子标记辅助选择法在植物育种中的应用越来越普遍, 它可以从分子水平上准确地分析植株的遗传组成从而实现分子育种, 筛选对非生物胁迫和生物胁迫耐受性好、 产量高的基因型。 该方法不仅需要应用基因功能知识和重组DNA技术, 而且也需要高通量植物表型技术来解析不同功能基因的解剖、 生理、 生化表型性状[64]。
叶绿素荧光技术提供了与光合系统相关的信息, 为作物优良性状的筛选提供了理想的平台。 如2015年Estrada研究温度和水分两个环境因子对六种基因型蓝莓的影响[65]; 2017年Zhou等利用叶绿素荧光成像技术检测在干旱和热复合胁迫下三个品种番茄的生理变化, 主要选用Φ PSII, NPQ, ETR和qL等参数, 表明番茄生理响应与干旱、 高温和复合胁迫的差异和联系, 对干旱、 高温和复合胁迫下耐盐番茄品种的选育具有重要意义[66]; 2014年Chen等利用叶绿素荧光成像技术并结合其他成像技术建立了一个全面的高通量植物表型数据分析架构, 实现了在同一时段内从多源图像信息中提取大量表型性状特征, 为揭示复杂农艺性状的遗传机制打下基础[36]。 此外, 在植物的光合作用和产量的提高方面也有相关应用, 如光量子效率(Φ PSII)可以用来评估CO2固定的光能利用效率和干物质积累[67]。
叶绿素荧光技术也有一定的局限性, 存在暗适应、 大田尺度测量难、 数据分析方法单一等问题。 叶绿素荧光技术测量植物叶绿素荧光参数需要提前暗适应, 该过程需要耗费大量时间, 影响叶绿素荧光技术在高通量表型平台上的发展。 Mishra等在2016年提出一种无需暗适应的测量方法, 设置环境光的光照强度为植物生长环境中光照强度的1/2, 结果表明该方法获得的荧光参数用于干旱胁迫检测可与暗适应获得的参数相媲美, 为解决暗适应问题提供了一种新思路, 但该方法的普适性仍需进一步的研究[34]。 针对大田尺度测难的局限性, 有学者开发了阴影成像站, 为叶绿素荧光技术在大田尺度的应用提供方案[68]。 叶绿素荧光系统可以采集大量荧光信息, 包括参数、 猝灭曲线以及图像等。 纵观目前的研究, 大多局限于传统叶绿素荧光参数的分析, 叶绿素荧光参数的利用率比较低, 需要进一步挖掘具有潜在价值的信息。 目前, RGB、 高光谱成像技术等建立了较为成熟的数字图像处理和数据分析方法, 能实现植株病害侵染、 生理变化的智能化监测。 因此, 进一步结合植物表型性状信息, 探索数理统计、 数据挖掘和模式识别等方法, 发挥叶绿素荧光技术表征植物光合作用的优势, 进而为高通量植物表型分析提供一种高效、 准确、 快速的方法。
叶绿素荧光技术不仅提供与光合生理相关的荧光参数, 而且提供各荧光信号在二维空间的分布信息, 已经成为研究植物光合作用变化的强大工具。 分析方法主要包括了传统叶绿素荧光参数分析与图像处理, 深入探究多源信息融合、 数据挖掘等方法有利于促进该技术的发展。 从分析内容来看, 该技术适用于植物的非生物胁迫、 生物胁迫诊断、 作物优良性状筛选等, 可实现在基因和环境因素共同作用下的植物生理状态变化检测以及不同基因型的抗逆性评估, 为筛选优良的作物品种和发展先进的栽培技术打下基础。 但是, 叶绿素荧光技术也存在一定的局限性, 不可避免的暗适应过程大大阻挠了其检测效率, 因此暗适应之于表型分析的必要性仍然值得考究; 大田尺度冠测量难限制了该技术在低空遥感领域的应用; 叶绿素荧光信息的分析方法较少, 如何高效利用叶绿素荧光信息提高植物表型分析的精度和效率值得思考。 这些问题的突破将有利于叶绿素荧光技术在植物表型分析中的应用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|