作者简介: 王 岩, 1992年生, 长春理工大学电子信息工程学院硕士研究生 e-mail: wangyan1@cigit.ac.cn;汤明杰, 女, 1985年生, 中国科学院重庆绿色智能技术研究院工程师 e-mail: mjtang@cigit.ac.cn;王 岩, 汤明杰: 并列第一作者
PM2.5作为一种重要的空气污染物, 研究不同地区PM2.5对人体细胞的损伤异同具有重要意义。 本实验以人肺癌细胞为研究对象, 分别经过3个不同地区PM2.5日均量暴露2 h, 采用拉曼光谱仪和原子力显微镜对活性单细胞的光谱、 形貌和生物力学指标进行检测, 通过酶联免疫反应检测细胞产生的发炎因子浓度。 统计分析表明: PM2.5暴露后细胞拉曼峰1 002.97, 1 127.29, 1 172.83和1 338.1 cm-1强度变大; 细胞伪足收缩或残缺, 细胞核区变高; 苏州地区PM2.5暴露后细胞黏滞功变小, 弹性能变大; 细胞产生发炎响应。 发现经不同地区PM2.5暴露后, 单细胞光学和力学信息发生了各异的改变, 因此单细胞水平上研究不同地区PM2.5的毒理效应, 为空气污染治理、 肺部疾病防控提供数据支撑。
PM2.5 is one of the important pollutants, so it is of great significance to the study of cytotoxical effects of PM2.5 from different regions. In this study, Human lung carcinoma epithelial cells (A549) were exposed to the average daily volume of PM2.5 from three different regions in vitro for 2 h. Afterwards, the cells were examined on the single cell level by the confocal Raman microspectroscopy and atomic force microscopy, respectively, to obtain the Raman spectroscopy, and the morphological and biomechanical properties of the cells. In addition, the cytokine concentration was measured by the multiplex enzyme linked immunosorbent assay. Compared to the untreated cells, statistical results revealed several interesting phenomena, including (1) the intensity of the Raman peaks of the treated cells increased at 1 002.97, 1 127.29, 1 172.83 and 1338.1 cm-1; (2) the lamellipodia of treated cells shrunk or partially disappeared; (3) the treated cells became higher; (4) the adhesion work decreased while the elastic energy increased for the cells treated by the PM2.5 from Suzhou region and (5) the treated cells had an inflammatory response. Our work demonstrated that the toxical effects of PM2.5 from different regions on A549 were different, which provides useful information for the air pollution control and prevention and control of lung diseases.
越来越多的流行病学和毒理学研究资料表明, 大气颗粒物对人类健康有明显的不良影响, 大气污染已成为影响人类健康的主要危险因素之一。 2013年, 国务院发布《大气污染防治行动计划》明确指出“ 我国大气污染形势严峻, 以可吸入颗粒物(PM10)、 细颗粒物(PM2.5)为特征污染物的区域性大气环境问题日益突出, 损害人民群众身体健康, 影响社会和谐稳定。 ” 近年来, 颗粒物导致慢性支气管炎、 肺炎及哮喘等呼吸系统损伤性疾病的发病率呈逐年上升趋势[1]。 粒径小于2.5 μ m的大气颗粒物常以PM2.5表示, 其危害作用日益受到关注。 科学家用PM2.5表示每立方米空气中这种颗粒的含量, PM2.5值越高, 就代表空气污染越严重。 PM2.5作为一种重要的空气污染物, 对心肺疾病发生率、 死亡率有明显影响[2]。 PM2.5粒径小、 表面积大, 能在空气中长时间滞留, 富集有毒重金属、 酸性物质、 有机污染物、 细菌和病毒等, 并易避开气管纤毛等过滤机制进入下呼吸道, 沉积在肺泡, 引起各种呼吸系统疾病及心血管、 神经、 免疫系统的变化[3]。 PM2.5促使人体肺细胞发炎, 使得参与发炎反应的基因和蛋白质严重失调[4], 和对蛋白折叠产生影响[5]。 细(直径< 2.5μ m)或超微(< 1.0 μ m)的颗粒物能够刺激肺上皮细胞释放促炎性细胞因子[6], 包括IL6, IL8, GRO-α 等[7], 引起肺部炎症可导致或加重慢性呼吸系统疾病。 虽然相关的研究清楚表明PM2.5可诱导肺病理学, 但是缺乏PM2.5在单细胞水平上对细胞生物力学和生物化学影响的研究。
原子力显微镜(atomic force microscopy, AFM)可以提供许多纳米级分辨率的参数, 如细胞表面形貌以及力学特性[8, 9], 从而推知PM2.5暴露下细胞骨架的形态和力学变化过程。 拉曼光谱(Raman microspectroscopy, RM)是分子对光子的一种非弹性散射光谱, 能够反映水溶液中活细胞中生物化学组分的变化信息, 不需要任何标记和固定[10], 已被用于临床诊断学, 组织工程和毒理实验[11], 故采用此技术可以获取PM2.5暴露下细胞核内遗传物质的变化, 细胞质内和细胞膜上蛋白等物质的改变。
PM2.5的产生来自不同的污染源, 室外大环境的PM2.5主要来源于燃料燃烧的烟雾、 机动车尾气、 挥发性有机物等; 室内小环境主要来自于吸烟的烟雾。 由于各地区的污染源各异, 污染程度不同, 故PM2.5的组成成分和比例有所区别[12]。 目前国内外尚没有从生物力学和生物化学两个角度对不同区域来源PM2.5的毒理效应进行研究, 本工作基于单细胞力学和光学指纹特性研究不同区域PM2.5的毒理效应, 配合酶联免疫反应(ELISA)测定其发炎因子, 不仅可为环境标准的制定提出参考, 而且还为生物医学的研究奠定基础。
对冬季12月份重庆, 成都, 苏州3个地区的PM2.5采集24 h, 将其收集到47 mm滤膜上, 加入100 mL超纯水超声, 将其超声到超纯水中, 再通过高压灭菌处理, 低温冻干后, 与等体积的细胞培养液混合, 用其培养液对细胞进行平行培养2 h。 然后使用同一批处理的样本分别进行共聚焦拉曼光谱检测, AFM检测, 和酶联免疫反应实验。
实验采用人肺癌细胞A549, 由齐氏生物科技有限公司提供。 将A549细胞培养在DMEM培养基中(含10%胎牛血清FBS和1%青霉素-链霉素混合溶液), 置于温度为37 ℃, 浓度为5%CO2的细胞培养箱中培养。
为了减小拉曼光谱背景, 将生长到80%~90%的A549细胞传代在MgF2晶体片上使其贴壁生长。 设置一个对照组, 即不添加任何地区PM2.5的A549细胞。 3个实验组, 分别为3个不同地区PM2.5处理过的A549细胞。 在AFM检测细胞前, 同样将细胞传代在培养皿中, 设置一个对照组和三个实验组。
采用英国雷尼绍公司的inVia-Reflex型拉曼光谱仪, 选用532 nm激光器。 首先用洁净的硅片进行校准, 校准硅片的拉曼峰值位置在520 cm-1。 将生长有细胞的MgF2取出, 用PBS慢慢清洗3次, 滴上30 μ L的PBS, 盖上石英片进行测量。 测量的位置为细胞核, 一个对照组和三个实验组分别设有3个平行的实验样本。 对照组与重庆、 成都和苏州三个实验组分别为128, 113, 133和114个细胞样本。 其中PBS可以维持细胞正常的渗透压, 以保证测量得到的是细胞正常生理状态下的拉曼光谱。 实验室温度为25 ℃, 湿度为50%。
实验时首先测量四组实验各自的背景光谱, 然后再对细胞的光谱进行测量。 在分析细胞的拉曼光谱时, 将得到的四组拉曼光谱分别扣除各自的背景光谱后取平均值, 然后进行基线校准, 平滑和归一化处理。 最后采用主成分分析法对四组拉曼光谱进行分析。 可以直观地看到3个主成分时, 对照组和3个不同地区PM2.5处理细胞后的分布情况。 然后将四组实验数据分为校正集和预测集, 最后通过判别分析对对照组和实验组的光谱进行分类。
采用美国Dimension EDGE原子力显微镜, 选用BRUKER公司的MLCT探针, 采用接触模式对细胞的力学性质和形貌进行测量。 一个对照组和三个实验组分别设有3个平行的培养皿样本。 在AFM测量前, 移除培养液, 用PBS慢慢清洗细胞3次, 最后加入PBS进行测量。 测量细胞形貌时, 扫描频率为0.3Hz, 测量细胞力曲线时, 探针的弹性常数为0.03 N· m-1; 针尖趋近和趋离速率为1 μ m· s-1。 对照组与重庆、 成都和苏州三个实验组分别为209, 180, 149和118条力曲线。 实验室温度为25 ℃, 湿度为50%。
细胞发炎会产生各种细胞因子。 通过对细胞因子的检测, 可以得出3个不同地区的PM2.5对细胞的损伤程度。 将对照组和3个地区PM2.5处理2 h后的细胞上清液收集, 采用酶联免疫法对细胞发炎响应产生的细胞因子进行检测。 一个对照组和三个实验组分别设有3个平行的实验样本。
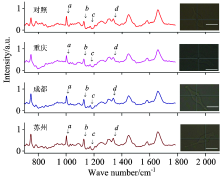
首先将对照组和实验组测量得到的拉曼光谱分别去除各自背景, 进行基线校准、 平滑和归一化处理, 然后求其平均值, 得到对照组和实验组细胞的拉曼光谱, 如图1所示。 与对照组相比, 虽然没有新的拉曼峰增加和缺失, 但实验组的拉曼光谱中部分波峰强度大小发生了改变。 例如: 1 002.97 cm-1 (a), 1 127.29 cm-1 (b), 1 172.83 cm-1 (c) 和1 338.1 cm-1 (d) 峰, 它们分别代表蛋白质(苯丙氨酸)、 蛋白质(C— C骨架拉伸变形)、 DNA(胞嘧啶、 鸟嘌呤)、 蛋白质和核酸(δ CH2CH3扭转振动)[13]。 四处拉曼峰强度都增加了, 说明经不同地区PM2.5暴露后, 细胞内蛋白质和核酸含量变多了, 蛋白质增加可能与细胞内微管、 中间丝和肌动蛋白微丝的聚拢有关, 它们是组成细胞骨架的主要结构[14]。 由此推测PM2.5可能破坏了细胞骨架网络的正常架构。 核酸含量的增加可能是PM2.5暴露后, 抑制了微管解聚, 进而导致细胞G2期和M期被阻断, 因此细胞在进行有丝分裂时, 不能形成正常的纺锤体, 细胞核不能进行正常分裂[15]。 图1中拉曼光谱曲线右边分别为细胞进行拉曼光谱采集时的光学图像, 图上十字交叉的部分即为拉曼光谱的采集位置。
将所有细胞样本的拉曼光谱按2∶ 1分成校正集和预测集。 然后对校正集和预测集的光谱进行主成分分析, 我们可以直观地看到对照组和实验组光谱的一个三维分布情况, 如图3所示。 对照组基本分布在左上方, 重庆地区PM2.5处理细胞基本分布在左下方, 成都PM2.5处理细胞基本分布比较分散, 苏州地区的PM2.5处理细胞基本分布在对照组的右侧, 分布较为分散且距对照组较远; 从总体上看, 与对照组的分界也较为明显。
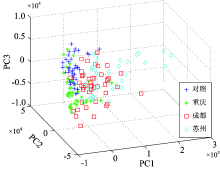 | 图3 主成分分析预测集前三个主成分三维视图Fig.3 Principal component analysis (PCA) of Raman spectra for the prediction sets |
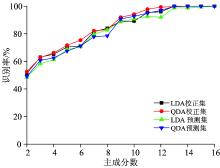
最后采用了线性判别和二次判别方法分别对细胞进行分类识别, 基于两种判别方法, 其识别率随主成分数的增加而逐渐趋于100%, 如图4所示。 采用线性判别分析时, 当主成分数为16时, 校正集和预测集识别率均达到100%; 采用二次判别分析时, 当主成分数为14时, 校正集和预测集识别率均达到100%。 由此可以看出, 采用二次判别方法, 能够更有效地对细胞进行分类识别。 线性判别决策面是一条直线、 一个平面或一个线性超平面; 二次判别决策面是一个二次曲面。 在预测协方差矩阵参数时, 二次判别需要的参数更多, 二次判别的适用范围更广, 因此在样本数量较多时, 二次判别比线性判别的效果更好。 两个识别模型均能够将对照组和3个实验组细胞100%的成功区分开, 说明细胞经过3个地区的PM2.5处理后, 分别发生了各异的生物化学成分的改变。
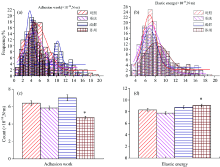
采用AFM接触模式对细胞进行形貌测量, 得到对照组和3个实验组的单细胞形貌图。 如图5所示, 从上至下的每行分别为对照组和经重庆、 成都、 苏州地区PM2.5处理的细胞的AFM微悬臂偏折信号图像、 高度图像和高度分析图。 最右栏图中的细胞高度曲线分别对应中间栏图中经过细胞最高点的水平方向的白线。 从图5可以看出, 细胞经PM2.5处理后, 细胞的高度不但增加了, 而且细胞的伪足也出现了收缩或缺损, 细胞的趴壁状态有所下降。 因为细胞伪足主要成分是由肌动蛋白微丝组成[16], 所以推测经PM2.5处理后, 细胞伪足部分肌动蛋白微丝产生了回缩或减少。 PM2.5处理导致细胞变高的原因目前还不清楚。 将4组实验生物力学参数的数据进行统计分析, 如图6所示, 前2幅图分别为采用高斯拟合对对照组和实验组的黏滞功和弹性能数据进行统计分析[17], 最后2幅图为与对照组比较, 对各个实验组黏滞功和弹性能的差异显著性进行统计分析。 与对照组相比, 经苏州地区PM2.5处理后, 细胞的黏滞功和弹性能产生了显著性变化(p< 0.05), 黏滞功变小, 弹性能变大。 细胞骨架主要是由微管、 中间丝和肌动蛋白微丝形成的一个网络结构[18, 19], 对维护细胞形态具有重要作用。 黏附分子与细胞黏性密不可分[20]。 经苏州地区PM2.5处理后, 其黏滞功减小可能是PM2.5处理细胞后黏附分子表达减少引起的[21, 22], 也可能是PM2.5处理细胞后, 细胞表面微绒毛减少, 导致探针离开细胞时, 探针针尖与微绒毛的相互作用力减少, 进而表现细胞黏滞功变小[23]。 而其弹性能变大可能是由于PM2.5抑制了细胞内微管的解聚[24], 使细胞的骨架网络结构更加坚实, 具有更好的弹性, 从而导致细胞弹性能增大。 经重庆和成都地区PM2.5处理后的细胞, 其黏滞功和弹性能在数值上与对照组比较有所不同, 但是没有产生显著性变化(p> 0.05), 推测可能是重庆和成都地区的PM2.5在两小时内对细胞骨架结构的影响不明显。
 | 图5 对照组和不同地区PM2.5处理后细胞的形貌图和高度曲线, 比例尺为10 μ mFig.5 The deflection images and height curves of the control group and treated groups measured by AFM. Scale bar: 10 μ m |
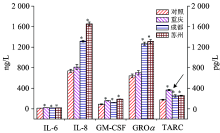
通过酶联免疫反应实验结果分析, 细胞在经过PM2.5暴露后会发炎, 从而产生多种细胞因子, 包括IL-6, IL-8, GM-CSF, GROα 和TARC等, 如图7所示。 经重庆、 成都和苏州地区PM2.5处理后的细胞, IL-6, IL-8, GM-CSF, GROα 和TARC的浓度都增加了; 苏州地区PM2.5促使细胞产生IL-6, IL-8, GM-CSF和GROα 的浓度是最高的, 重庆地区的PM2.5促使细胞产生TARC的浓度是最高的。 推测细胞被PM2.5处理后, 产生发炎损伤, 从而引起核转录因子NF-κ B活化, 导致细胞因子浓度增加[25]。 从整体来看, 经苏州地区PM2.5处理后的细胞, 产生细胞因子的浓度值之和是最高的, 因此可以推断, 苏州地区PM2.5的毒性可能比其他地区略强一些, 和拉曼光谱仪、 AFM测定的生物光学信息、 力学参数的改变程度相一致。
从细胞拉曼光谱分析可得, 通过对比1 002.97, 1 127.29, 1 172.83和1 338.1 cm-1位置的峰值强度, 采用不同地区PM2.5处理细胞后, 细胞内蛋白质和核酸的含量具有显著性差异(p< 0.05), 且显著增加。 推测蛋白质增加可能是PM2.5处理细胞后, 引起了微管、 中间丝和肌动蛋白微丝的聚拢; 而核酸含量增加可能是PM2.5抑制了微管解
聚, 导致细胞G2期和M期被阻断, 细胞在进行有丝分裂时, 不能形成正常的纺锤体, 细胞核不能进行正常分裂, 从而导致细胞核酸含量增加。 从细胞生物力学参数分析得出, 经苏州地区PM2.5处理后, 其黏滞功和弹性能具有显著性差异(p< 0.05), 黏滞功变小, 弹性能变大。 黏滞功变小可能是PM2.5处理细胞后, 黏附分子减少导致的, 也可能是PM2.5处理细胞后, 导致细胞表面微绒毛较少, 进而减弱了探针针尖与细胞表面微绒毛的相互作用力导致黏滞功减小引起的。 弹性能的变化有可能是PM2.5导致构成细胞骨架的蛋白网络结构更坚实, 从而导致细胞弹性能变大; 从细胞的形貌和高度上看, 经不同地区PM2.5处理后的细胞, 其伪足出现收缩或缺损, 高度整体增加。 从细胞的拉曼光谱和细胞的生物力学上, 可看出PM2.5处理细胞后, 其生物化学和物理性质均发生了一定的改变; 通过ELISA检测结果分析可知, 苏州地区PM2.5诱导细胞产生的发炎因子浓度最高。 总之, 不同地区的PM2.5对细胞均产生了一定的毒理效应, 以苏州地区最为显著。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|