作者简介: 陆 彩, 1993年生, 南京中医药大学药学院硕士研究生 e-mail: 1247524248@qq.com
研究泽泻醇类化合物23-乙酰泽泻醇B(alisol B 23-acetate, 23B)、 24-乙酰泽泻醇A(alisol A 24-acetate, 24A)混合物(24A∶23B含量比=1∶1)与抑癌基因p53DNA的作用机理, 探讨泽泻醇类化合物抗肿瘤作用的分子机制。 紫外-可见吸收光谱法、 荧光光谱法与分子模拟联用探讨23B, 24A及24A-23B混合物与p53DNA的作用方式。 紫外光谱显示泽泻醇单体与其混合物部分嵌插入p53DNA, 他们使p53DNA紫外吸收降低的程度为: 24A∶23B(1∶1)>23B>24A。 荧光光谱显示泽泻醇单体及其混合物与p53DNA的相互作用模式均为嵌插结合, 结合强度为: 24A∶23B(1∶1)>23B>24A。 分子模拟显示, 泽泻醇单体及其混合物与p53DNA结合能的大小顺序为: 24A∶23B (1∶1)>23B>24A, 23B与p53DNA f 链的腺嘌呤脱氧核苷酸(DA4)形成1个氢键, 24A-23B复合物与p53DNA的DA4、 胸腺嘧啶脱氧核苷酸(DT19)形成4个氢键。 24A, 23B及其混合物与p53DNA结合的强度顺序: 24A∶23B (1∶1)>23B>24A, 表明24A和23B对抗癌靶点p53DNA具有协同作用, 三者与p53DNA的作用方式均为部分嵌插结合。 同时, 泽泻醇化合物母环C14-和结构中的空间位阻, p53DNA f 链的DA4中磷酸上的氧原子为泽泻醇类化合物与p53DNA相互作用的关键结合位点, 是该类泽泻醇发挥抗肿瘤作用的活性中心。 24A侧链C19-上的羟基, p53DNA f 链的DA4中腺嘌呤上的氮原子和氧原子, e链的DT19中胸腺嘧啶上的氧原子为泽泻醇类化合物协同增效作用的关键。
The paper aims to study the interactive mechanism of alisol B 23-acetate (23B), alisol A 24-acetate(24A) and content of 23B∶24A=1∶1 mixture with p53DNA which is tumor-suppressor gene, and explore the molecular mechanism of the antitumor effects of alisol acetates. The interaction of 23B, 24A and 24A-23B mixture with p53DNA was investigated by Ultraviolet and Visible Spectroscopy (UV-Vis), Fluorescence spectroscopy and Molecular simulation. UV-Vis showed that p53DNA was partially inserted by alisol mononers and its mixture, in which the decrease degree between p53DNA’s UV-Vis absorbance was 24A∶23B (1∶1)>23B>24A. Fluorescence spectroscopy demonstrated that the mode of interaction of p53DNA and alisol mononers and its mixture was inserted, in which the bonding strength was 24A∶23B (1∶1)>23B>24A. Molecular simulation illustrated that the sequence of binding of alisol mononers and its mixture with p53DNA was 24A∶23B (1∶1)>23B>24A, in which 23B formed a hydrogen bond with Adenine nucleotides (DA4) of p53DNA while 24A-23B mixture formed four hydrogen bonds with the DA4 and Thymine Nucleotides (DT19). The sequence of binding of alisol mononers and its mixture with p53DNA was 24A∶23B(1∶1)>23B>24A, in which the mode of interaction between them and p53DNA were all partial insertion, indicating that 24A and 23B had synergistic effects on anticancer target p53DNA. In addition, the parental rings C14- of alisol acetates and their steric hindrance and the oxygen in phosphoric acid of DA4 in the f chain in p53DNA were the binding site of the interaction between alisol acetates and p53DNA, which was the active center of the antitumor effects of alisol acetates. The key to the synergy of alisol acetates is that the the hydroxyl group on the side chainn C19- of 24A and the nitrogen and oxygen on adenine of DA4 in the f chain in p53DNA and the oxygen atom in thymine of DT19 in the e chain in p53DNA.
中药泽泻为泽泻科植物泽泻Alisma orientale (Sam.) Juzep.的干燥块茎, 具有阻滞肿瘤细胞增殖周期、 诱导细胞凋亡、 逆转多药耐药、 诱导自噬等抗肿瘤的作用[1, 2]。 泽泻化学成分以萜类为主, 含有多种四环三萜、 倍半萜、 二萜类化合物等[3]。 泽泻的主要活性成分为24-乙酰泽泻醇A(alisol A 24-acetate, 24A)、 23-乙酰泽泻醇B(alisol B 23-acetate, 23B)。 近年来, 随着现代科学技术的不断发展, 已有研究表明, 泽泻中的泽泻醇类化合物具有抗肿瘤作用[2], 然而, 至今尚未见有关泽泻醇抗癌的分子机制的报道。 p53DNA是人类最主要的肿瘤抑制基因, 人体中功能正常的p53DNA能阻止多种肿瘤发生, 而p53DNA自身结构的改变是导致其抑癌功能丧失的主要原因, 人类癌症中约有一半是由于p53DNA发生突变失活, 是迄今发现与人类肿瘤相关性最高的基因[4]。 文献[5]表明, p53DNA是抗癌药物的常见作用靶点, 通过破坏DNA的结构和功能, 发挥抗癌作用。 因此, 采用紫外-可见吸收光谱、 荧光光谱联合分子模拟, 从分子层次深入探讨泽泻醇类化合物23B, 24A及其混合物与抑癌基因p53DNA的相互作用机制以及结合方式, 并求出其结合常数, 从而为泽泻醇类化合物的抗肿瘤分子机制的研究, 及其临床应用以及新型天然抗癌药物和抗癌药物候选分子的设计提供理论参考和依据。
试剂: 单链DNA(上海生工生物工程股份有限公司): p53基因P1启动子区(ss1: 5’ -CCTCCTCCCCAACTCC-3’ , ss2: 3’ -GGAGGAGGGGTTGAGG-5’ ); 23-乙酰泽泻醇B标准品, 24-乙酰泽泻醇A标准品(成都曼思特生物科技有限公司), 结构如图1; 溴化乙锭(EB, 上海麦克林生化科技有限公司); 乙腈为色谱纯(美国Merck公司); 三羟甲基氨基甲烷(Tris, 美国BIO LINK公司), 与盐酸(HCl)配制成pH为7.4的Tris-HCl缓冲溶液(0.50 mol· L-1); 其他试剂均为分析纯; 实验用水为超纯水。
仪器: Cary-5000紫外分光光度计(美国Varian公司); LS55型荧光光度计(美国Perkin Elmer公司); HH-2数显恒温水浴锅(常州国华仪器有限公司); TG16-WS台式高速离心机(上海卢湘仪离心机仪器有限公司); MX-S可调式混匀仪(美国SCILOGEX公司); FA2004电子天平(上海上平仪器有限公司); PHS-3C台式数显精密pH仪(上海仪电科学仪器股份有限公司)。
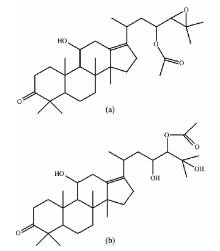 | 图1 泽泻醇类化合物的化学结构式 (a): 23-乙酰泽泻醇B; (b): 24-乙酰泽泻醇AFig.1 Molecular structures of alisol acetates (a): Alisol B 23-acetate; (b): Alisol A 24-acetate |
溶液配制: 双链DNA的制备: 用Tris-HCl缓冲液(0.50 mol· L-1, pH 7.4)配制含有2条互补单链DNA(5 μ mol· L-1)溶液, 在85 ℃水浴锅中放置10 min后退火, 缓慢自然冷却至室温(超过4 h), 即配制成5 μ mol· L-1双链DNA溶液[6], 于-20 ℃储存, 备用。 泽泻醇溶液的配制: 分别将23B和24A标准品用乙腈配制成浓度为5.05× 10-4 mol· L-1的泽泻醇溶液, 用Tris-HCl缓冲液(0.50 mol· L-1, pH 7.4)稀释得浓度为1.52× 10-4 mol· L-1的23B和24A溶液, 再将23B和24A溶液按照含量比为1∶ 1混合后得23∶ 24A(1∶ 1)混合溶液, 于4℃储存, 备用。
1.2.1 紫外-可见吸收光谱测定[7]
移取2 mL 5.00 μ mol· L-1 DNA溶液于1cm石英比色皿中, 分别依次加入5份5 μ L的23B溶液、 24A溶液和24A∶ 23B=1∶ 1的混合溶液, 加入后混合均匀使泽泻醇与DNA的摩尔比为0, 0.76, 1.52, 2.28, 3.04, 3.80, 静置至反应完全。 测定条件: 扫描范围为200~300 nm, 扫描间隔1.0 nm, 参比溶液均为0.50 mol· L-1 Tris-HCl缓冲液(pH=7.4), 测定DNA溶液的紫外-可见吸收光谱变化。
1.2.2 荧光光谱测定[8]
将DNA与EB溶液混合, 得到DNA浓度为5.00 μ mol· L-1和EB浓度为5.0× 10-5 mol· L-1的EB-DNA混合体系, 分别依次加入5份5 μ L的23B溶液、 24A溶液和24A∶ 23B=1∶ 1的混合溶液, 加入后混合均匀使泽泻醇与DNA的摩尔比为0, 0.76, 1.52, 2.28, 3.04, 3.80, 静置至反应完全。 测定条件: DNA的激发波长为480 nm, 狭缝宽度15 nm× 15 nm, 发射光谱扫描范围为500~800 nm, 测定EB-DNA体系的荧光光谱的变化。
1.2.3 分子模拟[9]
所有计算工作均使用美国Accelrys公司Discovery Studio 2.5(DS2.5)软件包完成。 配体小分子均采用DS2.5中的Sketching功能构建并优化。 对接研究采用的晶体结构来源于PDB数据库(PDB ID: 1TSR)。 该晶体结构为双链p53DNA与p53蛋白核心域的复合物。 选取该复合物晶体结构作为模板, 剔除原有配体后, 进行配体小分子与双链p53DNA的对接运算。
采用DS2.5软件包的CDOCKER模块在CHARMm力场下分别将23B, 24A以及24A与23B的1∶ 1组合与p53DNA的半柔性对接: 基于格点的精确分子对接方法, 利用高温动力学产生10个不同构象的配体, 采用模拟退火的方法将各个构象在受体活性位点进行优化, 计算受体-配体的相互作用能, 最终得到最稳定的复合物构象。
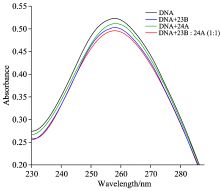
双链DNA分子中存在共轭双键体系, 在波长260 nm左右处有独特的紫外吸收峰。 将不同体积的泽泻醇逐渐加入p53DNA溶液中, 随着泽泻醇类化合物的不断加入, p53DNA溶液的紫外吸收光谱在260 nm左右的特征吸收峰强下降(图2), 峰位基本没有变化。 23B下降程度高于24A。 根据文献[10], 可推测泽泻醇类化合物与p53DNA为非完全嵌插作用, 即部分嵌插入p53DNA碱基对中, 破坏了p53DNA原有的共轭体系, 使得p53DNA的紫外吸收减弱, 并且23B与p53DNA的亲和力强于24A。
 | 图2 泽泻醇单体加入p53DNA溶液的紫外吸收光谱Fig.2 Absorption spectra of alisol mononer added to p53DNA solution a: 0 μ L; b: 5 μ L; c: 10 μ L; d: 15 μ L; e: 20 μ L; f: 25 μ L |
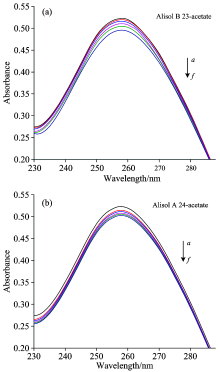
同时, 综合分析图3和表1可知, 泽泻醇单体与其混合物对p53DNA紫外吸收的降低程度为: 24A∶ 23B(1∶ 1)> 23B> 24A, 说明, 24A∶ 23B=1∶ 1的混合物对p53DNA紫外吸收的降低程度强于泽泻醇单体对p53DNA的作用。
 | 图3 泽泻醇化合物加入p53DNA溶液的紫外吸收光谱 24A: 24-乙酰泽泻醇A; 23B: 23-乙酰泽泻醇BFig.3 Absorption spectra of alisol acetates added to p53DNA solution 23B: alisol B 23-acetate; 24A: alisol A 24-acetate |
| 表1 泽泻醇化合物加入p53DNA溶液后的紫外吸收强度的变化 Table 1 The change of ultraviolet absorption intensity after alisol acetates added to p53DNA Solution |
因DNA本身基本没有荧光, 需要借助荧光探针分子EB, 形成EB-DNA荧光探针体系[9]。 泽泻醇化合物与p53DNA相互作用的荧光光谱, 如图4所示, 随着泽泻醇化合物的不断加入, EB-DNA体系的荧光强度逐渐减弱, 峰位几乎没有发生位移(590.5 nm左右), 推测23B和24A均竞争置换出EB, 与p53DNA发生了嵌插作用。
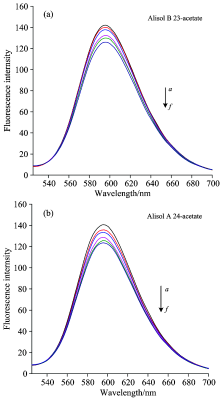 | 图4 泽泻醇单体加入p53DNA溶液的荧光光谱Fig.4 Fluorescence spectral changes of alisol mononer added to p53DNA Solution a: 0 μ L; b: 5 μ L; c: 10 μ L; d: 15 μ L; e: 20 μ L; f: 25 μ L |
为研究泽泻醇与p53DNA的荧光猝灭机理, 可利用Stern-Volmer方程[11], 绘制F0/F与[Q]曲线。
式中, F0为未加猝灭剂时的荧光强度; F为加入猝灭剂后的荧光强度; Kq为分子扩散碰撞猝灭速率常数; τ 0为荧光分子的平均寿命; KSV称为Stern-Volmer猝灭常数, 是双分子猝灭速率常数与单分子衰变速率常数的比率; [Q]为猝灭剂浓度。
由图5可知, 两种泽泻醇类化合物的F0/F与[Q]具有较好的线性关系。 通过Sterm-Volmer方程计算出泽泻醇与EB-DNA体系作用的相关常数(见表2); 23B的猝灭常数KSV=7.64× 104 L· mol-1, 猝灭速率Kq=7.64× 1012 L· mol-1· s-1; 24A的KSV=6.36× 104 L· mol-1, Kq=6.36× 1012 L· mol-1· s-1。 一般认为, 生物大分子的荧光寿命大约为10-8 s, 以KSV值较小的24A为例, 其猝灭速率为Kq=6.36× 1012 L· mol-1· s-1, 小分子与生物大分子之间的最大扩散控制的碰撞猝灭常数2× 1010 L· mol-1· s-1, 计算求得的猝灭速率远远大于这个数值[11]。 由此可推断, 静态猝灭是泽泻醇类化合物与p53DNA相互作用的主要作用模式。 同时, 比较发现, 23B与p53DNA相互作用的亲和力大于24A, 这与紫外-可见吸收光谱的实验结论一致。
| 表2 泽泻醇化合物与p53DNA相互作用的荧光猝灭方程和相关系数 Table 2 Fluorescence quenching equation and correlation coefficient of the interaction between alisol acetates and p53DNA |
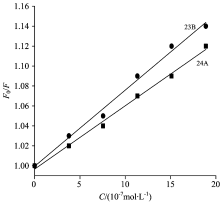 | 图5 泽泻醇与p53DNA溶液的荧光实验的Sterm-Volmer曲线Fig.5 Sterm-Volmer curve of fluorescence experiment of alisol acetates and p53DNA solution |
静态猝灭过程中可能存在有多个结合位点的情况。 通过以下公式将泽泻醇对p53DNA的猝灭数据以lg(F0-F/F)对lg[D]作图可得一直线, 该直线的截距为结合常数Ka, 而斜率则为结合位点数n[12], 见表2。
由图6可知, 两种泽泻醇类化合物p53DNA荧光猝灭的双对数图均为直线, 且线性关系良好。 23B结合位点> 24A, 说明23B与p53DNA的嵌插结合强于24A, 23B可能与p53DNA的2个位点结合, 而24A可能与p53DNA体系的1个位点结合。
 | 图6 泽泻醇对p53DNA荧光猝灭的双对数图Fig.6 The double logarithmic diagram of fluorescence quenching of p53DNA by alisol acetates |
综合比较泽泻醇单体及其混合物对EB-DNA体系的荧光强度和荧光猝灭率的影响(见图7、 表3), 泽泻醇单体及其混合物对EB-DNA体系荧光降低程度为: 24A∶ 23B(1∶ 1)> 23B> 24A, 这表明了24A∶ 23B=1∶ 1的混合物对EB-DNA体系荧光的降低程度强于24A和23B对EB-DNA体系的单独作用, 这与紫外-可见吸收光谱实验的结果一致。
 | 图7 泽泻醇加入p53DNA溶液的荧光光谱 24A: 24-乙酰泽泻醇A; 23B: 23-乙酰泽泻醇BFig.7 Fluorescence spectral changes of alisol acetates added to p53DNA Solution (a): Alisol B 23-acetate; (b): Alisol A 24-acetate |
| 表3 泽泻醇化合物加入p53DNA溶液后的荧光强度的变化 Table 3 The change of fluorescence intensity after alisol acetates added to p53DNA Solution |
采用分子模拟进一步探讨泽泻醇类化合物与p53DNA的相互作用模式。 p53DNA为B型DNA片段, 含11个GC碱基对, 5个AT碱基对, 四种疏水性的碱基位于螺旋的内侧, 带负电荷的、 亲水性的磷酸基与脱氧核糖单位位于外侧。 DNA由平行堆积的碱基、 聚合的阴离子磷酸骨架以及两条脱氧核苷酸形成的大沟、 小沟组成DNA靶向分子的识别位点。
分别将23B, 24A以及24A∶ 23B=1∶ 1组合定义为配体, 与p53DNA进行对接, 综合考虑配体-受体复合物的CDOCKER Energy, CDOCKER Interaction Energy以及两者形成氢键的情况判断最终的稳定构象, 选取此构象作进一步分子动力学模拟。
2.3.1 泽泻醇类化合物(单体)与p53DNA的分子对接结果
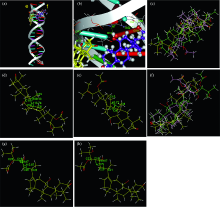
23B与p53DNA相互作用的分子模拟结果如图8所示。 图8(a)是该化合物与p53DNA相互作用的总体图, 其与p53DNA结合的活性口袋包含的脱氧核苷酸为: e链: DC14, DC15, DC16, DA17, DA18; f链: DA3, DA4, DT5, DT6, DG7, DG8。 如图8(a)所示, 23B的母环结构嵌插入p53DNA双螺旋骨架的碱基对中, 而侧链一段则裸露在外, 扭曲向外部的磷酸骨架, 说明二者的相互作用模式是部分嵌入结合。 这与光谱实验得出的结论基本一致。 其中, 23B的C14-O28-H72与p53DNA f 链腺嘌呤脱氧核苷酸(DA4)中磷酸上的氧原子形成氢键[见图8(b)、 表4], 键长为1.951 Å , 键角为157.88° 。
| 表4 泽泻醇与p53DNA形成的氢键的键长和键角信息 Table 4 The length (Å ) and the angle of hydrogen bond formed between alisol acetates and p53DNA |
23B对接前后, 构象发生较大改变, 如图8(c)所示。 计算得RMSD值为3.96 Å 。 如图8(d)和(e)所示, 对接后其母环结构折叠明显, 对接后小分子从原来的舒展状打开结构折叠为弯月形以吻合p53DNA双螺旋结构, 便于二者的结合。 对接前小分子母环结构舒展, ∠C8-C9-C11为105.75° , ∠C9-C11-C15为121.61° , ∠C8-C9-C11-C15为-48.35° , 对接后, ∠C8-C9-C11为111.05° , ∠C9-C11-C15为105.75° , ∠C8-C9-C11-C15为-34.62° , 母环之间的夹角发生了显著的变化、 尤其二面角减小, 使得对接后母环结构由打开舒展状态到折叠状态, 部分插入到p53DNA中发生相互作用。 同时, 23B与p53DNA小沟处的磷酸形成氢键, 进一步增强了23B与p53DNA复合物的稳定性。 计算得两者相互作用的静电能为-21.39 kJ· mol-1, 范德华能为-13.87 kJ· mol-1, 由此可知, 体系之间的静电能比范德华能低, 说明该小分子与p53DNA主要是以静电相互作用而存在。 计算得23B与p53DNA之间的结合能Δ G° 为-31.47 kJ· mol-1。
24A与p53DNA相互作用的分子模拟结果如图9所示。 图9(a)是该化合物与p53DNA相互作用的总体图, 其与p53DNA结合的活性口袋包含的脱氧核苷酸为: e链: DC14, DC15, DC16, DA17, DA18; f链: DT6, DG7, DG8, DG9, DC10。 如图9(a)所示, 24A的侧链结构嵌插入p53DNA双螺旋骨架中, 而母环结构一段则裸露在外, 扭曲向外部的磷酸骨架, 说明二者相互作用的方式是部分嵌插结合, 这与光谱实验结论一致。 同时, 24A与p53DNA无氢键, 计算得两者之间的相互作用的静电能为-27.71 KJ· mol-1, 范德华能为-14.35 KJ· mol-1, 体系之间的静电能低于范德华能, 说明该小分子与大分子主要是以静电作用而相互结合。 计算得24A与p53DNA之间的结合能Δ G° 为-23.10 kJ· mol-1。
24A对接后, 构象发生改变, 如图9(b)所示。 计算得RMSD值为2.46 Å 。 如图9(c)和(d)所示, 对接后其侧链折叠明显, 对接后小分子从原来的打开结构折叠为团簇状结构, 对接前小分子侧链与环状结构舒展, ∠C21-C20-C19为117.89° , ∠C20-C19-C23为110.22° , ∠C21-C20-C19-C23为168.56° , 对接后∠C21-C20-C19为113.86° , ∠C20-C19-C23为113.69° , ∠C21-C20-C19-C23为-92.44° , 二面角的显著变化, 说明对接后小分子侧链发生很大扭转, 由原来的舒展打开状态变为环状折叠, 分子极性减小, 疏水性增强, 而位于螺旋的内侧为四种疏水性的碱基, 导致24A仅部分嵌入到p53DNA中发生相互作用。
2.3.2 泽泻醇类化合物(混合物)与p53DNA的分子对接结果
23B与24A 1∶ 1混合物与p53DNA分子模拟结果如图10所示。 图10(a)是该化合物与p53DNA相互作用的总体图, 其与p53DNA结合的活性口袋包含的脱氧核苷酸为: e链: DC14, DC15, DC16, DA17, DA18; f链: DA3, DA4, DT5, DT6, DG7, DG8。 24A-23B复合物与p53DNA对接后, 如图10(a)和(b)所示, 24A-23B复合物中的24A部分嵌入p53DNA双螺旋骨架的碱基对中, 23B扭曲向外部的磷酸骨架, 说明二者的相互作用模式是部分嵌入结合, 这与光谱实验结果基本吻合。 如图10(d)所示, 24A-23B复合物与p53DNA形成4个氢键(见表5), 其中23B的C14-O28-H72与p53DNA f 链腺嘌呤脱氧核苷酸(DA4)中磷酸上的氧原子形成氢键, 键长2.167 Å , 键角135.49° ; 24A的C14-O28-H74与p53DNA f 链DA4中腺嘌呤上的氮原子形成氢键, 键长2.127 Å , 键角30.89° ; 24A的C19-O18-H56与e链胸腺嘧啶脱氧核苷酸(DT19)中胸腺嘧啶上的氧原子形成氢键, 键长2.265 Å , 键角134.84° ; 以及f链腺嘌呤脱氧核苷酸(DA4)中腺嘌呤上的H62与24AC19-O18形成氢键, 键长2.099 Å , 键角136.92° 。
23B对接前后, 构象发生了显著的改变, 如图10(c)所示。 计算得RMSD值为9.41 Å 。 如图10(d)和(e)所示, 对接后其母环结构折叠明显, 对接后小分子从原来的打开结构变为折叠, 对接前小分子母环结构舒展, ∠C8-C9-C11为105.75° , ∠C9-C11-C15为121.61° , ∠C8-C9-C11-C15为-48.35° , 三元对接后, ∠C8-C9-C11为113.74° , ∠C9-C11-C15为109.13° , ∠C8-C9-C11-C15为43.72° , 母环之间的夹角发生了较大变化、 尤其二面角减小, 使得对接后母环由打开舒展状态到折叠状态, 部分插入到p53DNA中发生相互作用。 同时, 23B与p53DNA小沟处的磷酸形成氢键, 进一步增强了23B-24A复合物与p53DNA结合的稳定性。
24A对接前后, 构象发生改变, 如图10(f)所示。 计算得RMSD值为3.25 Å ; 比较对接前后, 如图10(g)和(h)所示, 对接前∠C21-C20-C19为117.89° , ∠C20-C19-C23为110.22° , ∠C21-C20-C19-C23为168.56° , 三元对接后, ∠C21-C20-C19为115.67° , ∠C20-C19-C23为109.47° , ∠C21-C20-C19-C23为169.07° 。 表明, 三元对接后该小分子侧链发生了扭转, 由原来的舒展状态变为环状折叠, 且与p53DNA存在氢键作用, 从而加强23B-24A复合物与p53DNA的相互作用。
计算得23B∶ 24A=1∶ 1组合与p53DNA相互作用的静电能为-51.40 kJ· mol-1, 范德华能为-37.90 kJ· mol-1, 体系之间的静电能远低于范德华能, 说明该小分子与大分子结合的主要模式是静电相互作用。 计算得23B∶ 24A=1∶ 1组合与p53DNA之间的结合能Δ G° 为-60.44 kJ· mol-1。 推测可能由于24A-23B复合物与p53DNA形成的氢键较多, 增强了二者结合的稳定性。
| 表5 泽泻醇与p53DNA形成的氢键的键长和键角信息 Table 5 The length (Å ) and the angle of hydrogen bond formed between alisol acetates and p53DNA |
综合比较泽泻醇单体和混合物与p53DNA的分子对接结果表明, 泽泻醇单体及其混合物与p53DNA结合能的大小顺序为: 24A∶ 23B (1∶ 1)> 23B> 24A, 混合物的结合能低于泽泻醇单体与p53DNA结合能, 表明24A及23B对抗癌靶点p53DNA具有协同增效作用, 这与紫外光谱、 荧光光谱规律一致。 分子模拟结果表明23B与p53DNA f链上的腺嘌呤脱氧核苷酸(DA4)、 e链上的胸腺嘧啶脱氧核苷酸(DT19)的2个位点结合, 24A与p53DNA f链上的腺嘌呤脱氧核苷酸(DA4)位点结合, 这与荧光光谱显示的结合位点结果一致。
分子模拟揭示了泽泻醇单体及其混合物与p53DNA的相互作用模式均为部分嵌插结合。 其中, 23B单独与p53DNA结合后, 由于侧链的含氧三元环存在空间位阻, 母环结构结构折叠明显, 母环C14-上的羟基是其与P53DNA相互作用的重要基团; 24A单独与p53DNA结合后, 侧链发生很大扭转, 由原来的打开状态变为环状折叠; 23B-24A复合物与p53DNA结合后, 23B的母环结构和24A的侧链均发生显著的折叠, 并且复合物中23B母环C14-上的羟基、 24A母环C14-上的羟基和24A侧链C19-上的羟基为该复合物与p53DNA相互作用的重要基团。 由此表明, 泽泻醇化合物母环C14-和24A侧链C19-上的羟基及结构中的空间位阻是影响该类化合物与p53DNA相互作用的关键因素。 同时表明, 23B与24A由于侧链结构差异, 导致其与p53DNA的结合部位不同。 本课题组前期研究表明[14, 15, 16, 17, 18, 19], 泽泻醇类化合物的侧链为其活性基团, 侧链对该类化合物与大分子的相互作用起到舵手作用, 称为“ 舵手基团” (steering group)。 它可能是决定与大分子作用方式的关键基团, 对该类化合物与大分子的相互作用起到决定性的作用, 这与本研究结果一致。
同时, 23B结合于p53DNA f 链腺嘌呤脱氧核苷酸(DA4)和胸腺嘧啶脱氧核苷酸(DT19), 并与DA4中磷酸上的氧原子形成氢键; 24A结合于f 链腺嘌呤脱氧核苷酸(DA4); 23B-24A复合物结合于p53DNA f 链的腺嘌呤脱氧核苷酸(DA4)和e链的胸腺嘧啶脱氧核苷酸(DT19), 并与DA4中磷酸上的氧原子及腺嘌呤上的氮原子和氧原子形成3个氢键, DT19中胸腺嘧啶上的氧原子形成1个氢键。 可见无论是泽泻醇单体或混合物与p53DNA对接, p53DNA双链的f 链的腺嘌呤脱氧核苷酸(DA4)中磷酸上的氧原子及腺嘌呤上的氮原子和氧原子, e链的胸腺嘧啶脱氧核苷酸(DT19)中胸腺嘧啶上的氧原子为23B, 24A及两者1∶ 1混合物与其结合的重要位点。
采用紫外-可见吸收光谱、 荧光光谱和分子模拟探讨了泽泻醇类化合物及混合物与抗癌靶点p53DNA的相互作用, 从分子层次探讨了泽泻醇类化合物抗肿瘤的作用机制。 紫外光谱、 荧光光谱和分子模拟结果一致表明, 泽泻醇单体及其混合物与p53DNA结合能的大小顺序为: 24A∶ 23B (1∶ 1)> 23B> 24A, 且三者与p53DNA的相互作用模式均为嵌插结合, 与混合物的结合能低于泽泻醇单体与p53DNA结合能, 说明24A及23B对抗癌靶点p53DNA具有协同增效作用。 分子模拟的结果显示, 分子模拟结果表明23B与p53DNA f链上的腺嘌呤脱氧核苷酸(DA4)、 e链上的胸腺嘧啶脱氧核苷酸(DT19)的2个位点结合, 24A与p53DNA f链上的腺嘌呤脱氧核苷酸(DA4)位点结合, 这与荧光光谱中结合位点结果一致。
综上所述, 泽泻醇化合物母环C14-和结构中的空间位阻, p53DNA f 链的腺嘌呤脱氧核苷酸(DA4)中磷酸上的氧原子为泽泻醇类化合物与p53DNA相互作用的关键结合位点, 是该类泽泻醇发挥抗肿瘤作用的活性中心。 24A侧链C19-上的羟基, p53DNA f 链的腺嘌呤脱氧核苷酸(DA4)中腺嘌呤上的氮原子和氧原子, e链的胸腺嘧啶脱氧核苷酸(DT19)中胸腺嘧啶上的氧原子为泽泻醇类化合物协同增效作用的关键。 该结果从分子层次探讨了泽泻醇的抗肿瘤机制, 为设计合成泽泻醇类DNA靶向药物、 体外筛选以及探讨药物的作用机理, 对抗癌药物设计方面具有重要的意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|