作者简介: 朱锡宇, 1992年生, 贵州大学生命科学学院硕士研究生 e-mail: zxydiy1@gmail.com
二价汞离子作为一种重要的环境污染物, 一直以来受到国内外广泛关注。 基于T-T错配的Hg2+检测极大依赖于汞选择性寡聚核苷酸(MSO)的设计, 利用SYBR Green I对目前所报道的汞离子探针进行了优化, 研究了若干种MSO探针与Hg2+的结合响应, 在对探针二级结构进行分析和讨论的基础上, 提出最优的富T探针序列, 并由此建立了一种基于SYBR Green I的水中汞离子快速、 便捷的荧光检测方法。 最终测得3种实际水样的加标回收率在82.8%~101.8%之间, 相对标准偏差小于15%, 表明该方法受环境基质的影响较小, 可应用于实际水样中的汞离子检测。
As an important environmental contaminant, mercury(Ⅱ) has caused worldwide concern. The T-T mismatch based detection for Hg2+ greatly depends on the design of mercury specific oligonucleotide (MSO). This paper optimized the currently reported MSOs by using SYBR Green I. Based on the binding response analysis between several MSOs and Hg2+and further discussion on the secondary structure of sequences, the optimum T-rich sequences was proposed. Hence a fluorescent detection method towards Hg2+ in water samples based on SYBR Green Ⅰ was established. Consequently, the recovery ratios in spiked real water samples ranged from 82.8% to 101.8% with the relative standard derivation of less than 15%. Results show that this method was slightly affected by the environmental matrix, providing accurate detection of mercury ions in real water samples.
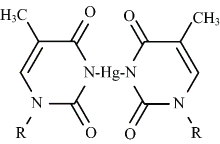
汞是一种高毒性金属, 长期接触会对脑、 肾、 免疫系统和其他生理器官造成不良影响。 汞的排放绝大多数来源于人类的生产活动, 如煤炭资源的燃烧等。 每年度汞的全球排放量大概是1.9万吨[1]。 水环境中最常见的有毒汞状态是水溶性二价汞离子(Hg2+)[2], 因此开发简便快速的汞离子高灵敏和高选择性检测技术具有重要的理论和应用价值。 2004年, Ono和Togashi发现了汞离子可以结合在两个T碱基之间, 引起T-Hg2+-T错配(图1), 并基于此发现, 设计了一种荧光型Hg2+传感器[3]。 在此设计中, 两端标记的富含T碱基的DNA链在Hg2+的存在下折叠成发夹结构, 导致荧光强度的降低, 检测限可以达到40 nmol· L-1。 此后, 基于富T碱基功能核酸的Hg2+生物传感技术逐渐成为环境与分析科学的热点课题。 与传统的亲和识别材料— — 抗体相比, 功能核酸具有可人工合成、 生产成本低、 性能稳定、 体外筛选所得、 无需考虑目标物是否具有免疫原性等优点[4, 5, 6]。 为了进一步优化T-Hg2+-T错配型传感检测方法的灵敏度, 基于光诱导电子转移[7], 氧化石墨烯[8], 分子信标[9, 10], 功能核酸[11], SYBR Green I[12]等高灵敏Hg2+传感方法被陆续报道。
SYBR Green I(SGI)是一种在分子生物学领域用作核酸染色剂的非对称花青染料, 其灵敏度相对于传统核酸染料溴化乙锭要高出25~100倍。 SGI与DNA结合后所得到的DNA-染料复合物, 吸收蓝光(λ max=497 nm)后发射光为绿光(λ max=520 nm)[13]。 染料优先与双链DNA(dsDNA)结合, 非常少量与单链DNA(ssDNA)结合[8]。 因此, 可以认为SGI的荧光信号强度与dsDNA数量有关, 根据荧光信号便可以检测出体系中存在的dsDNA数量。
基于T-T错配的Hg2+检测极大依赖于汞选择性寡核苷酸(mercury specific oligonucleotide, MSO)探针的设计。 然而, 目前这方面的相关报道却非常有限。 因此, 本研究拟采用SGI为核酸染色剂, 研究若干种MSO探针[14, 15, 16, 17, 18]与Hg2+的结合响应, 在对探针二级结构进行深入分析和讨论的基础上, 提出最优的富T探针序列, 并建立一种基于SGI的水中汞离子快速、 便捷的荧光检测方法, 最终对实际水样进行了加标回收测试。
汞离子标准液(1 000 μ g· mL-1)购于国家标准物质中心。 Tris-HCl等其他盐购自Sigma-Aldrich; 盐酸(HCl)、 乙醇和其他有机物购自北京化工厂; 所有溶液均使用分子生物级水制备(Corning Cellgro, NY, USA); 紫外分光光度计(UV)型号为日本日立U-3900; 荧光分光光度计为日立公司F-7000。 所有核酸序列(HPLC纯化)均购自上海生工, 具体名称与碱基序列如表1所示。
| 表1 汞选择性寡核苷酸探针序列 Table 1 Mercury specific oligonucleotide sequences |
SYBR Green I购于Sigma-Aldrich公司, 保存于-20 ℃条件下, 使用前对其进行短暂离心(此处不应使用玻璃容器, 染料可能会吸附到玻璃容器表面), 再使用1X TBE缓冲液(89 mmol· L-1 Tris碱, 89 mmol· L-1硼酸和1 mmol· L-1 EDTA, pH 8.0)以1∶ 10 000缓冲液(暨1 mL染料原始溶液可以制备10 L的染料溶液)的稀释比例制备SG I染料储备溶液。
染料/碱基比例(dye base pair ratio, DBPR)为初始反应体系中每摩尔DNA碱基 (base pair, bp)所对应的染料(dye)摩尔数, 其计算公式如式(1)
本文中采用SGI作为荧光染料。 固定体系MSO浓度为 300 nmol· L-1, 汞离子浓度为500 nmol· L-1, 依据相关经验, 在DBPR=0.25~1.25的范围内调节SG I浓度。 每个反应体系于室温下在10 mmol· L-1 MOPS缓冲液中避光反应0.5 h。 根据反应体系相较于空白对照体系(无汞离子存在)荧光增强倍数(F/F0, 计算公式如式(2))的高低对DBPR进行优化。 荧光光谱仪测试条件: 光电倍增管电压400 V, 激发波长为497 nm, 发射波长为520 nm, 若无特殊说明, 本文中其他测试条件均与此相同。
本研究选取了若干代表性MSO(如表1所示), 固定体系MSO浓度为300 nmol· L-1, 使用1.2中优化出的DBPR, 调整汞离子浓度。 每个反应体系于室温下在10 mmol· L-1 MOPS缓冲液中反应0.5 h, 根据相应F/F0对各MSO进行对比优化。
在基于紫外吸收波谱推断MSO识别汞的可能构型时, 固定体系MSO浓度为20 μ mol· L-1, 汞离子浓度在0~20 μ mol· L-1内变化。 每个反应体系于室温下在10 mmol· L-1 MOPS 缓冲液中反应0.5 h, 随后进行紫外吸收波谱测试, 并记录260 nm处紫外吸收值变化。
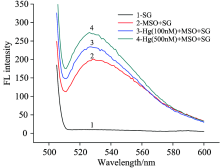
图2显示了在不存在和存在Hg2+的不同条件下SGI的荧光变化。 在没有Hg2+的情况下, SGI溶液只显示非常弱的荧光(曲线1)。 加入MSO(T10)后, 混合物的荧光略有增加(曲线2), 说明随机卷曲的MSO与SGI相互作用较弱。 然而, 分别在100和500 nmol· L-1 Hg2+的存在下, SGI/MSO复合物的荧光不断增加(曲线3, 4), SGI-MSO和SGI-Hg2+-MSO之间的差异表明MSO与汞离子作用后形成局部双链结构, 可与SGI强烈相互作用, 这使得该方法可以实现Hg2+的检测。
为测试该方法在实际检测中的性能, 考察实际环境中基质效应对测试的影响, 本研究选择三种实际水样进行了加标回收实验, 包括两种地表水(丹江口水库, 清华大学荷塘水)和从清华大学下方数百米处抽取的碳酸钙硬度为290~350 mg· L-1的地下水。 丹江口水库作为南水北调工程中线的水源, 其水质状况非常重要。 荷塘是清华大学一个没有流入和流出的小湖。
在测量之前需要进行包括煮沸以沉淀碳酸盐, 待冷却至室温后, 使用0.22 μ m尼龙滤膜过滤以除去较大的颗粒物, 然后在回收实验前用去离子水稀释2倍。 在检测的线性范围内, 加标浓度分别为10, 50和100 nmol· L-1, 对加标前后每个样品平行测试3次, 分别计算回收率。
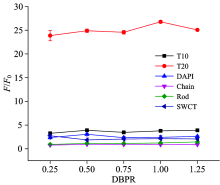
合适的DBPR对基于荧光染色的生物传感体系有着重要的意义。 若体系中荧光染料过少, 所形成的dsDNA不能被完全染色, 会降低传感上限的测量准确度; 若体系中荧光染料过多, 则游离的荧光染料可能增强背景噪声, 削弱体系灵敏度。 一般情况下, 适当提高荧光染料浓度可以提高检测的灵敏度、 扩大靶标定量线性范围。 本工作采用SG I作为荧光染料。 根据先前的经验, 在0.25~1.25的范围内基于MSO体系优化DBPR。 如图3所示, 随着DBPR的增加, F/F0(暨信号与基线的比值)整体趋势大致相同, 当DBPR为0.5时F/F0已经比较稳定, 后续即使加大, 整体的比值也没有非常明显的变化, 说明此时SGI的用量比较合适, 既可以明确的指示双链的量, 又不会对杂交产生影响。 同时可以看出, T20对SGI的响应强度非常大, 而其他探针的响应情况区别不是很大。 可能因为T20探针拥有数目最多的T碱基, 结合汞离子后, 与SGI结合的能力最强。 在保证一定灵敏度的前提下, 出于节省染料的目的, 本工作以DBPR=0.5作为后续试验的条件。
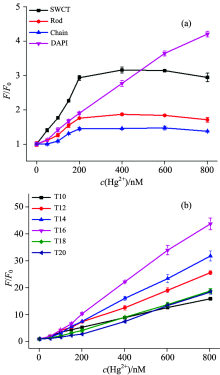
目前已经报道的MSO类型丰富, 但至今却没有工作针对探针类型进行系统优化的报道。 本工作基于上述优化的DBPR和固定的探针浓度、 在适宜的Hg2+浓度范围内, 针对前人报道中常见的代表性MSO(表1), 按照1.3中所描述的方法, 采用F/F0为评价指标对各MSO汞传感灵敏度进行测试, 结果如图4所示。 整体上, 在所研究Hg2+范围内, 非Tn型MSO探针荧光信号增强倍数较低, F/F0普遍低于5; 而Tn型MSO荧光信号增强倍数较高, F/F0最高可达40以上。 在Tn型MSO中, T16探针最为灵敏, 其次为T14。 而当Tn长度增至20时(T20), 此时可能因为随着DNA探针链的增长, 其自身产生发卡结构而使得结合的汞离子含量减少, 进而使得F/F0的比值减小, 与T10接近。
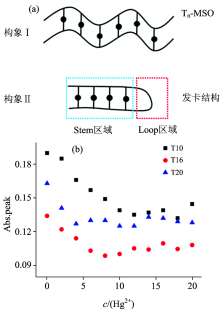
进一步基于紫外吸收波谱对Tn型MSO-Hg2+复合物构型进行研究。 选用短(T10)、 中(T16)、 长(T20)三种Tn型MSO为代表进行验证。 利用DNA在260 nm UV处有特定的吸收峰, 可以定量DNA的浓度。 在理想状态下, 当富含T碱基的dsDNA与Hg2+结合后, 便会形成如图5(a)构像Ⅰ 所示, dsDNA MSO上的T碱基分别与Hg2+结合, 引发其吸收峰的位置发生移动, 继而原先在260 nm处的峰值便会降低, 在其他波长位置产生新的吸收峰。 而在实际检测中, 并不完全如图5(a)构像Ⅰ 所示那样, 而是可能单条MSO自身与Hg2+发生杂交, 产生如图5(a)构像Ⅱ 所示的发卡结构。 根据这一特性, 在相同的T碱基浓度下, 如果MSO-Hg2+形成发卡结构, 该发卡结构相对于dsDNA将少结合一定量的Hg2+离子。 在较小Hg2+浓度的时候, 其在260 nm处的吸收值便会降低并趋于稳定。
根据不同浓度汞离子所对应的260 nm处的峰值的变化趋势可以得知不同探针出现发卡结构的可能, 进一步对MSO-Hg2+复合物构型加以分析。
由图5(b)可以看出, 体系中存在4 μ mol· L-1汞离子的情况下, T20探针的吸收峰值最早趋于稳定, 达到一个平台; 而后当体系中的汞离子达到8 μ mol· L-1时, T16探针的吸收峰值也趋于稳定; 最后, 直到体系中的汞离子浓度达到12 μ mol· L-1时, T10探针的吸收峰值才趋于稳定。 由此可以推断, T20探针存在一定的发卡结构, 在相同的T碱基浓度下, 发夹结构将比dsDNA结合更少的汞离子。 因此, 在较低Hg2+浓度的情况下, 紫外吸收便会出现饱和。 同时也说明, 在较低浓度汞离子存在的情况下, 使用T20探针可能会使检测做到更加灵敏。
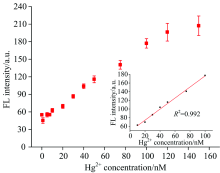
使用上文中优化的条件进行Hg2+的检测, 随着Hg2+浓度的增加, 荧光强度逐渐增加。 图6表示不同浓度的Hg2+的荧光强度的标准曲线。 检测限为7.89 nmol· L-1(定义为3σ /斜率, 其中σ 是空白溶液的相对标准偏差, n=11), 线性范围为10~100 nmol· L-1。
为了考察实际环境中基质效应对测试的影响, 尝试在三种不同水样中加入三个不同汞离子浓度(5, 10和100 nmol· L-1)并测试3次, 三种不同水样的加标回收能力均令人满意, 整体回收率在82.8%~101.8%之间, 表明该方法有着很好的精密度和准确性, 受环境基质的影响较小, 可应用于实际水样中汞离子的检测。
| 表2 三种不同水样的加标回收测试(n=3) Table 2 Recoveries of spiked samples of three different water (n=3) |
建立了一种基于功能核酸的水中汞离子荧光检测方法, 利用SYBR Green I特异性染色dsDNA, 以及Hg2+架桥形成的T-Hg2+-T复合结构, 实现对Hg2+的荧光定量检测。 发现在考察的富T功能核酸序列中, 纯T碱基序列对Hg2+进行传感的灵敏度要高于其他非纯T序列, 其中基于SGI染色法可以得出T16探针的灵敏度最高。 利用紫外分光光度计判断了不同纯T碱基MSO序列识别Hg2+的可能原理。 最终建立的Hg2+检出限为7.89 nmol· L-1, 检测线性范围10~100 nmol· L-1。 针对加标三种实际水样的Hg2+回收率在82.8%~101.8%之间, 证实了该方法能够实现实际水样中Hg2+的检测。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|