作者简介: 罗 丹, 女, 1993年生, 西南大学化学化工学院硕士研究生 e-mail: 1105877583@qq.com
联合紫外、 拉曼光谱及其在L-半胱氨酸/银传感器(L-Cys@Ag)的表面增强拉曼散射(SERS)光谱表征吲哚美辛, 并与固体吲哚美辛的常规拉曼光谱(NRS)进行对比, 发现L-Cys@Ag对吲哚美辛有明显拉曼信号放大, 但其特征峰几乎不产生位移。 研究不同酸碱环境下, L-Cys@Ag的吸附模型, 分析吲哚美辛在L-Cys@Ag上的拉曼光谱和SERS光谱, 归属拉曼特征峰。 结果显示, L-半胱氨酸与银主要以Ag—S键的方式形成稳定吸附, 但是中性和碱性条件时—COO-也会吸附到银表面。 结果表明: 半胱氨酸中的氨基与吲哚美辛中的羧基氧、 苯环中的π电子发生吸附, 整体能量下降, 使结构更加稳定。 加入牛血清白蛋白(BSA)后, pH为5时, SERS强度明显减弱。 在pH为7和9时, N—H伸缩振动和酰胺Ⅱ振动明显增强, 吲哚美辛的苯环和吲哚环的特征峰振动消失。 其原因是吲哚美辛的苯环和吲哚环进攻BSA后, 吲哚美辛特征振动消失, 但是吲哚美辛中的氮, 羰基与BSA中氨基吸附, 使得C—N和—COO-的SERS信号稳定。 这为将来吲哚美辛以及相关非淄体消炎药的改良和新药的研究提供了可靠的鉴别和分析方法。
In this paper, indomethacin are characterized by the spectroscopy of UV and Raman and surface enhanced Raman scattering (SERS) on the substrate of L-Cys@Ag. And compared with the conventional Raman spectra (NRS) of solid indomethacin, it was found that L-Cys@Ag had significant Raman enhancement for indomethacin, but the characteristic peak was almost unchanged. The Raman spectra of indomethacin on L-Cysteine/silver were analyzed by the adsorption model of L-Cysteine and silver under acidic and basic conditions. The results showed that L-Cysteine and silver were mainly adsorbed by Ag—S bonds, but neutral and alkaline conditions carboxyl were also adsorbed to the surface of silver. The reson why the overall energy decreases is that the amino groups in the cysteine react with the carboxyl groups in the indomethacin and the π electrons in the benzene ring. After adding bovine serum albumin (BSA), the SERS intensity was significantly decreased at pH 5. At pH 7, and pH 9, the NH stretching vibration and amide II vibration were obviously enhanced, as well as the benzene ring and indole ring of indomethacin. The peak vibration disappeared due to the disappearance of indole mesacin, and the nitrogen and carbonyl groups in indomethacin were adsorbed by amino groups in BSA, and the C—N And —COO’s SERS signal is stable. This provides a reliable method for the identification and analysis of the future improvement of indomethacin and related non-Zhiban anti-inflammatory drugs and new drugs.
吲哚美辛俗称消炎痛、 抗炎吲哚酸、 意施丁等, 是一种常见的非淄体消炎药。 由于缓解炎性疼痛作用明显, 常用于关节炎、 癌性疼痛和关节囊炎等。 非法和长期使用止痛剂将威胁人体健康, 造成严重的过敏反应和细菌耐药性, 甚至会导致死亡[1], 目前虽然常使用高效液相色谱(HPLC)[2], 气相色谱(GC)[1]等方法检测吲哚美辛的浓度, 但是探讨药物与身体内部的特征精细结构的作用变化, 为进一步研究改善药物副作用有重要意义。 L-半胱氨酸(L-Cys)是含硫氨基酸之一, 可以和纳米银形成稳定吸附。 牛血清白蛋白(BSA)是氨基酸混合的生物大分子, 具有较高的稳定性。
表面增强拉曼散射(SERS)因其快速, 非破坏性, 高灵敏度和选择性好等优点而关注[3], 在一些新的研究领域中甚至能达到单分子水平[4]。 大量研究报道表明[5, 6, 7], SERS作为痕量检测技术可以检测到相当低的浓度, 这也是SERS受到许多科学家青睐的原因。 随着研究的不断深入, SERS已经广泛应用于分子结构[8], 组分分析, 环境保护, 疾病监测[9], 尤其是纳米科学和表面科学等领域。 SERS通常采用贵金属纳米结构材料如银、 金、 铜、 钛等(金、 银、 铜等具有较强的表面等离子体发射)作为基底, 通过其粗糙表面表征分子的精细结构[10], 使得光谱信号增强。 因此, SERS光谱与常规拉曼光谱(NRS)相比信号放大了约106~1014倍[11]。 目前应用核-壳纳米颗粒[12]、 纳米棒[13]、 纳米立方体[14]、 纳米球[15]和纳米管[16]等结构, 达到拉曼信号增强早有研究[17]。 目前利用拉曼光谱对吲哚美辛研究的报道极少。 本文所制备的纳米银通过扫描电子显微镜(SEM)图像显示具有更加不规则的表面、 较大的比表面积和更多的热点。 通过SERS考察L-半胱氨酸/银(L-Cys@Ag)基底结合蛋白推测酸碱条件下吲哚美辛的SERS机理和吸附状态, 为深入研究吲哚美辛与其他非淄体消炎药的结构, 改善其副作用提供有益的参考。
FS-100型傅里叶变换拉曼光谱仪(德国Bruker公司), Nd:YAG激光光源, 液氮冷却Ge检测器; DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司); 80-1台式低速离心机(金坛科技仪器有限公司)。 四氯金酸三水合物(H7AuCl4O3)、 吲哚美辛(C19H16ClNO4)、 L-半胱氨酸(L-Cys)、 购于阿拉丁三(羟甲基)氨基甲烷购于天津市科密欧化学试剂有限公司; 牛血清白蛋白(BSA)购于如吉生物科技; 硝酸银(AgNO3)、 氯化钠(NaCl)、 六水三氯化铁(FeCl3· 6H2O)、 盐酸(HCl)、 乙醇(C2H5O)和乙二醇(C2H6OH)均为分析纯, 均购于重庆川东化工(集团有限公司); 聚乙烯吡咯烷酮(PVP)为分析纯, 购于国药集团化学试剂有限公司。
1.2.1 银纳米线的制备
按照文献[13]的方法并稍加改变后制备银纳米线。 AgNO3作为银源, 利用乙二醇进行还原。 将PVP溶于乙二醇中, 配置0.56 mol· L-1 PVP溶液。 取50 mL 0.56 mol· L-1 PVP溶液加入到 250 mL的烧杯中, 以磁力搅拌器搅拌同时油浴从25 ℃ 加热到160 ℃, 保持温度恒定, 加入110 μ L 0.05 mmol· L-1 FeCl3溶液, 5 min后, 加入100 μ L 0.15 mol· L-1 NaCl 溶液, 5 min后, 加入10 mL 0.15 mol· L-1 AgNO3溶液以50 μ s-1的速度逐滴添加到烧杯中。 最后, 为了从银纳米线中分离出过量的PVP, 将悬浮液用乙醇(比例为1:10)稀释, 并以4 000 r· min-1离心, 直至上清液透明, 将产物分散在乙醇中并在室温下储存以进行谱学分析。
1.2.2 样品
配制浓度为1.0× 10-3 mol· L-1的吲哚美辛、 L-Cys和BSA溶液, BSA溶液用pH=7.4的Tris-HCl缓冲溶液定容, 用盐酸和氢氧化钠调节pH。 测定拉曼光谱和表面增强拉曼光谱。 L-Cys@Ag的制备: 取适量的L-Cys和Ag置于试管中超声振荡后, 置于室温下存储备用。 L-Cys@Ag修饰的BSA溶液的制备: 取适量L-Cys和Ag溶液于试管中加入适量的BSA溶液置于磁力搅拌器上搅拌30 min。
拉曼光谱的参数设置为: Nd:YAG激光光源(1 064 nm), 激光功率为200 mW, 积分时间100 s, 每次扣除暗电流, 扫描范围4 000~400 cm-1。
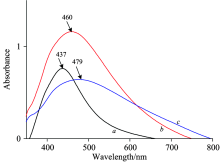
紫外吸收光谱(如图1)显示, 银纳米的最大紫外吸收为437 nm, 加入L-Cys后, 吸收峰红移至460 nm, 这是由于金属颗粒之间的偶极-偶极相互作用以及L-Cys的均匀吸附而导致纳米银的化学环境的变化[2]。 加入BSA后, 吸收峰继续红移至479 nm, 表明BSA已包裹。 最后, 加入吲哚美辛, 最大吸收峰从479 nm蓝移到317 nm(如图2), 表明吲哚美辛已成功组装到L-Cys@Ag基底上。 图3为所制备的银的SEM图, 结果显示, 纳米线具有更大的比表面积, 也具有更多的吸附活位, 实验结果表明采用银纳米线将会对拉曼光谱具有更好的增强效果。
 | 图2 为吲哚美辛在BSA@L-Cys@Ag上的紫外吸收光谱Fig.2 UV-Vis absorption spectra of indomethacin adsorbed on the BSA@L-Cys@Ag substrate |
如图4(A)所示, 445, 537, 1 344, 1 347, 1 394和1 429 cm-1为L-Cys的羧基特征峰, 根据文献对L-Cys的拉曼峰进行归属[17], 693 cm-1处的尖峰为C— S的伸缩振动。 SRES光谱表明当L-Cys和钠米银相互作用后445和537 cm-1消失并且693 cm-1随着pH的增加发生红移。 证明L-半胱氨酸的S— H键被破坏, Ag— S键形成[5]; 表明L-Cys成功地吸附在纳米银基底上。 C— COO-拉曼位移随着碱性的增强逐渐从1 004 cm-1变为893, 894和810 cm-1, 拉曼强度由弱至中等, 这表明在碱性条件下羧基易失去氢, 羧基氧与钠米银表面之间形成离子键。
如图4(B)所示1 003, 758, 761和1 657 cm-1分别归属于固体BSA的C— NH2的伸缩振动, S— S的伸缩振动, O— C=O的不对称伸缩振动和酰胺Ⅰ 谱带。 酰胺Ⅰ 谱带为BSA的α -螺旋结构的特征谱带, SERS中酰胺Ⅰ 谱带在酸性环境下消失, 表明该条件使BSA变性不以α -螺旋结构为主。 中性和碱性情况下, L-Cys @Ag未使BSA变性, 适用于生物学分子的研究。 898, 1 056和1 343 cm-1归属于C— NH2的伸缩振动和N— H伸缩振动, 这些特征谱带属于苯丙氨酸和酪氨酸, 因此BSA的SERS能反映分子侧链氨基酸残基的信息。 1 295 cm-1为O— C=O的不对称伸缩振动[16], 1 463 cm-1为酰胺Ⅱ 特征谱带, 说明BSA部分氨基酸裸露于表面, 并且以NH2而不是N
吲哚美辛与L-Cys@Ag的吸附过程中[如图4(C)、 表1], 1 292和1 395 cm-1消失同时苯环的C— H和C— C的拉曼位移随着碱性的增强呈现红移趋势且拉曼峰强度增大, C=C伸缩振动的出现表明半胱氨酸中的氨基与吲哚美辛中的羧基氧、 苯环中的π 电子发生吸附, 整体能量下降, 使结构更加稳定。 对比BSA的SERS, 加入吲哚美辛后[如图4(E)和表2], C— NH2伸缩振动明显红移, 酰胺Ⅱ 谱带出现。 酸性条件下SERS信号强度明显减弱。 中性和碱性条件下, 苯环和吲哚环的特征峰振动消失, 表明吲哚美辛的苯环和吲哚环进攻BSA的氨基后, 使得特征振动消失, 但是吲哚美辛中的氮, 羰基与BSA中氨基结合, 使C— N和— COO-的SERS信号稳定。 推测吲哚美辛的羧基可增加其水溶性, 同时其苯环和吲哚环与某些酶或者蛋白质的结合导致蛋白结构被破坏, 抑制相关酶的合成, 从而达到缓解疼痛的目的, 同时也由于破坏酶结构导致副反应的产生。
| 表1 吲哚美辛吸附在不同环境下的L-Cys @Ag的拉曼位移及其归属 Table 1 Vibration modes observed by SERS spectroscopy in indometacin absorb on L-Cys@Ag at different pH |
| 表2 不同环境下吲哚美辛与BSA@L-Cys@Ag的 拉曼位移及其归属 Table 2 Vibration modes observed by SERS spectroscopy in admixture at different pH |
联合紫外和拉曼光谱及其在L-Cys修饰的纳米银的SERS, 快速、 简单、 有效、 全面的建立了吲哚美辛的光谱图, 揭示了SERS变化。 利用L-Cys修饰的纳米银, 结合酸碱条件分析了吲哚美辛与L-Cys和BSA的作用方式, 同时模拟吲哚美辛和蛋白质的初步作用, 探讨吲哚美辛的镇痛机理。 为将来改良吲哚美辛及非淄体消炎药的结构和开发新药物的深入研究和鉴别, 提供了一个可能的和简便的分析方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|