作者简介: 李振, 1997年生, 河北农业大学农学院硕士研究生 e-mail: 3213686427@qq.com
黄酮是影响花生籽仁营养价值的重要指标, 常用的分光光度法及色谱法测定黄酮含量费时费力, 不适于育种过程中大批量的检测。 构建其近红外测定模型可为快速检测籽仁黄酮含量提供重要的技术保障。 该研究以290份不同黄酮含量的花生种质为材料, Al3+显色法测定的黄酮含量在46.96~140.18 mgRT(RT: rutin)·(100 g)-1之间。 使用瑞典波通DA7250型号的近红外分析仪(950~1 650 nm)扫描和采集花生籽仁的近红外光谱值, 选用全波长光谱范围内偏最小二乘回归法(PLSR), 对比单一和复合不同的预处理方法, 比较不同模型的相关系数和误差来预测最佳模型, 确定黄酮含量近红外光谱定标模型的最佳光谱预处理方法为“Savitzky-Golay Derivative+Baseline+De-trending”, 校正集相关系数( Rc)为0.884, 标准误差(RMSEC)为4.998。 模型构建过程中, 采用含有Savitzky-Golay Derivative的组合光谱预处理方法可以显著提高模型预测的相关系数。 利用50份花生样品对该模型进行外部验证, 预测的相关系数 Rp为0.904, 而预测的均方根误差RMSEP为1.122。 本研究所构建的近红外光谱模型能够无损、 高效的测定花生籽仁中的黄酮含量, 为选育高黄酮含量的花生品种奠定基础, 并为μg·g-1级物质含量的近红外模型构建提供借鉴。
Flavonoid is an important index affecting the nutritional value of peanut seed. The spectrophotometry and chromatography to detect flavonoid content are time-consuming and labor-intensive, so they are not suitable for mass detection in breeding process, and constructing its near-infrared measurement model can provide an important technical guarantee for rapid detection of flavonoid content in peanut seed. This study used 290 peanut germplasms with different flavonoid content to construct the model. The flavonoid content determined by the Al3+ chromogenic method was between 46.96 and 140.18 mg RT(RT: rutin)·(100 g)-1. The near-infrared spectrum of peanut seed was scanned and collected by Perten DA7250 near-infrared analyzer (950~1 650 nm). The partial least squares regression (PLSR) in the full wavelength spectrum range was used to compare the single and compound pretreatment methods, and the correlation coefficients and errors of different models were compared to predict the best model. The best spectral pretreatment method to determine the NIR calibration model of flavonoid content was “Savitzky-Golay derivative+baseline+de-trending”. The correlation coefficient ( Rc) of calibration set was 0.884, and the root mean square error (RMSEC) of correction was 4.998. 50 peanut samples verified the model. The predicted correlation coefficient Rp was 0.904, while the predicted RMSEP was 1.122. The near-infrared spectroscopy model constructed in this study can be used to determine the content of flavonoids in peanut seeds non-destructively and efficiently. It could be effectively used to breed peanut varieties with high flavonoid content and can help construct near-infrared spectroscopy models of substances with low content (μg·g-1).
花生(Arachis hypogaea L.)是起源于南美洲的异源四倍体(AABB)经济作物, 近年来中国花生年产量已达到全球最高, 占到了世界总产量约40%, 其籽仁中含有蛋白质、 蔗糖、 维生素E、 白藜芦醇、 黄酮等多种营养保健成份[1, 2]。 黄酮是花生籽仁中重要的功能性成份, 具有抗菌、 抗癌、 消除自由基、 抗氧化、 降血糖、 保护中枢神经等多种功能, 直接影响花生的经济价值, 其含量逐渐引起了消费者的重视[3]。 有研究表明不同种质花生籽仁黄酮含量具有差异。 Chukwumah等[4]利用分光光度法测得27份花生种质的黄酮含量为27.6~139.9 mg CE· (100 g)-1(每100 g花生中黄酮含量), 平均黄酮含量为56.4 mg CE· (100 g)-1。 Mondal等[5]使用紫外分光光度计, 结合氯化铝法, 以儿茶素为标准品, 测得来自VG9514和TAG24杂交的包含121个自交系的RIL群体花生籽仁在两年环境下的黄酮含量分别为11.00~50.19和7.08~50.19 mg CE· (100 g)-1, 平均含量为24.00 mg CE· (100 g)-1。 Wang等[6]利用高效液相色谱法检测美国花生种子黄酮含量, 两年平均含量分别为13.82和33.64 mg· (100 g)-1。 Hou等[1]测定河北省57份花生种质, 黄酮含量为39.00~453.00 mg RT/100 g· FW, 最大值比最小值高11.6倍。 筛选、 培育高黄酮含量的花生种质以满足市场对功能化食品的需求是花生品质育种的重要方向, 黄酮含量的高效测定是推进高黄酮含量花生育种的关键。
花生黄酮含量测定有比色法、 高效液相色谱法、 酶标仪微量法[7], 这些方法操作复杂、 费时费力、 成本高、 有一定破坏性, 不利于大批量筛选种质的育种研究。 近红外检测技术具有非破坏性、 成本低、 高效、 快速等优点, 已经在水稻、 大豆、 玉米、 马铃薯、 小麦等多个农作物育种过程中得到了广泛的使用[8, 9, 10, 11, 12]。 很多学者在花生种子含水量、 蛋白质含量、 含油量、 亚油酸、 蔗糖、 脂肪酸、 氨基酸、 棕榈酸、 芥酸、 维生素E等成份含量测定成功建立了多个近红外模型[13, 14, 15, 16, 17, 18]。 由于花生籽仁黄酮含量在μg· g-1级水平, 黄酮含量近红外检测模型的研究进展比较缓慢。 随着近红外仪光谱范围变宽, 光谱值处理方法的改进, 针对μg· g-1含量的物质近红外快速测定模型也相继建立[15, 19]。
为了更深入研究近红外光谱分析技术在检测花生黄酮含量的应用, 本研究利用290份不同黄酮含量的花生样品, 使用近红外仪采集其近红外光谱值, 酶标仪微量法测定其黄酮含量, 并通过结合适宜的光谱值处理方法构建了花生黄酮含量近红外检测模型, 建立了快速测定花生籽仁黄酮含量的方法, 该模型的应用将推动高黄酮含量花生品种选育研究及花生品质鉴定工作。
选用以四粒红和冀农黑3号为亲本衍生的重组自交系群体和美国微核心种质共290份试验材料。 并在本实验室资源库中随机选取50份花生品种做外部验证。 所用到的种子分别为2020年9月和2021年9月收获于河北省河北农业大学清苑试验基地。
所使用的光谱数据在瑞典波通DA7250近红外分析仪(DA7250 Diode Array Analyzer)的Simplicity TM软件上进行采集, 参见文献[16]。 使用漫反射光谱, 在950~1 650 nm光谱范围内进行扫描, 样品扫描前于恒温约25 ℃至少放置48 h, 以减少环境温度对样品的影响, 采集时环境温度在24~25 ℃。 仪器开机后预热30 min, 在各种花生材料中选取均匀饱满的种子放入样品杯, 使表面平整。 样品扫描5次, 重复扫描3次, 取平均光谱值建立模型。
花生籽仁总黄酮含量测定参照Hou等[1]的方法。 花生样品采集光谱后称取样品100 mg于2 mL离心管中, 使用JXFSTPRP-24(上海净信实业发展有限公司)砸样机粉碎, 石油醚(沸程: 60~90 ℃)反复萃取脱脂3次, 去掉脂肪后的样品在通风橱风干。
使用80%甲醇超声提取。 采用氯化铝比色法, 在510 nm处检测反应物的吸光值。 以芦丁为标准品(RT: rutin), 纯度≥ 98%。 结果以每100 g花生籽仁中含有RT的mg当量值表示, 即mg RT· (100 g)-1。 每个样品测定进行三次生物学重复。
利用化学计量学软件The Unscrambler X10.4来构建模型。 将采集得到的近红外光谱数据和测得的黄酮含量化学值导入The Unscrambler X10.4软件。 由于扫描近红外光谱时容易受到环境等因素的影响, 因此对原始光谱进行预处理使模型的精确度更高。
采用常见的标准正态变量变换、 基准化、 导数法、 去趋势、 S-G平滑法等光谱预处理方法来减少误差和噪声对光谱的影响[16]。 将以上预处理方法分别进行单一和复合处理, 从而选出最优的光谱预处理方法。 采用偏最小二乘回归(partial least squares regression, PLSR)建立定标模型。 自动剔除差距较大的异常样品, 通过比较化学值和预测值的相关系数(R2)和标准误差(RMSE)得到最佳模型[15]。 相关系数高且标准误差小的模型可靠性好。 采用外部交叉验证, 随机选择花生样品, 来评价模型的稳定性。
随机选取50个花生品种, 利用1.3方法检测样品的黄酮含量, 再使用构建的近红外模型分析其黄酮含量, 记录近红外光谱方法的预测值。 比较近红外光谱模型预测值与化学值的相关性。
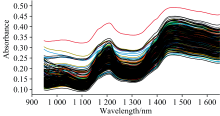
采集的290份花生籽仁光谱值如图1所示。 在950~1 650 nm内吸收峰明显, 趋势大致相同, 吸收特征一致, 每个样品存在多处吸收峰, 各个花生样品的吸收峰强度有差异, 表明它们之间含量有所不同。 说明该试验的近红外光谱数据有助于进行花生籽仁黄酮含量的定量分析。
290份花生籽仁中黄酮含量的样品化学值测定结果如表1所示。 黄酮含量在46.96~140.18 mg RT· (100 g)-1之间, 平均值为91.37mg RT· (100 g)-1, 标准差为15.97, 变异系数为17.48%。 结果表明本试验选择的花生样品黄酮含量范围广, 差异大, 可用来近红外光谱定标预测。
| 表1 花生籽仁黄酮含量的化学测定结果 Table 1 Chemical determination results of flavonoid content in peanut seeds |
2.3.1 光谱预处理方法的选择
为了去除光谱的影响因素, 可以从中获得大量与化学组成有关的信息, 将其按平滑处理、 标准正态变量变换、 导数法、 去趋势、 基准化法等进行了单一以及复合的预处理。 所采用的预处理方法及结果见表2和表3, 筛选出最佳的预处理方法为Savitzky-Golay Derivative、 Baseline 和De-trending。 Savitzky-Golay Derivative是卷积平滑和导数法的结合, 卷积平滑是移动平均平滑的方法, 在平滑中先对窗口内的所有波谱点加以最小二乘拟合, 再对所有观测数据都加上平均平滑系数, 从而降低了对有用数据的干扰, 导数法能够减少因背景噪声或基线漂移所产生的影响, 分辨重叠峰, 从而增加了光谱灵敏度和分辨率。 Baseline通过消除基线漂移, 达到基线校正。 De-trending从原始光谱中去掉趋势线, 以去除漫反射光谱中的基线漂移。 三种方法的结合提高了预测相关系数, 该研究结果可为构建谷物中μg· g-1级含量的次生代谢物近红外测定模型提供参考。
| 表2 不同光谱预处理对黄酮模型的影响 Table 2 Results of flavonoid model with different spectral pretreatment methods |
| 表3 花生籽仁黄酮含量光谱值的最佳预处理方法及预测模型 Table 3 Optimal pretreatment method and prediction model of spectral value of flavonoid content of peanut seed |
2.3.2 花生籽仁黄酮含量定标模型的构建与验证
对花生籽仁中黄酮含量的化学值和预处理后的光谱数据进行拟合, 结合偏最小二乘回归法分析法(PLSR)建立数学模型。 PLSR是一个经典的线性建模方式, 描述了含量值与光谱信息之间的最大协方差。 对比其他线性回归方法, 具有充分获得样品信息等优势, 使模型更加可靠[20]。
通过比较模型的相关系数(R2)和标准误差(RMSE)分析定标模型, 筛选出最佳模型。 本研究剔除37份异常值, 经比较种皮颜色, 剔除样品的种皮颜色为深粉或浅粉色, 可见, 颜色是影响光谱值的重要因素。 不同种皮颜色花生糖含量近红外测定模型构建也做出了说明[15]。 本模型适合粉色种皮花生籽仁黄酮含量的预测, 其他颜色籽仁黄酮含量的预测模型有待进一步研究。 随机选择50份粉色种皮花生品种分别进行化学方法测定和近红外分析, 作为外部验证集。 校正模型的相关系数如表2和图2(a, b)所示, 相关系数为0.884, 对已建立模型进行了外部验证[图2(a, b)], 预测值与化学值之间的相关系数为0.904, 同时计算出化学值与预测值之间的偏差, 偏差范围为-7.34~6.99 mg· (100 g)-1。 结果表明, 所构建的模型能够进行有效预测, 可用于花生黄酮含量的快速鉴定。
 | 图2 花生籽仁黄酮含量的校正模型(a)及预测模型(b)Fig.2 Correction model (a) and prediction model (b) of peanut seed flavonoid content |
近年来, 花生的品质性状以及改良日益成为科学研究的重点, 对这些指标的化学测定也往往费时费力, 从而促进了近红外光谱在花生品质改良中的广泛应用。 目前在国内, 通过不同的近红外光谱仪型号已形成了多种花生品质性状的近红外光谱模型[14]。 花生籽仁中的黄酮是一种含量比较低的功能性成份, 越来越受到人们的重视, 但由于其含量低, 测定方法繁琐, 对近红外光谱模型的需求大。 本研究通过选用大量的黄酮含量差异大的种质、 改进光谱值预处理方法构建了花生黄酮含量的近红外光谱测定模型, 可以快速、 无损地检测花生籽仁的黄酮含量, 为培育高黄酮含量花生品种提供了高效表型鉴定方法。
利用近红外光谱数据结合偏最小二乘法(PLSR)构建了花生籽仁黄酮含量的近红外光谱模型, 校正集的相关系数为0.884, 验证样品集的相关系数为0.904。 可以预测花生籽仁黄酮含量。
本研究所构建的黄酮模型可与同款机型上已有的脂肪酸、 亚油酸、 油酸、 蛋白质、 总糖可溶性糖、 蔗糖等模型可快速、 准确、 无损的综合评价花生基因型的品质, 为高通量花生品质相关性状鉴定研究提供了技术支撑。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|