作者简介: 王健敏, 女, 1997年生, 浙江工业大学药学院硕士研究生 e-mail: 1901260451@qq.com
鼻黏液是影响疫苗和药物经鼻吸收的首要屏障。 由于干扰因素复杂多变, 在体评价黏液渗透性较难实施, 多采用体外评价。 现有的药物鼻黏液渗透性检测方法如细胞模型法、 多粒子示踪技术等, 存在细胞培养周期长、 操作繁琐、 成本高、 可获得信息少且需要进行荧光标记等不足, 对鼻黏膜制剂的体外评价具有很大的局限性, 因此迫切需要建立一种快速、 简便、 灵敏的鼻黏膜制剂黏液渗透性评价方法。 基于衰减全反射-傅里叶红外光谱(ATR-FTIR)对药物结构以及粘蛋白二级结构变化的敏感性, 利用其对不同性质(粒径与电荷)脂质体的鼻黏液渗透性进行研究, 通过FTIR 图谱分析不同脂质纳米粒与黏液中粘蛋白的相互作用, 建立了鼻黏膜制剂黏液渗透性的体外评价方法。 方法学研究表明, 对于聚乙二醇10000(PEG10000)、 壳聚糖、 海藻酸钠脂质体, 该方法线性关系分别为 Y=2.386 6 X+2.154、 Y=1.870 3 X+0.278 9、 Y=1.130 14 X+0.060 9, 线性相关系数分别为0.995 8、 0.994 5、 0.990 9, 精密度RSD值分别为0.62%、 0.73%、 0.95%; 重复性试验中RSD值分别为0.83%、 0.97%、 0.88%, 说明该方法线性关系良好、 精密度高、 重复性好, 可用于体外评价药物制剂在黏液中的渗透性。 研究结果表明, 利用ATR-FTIR在不同时间内扫描样品可得到不同脂质体制剂样品的强度增加的吸收带。 对于不同粒径PEG脂质体而言, 粒径越小其黏液渗透性越强; 对于不同电荷脂质体而言, 壳聚糖脂质体黏液渗透性最弱, 海藻酸钠次之, PEG脂质体黏液渗透性最强。 进一步研究表明, 不同电荷脂质体黏液渗透性的差异源于其与粘蛋白相互作用, 该结论可通过分析粘蛋白酰胺Ⅰ带所包含的各二级结构信息得到。 综上, 基于ATR-FTIR所建立的体外评价方法灵敏简便, 可作为多种不同制剂的鼻黏液渗透性的快速测定, 经改进后还可用于药物制剂在其他黏液中的渗透性评价, 应用前景广阔。
Nasal mucus is the primary barrier affecting the nasal absorption of vaccines and drugs. In vivo assessments are difficult to perform due to the complexity and variability of the confounding factors, whereas in vitro evaluations are mostly used. The existing in vitro assays for monitoring nasal mucus permeability of drugs, such as cell model assays and multiparticle tracer techniques, have the disadvantages of a long cell culture cycle, cumbersome operation, high cost, little available information, and the need for fluorescent labelling, which have great limitations for the in vitro evaluation of nasal mucosal formulations. Therefore, there is an in urgent need to establish a rapid, simple and sensitive method for the evaluation of mucus permeability of nasal mucosal formulations. Based on the sensitivity of ATR-FTIR spectroscopy to changes in drug structure and mucin secondary structures, the nasal mucus permeability of liposomes, typical lipid nanoparticles, with different properties (particle size and charge) was studied in this paper, and the interaction of different liposomes with mucin in mucus by FTIR spectra to establish an in vitro evaluation method for mucus permeability of nasal mucosal preparations. Methodological studies showed that for PEG10000, chitosan, and sodium alginate liposomes, the linear relationships of the method were Y=2.386 6 X+2.154, Y=1.870 3 X+0.278 9, Y=1.130 14 X+0.060 9, the linear correlation coefficients were 0.995 8, 0.994 5, 0.990 9, and the precision RSD values were 0.62%, 0.73%, and 0.95%, respectively; the RSD values in the repeatability experiment were 0.83%, 0.97%, and 0.88%, respectively. It is indicated that the method has a good linear relationship, high precision, and good repeatability and can be used to evaluate the permeability of pharmaceutical preparations in mucus in vitro. The results showed that the sample absorption bands with increasing intensity of different liposome formulations could be obtained by scanning the samples at different times in interaction with mucus using ATR-FTIR. For PEG liposomes with different particle sizes, the smaller the particle size, the stronger the mucus permeability; for liposomes with different charges, chitosan liposomes with positive charges have the weakest mucus permeability, followed by sodium alginate and PEG liposomes have the strongest mucus permeability. Further studies have shown that the difference in mucus permeability of liposomes with different charges stems from their interaction with mucins, and this conclusion can be obtained by analyzing the information on each secondary structure (α-helix, β-sheet, β-turn, irregular turn) contained in the mucinamide Ⅰ band (1 600~1 700 cm-1). In summary, the in vitro evaluation method established in this paper based on ATR-FTIR is sensitive and simple and can be used as a rapid assay of nasal mucus permeability for various preparations. And with improved applicability, it can also be used to evaluate the permeability of pharmaceutical preparations in other mucus, which has a broad application prospect.
经鼻递送对于流感或新冠疫苗等的针对呼吸系统病毒感染的预防具有重要应用价值[1, 2], 鼻腔给药时高度血管化和相对容易渗透的表面, 可绕过胃肠道的酸和酶降解以及肝脏首过代谢, 鼻黏膜的良好血液循环使药物吸收迅速, 可产生快速的局部作用或全身作用[3], 使得鼻腔途径给药成为注射和口服等传统给药方式的很好补充和备选, 近年来已越来越受到人们的关注。
药物经鼻给药时, 必须面临黏膜上皮存在的复杂的黏液屏障。 黏液是复杂的生物聚合物屏障, 其主要功能包括润滑上皮, 维持水合层, 与底层上皮交换气体和营养物质, 以及作为病原体和异物的屏障。 粘蛋白是该屏障的主要功能成分, 可通过二硫键形成高密度粘蛋白纤维网络结构, 平均孔径在200~300 nm, 允许水、 气体、 营养物质等小分子通过, 但同时也可减少分子和颗粒的渗透以及扩散速率, 因此当药物制剂大于网孔时易发生空间位阻效应[4]。 此外, 药物制剂与粘蛋白的分子间相互作用也是影响药物在黏液中扩散的因素, 该作用受多种因素影响, 如制剂所带电荷、 亲疏水性等。 鉴于黏液的保护与清除异物功能, 研究外物分子在其中的扩散具有生理病理学和生物药剂学意义, 是药物制剂设计时需要考量的药物能否有效进入黏膜的重要因素。 然而, 在体方法研究药物在鼻黏液中的渗透与转运过程较为繁琐, 受干扰因素多[5], 难以对其进行量化分析, 迫切需要建立有效的体外评价方法对鼻黏膜制剂进行处方工艺优化与生物药剂学评价。
非破坏性的、 无需标记、 可实时提供与药物结构相关数据的衰减全反射傅里叶变换红外光谱(attenuated total reflectance-Fourier transform infrared spectroscopy, ATR-FTIR)技术, 早已成功应用于物质结构的分析研究[6], 但尚未见以此作为物质在黏液中的渗透性评价的报导。 为在体外探究药物制剂的不同表面性质对其黏液渗透性的影响, 本工作探索采用该技术对所制备的不同性质(即粒径与电荷)的脂质体的黏液渗透性进行检测, 并通过分析粘蛋白酰胺Ⅰ 带(1 600~1 700 cm-1)所包含的二级结构(α -螺旋、 β 折叠、 β -转角、 无规则卷曲)信息, 对不同性质脂质体与粘蛋白的相互作用进行研究, 分析建立适用于药物制剂黏液渗透性评价的非在体方法。
78HW-1恒温数显磁力搅拌器(杭州仪表电机厂), LDB-M 微量注射泵(定山仪器厂), JY92-IIN 超声波细胞粉碎机(宁波新芝生物科技股份有限公司), Nano ZS90纳米粒径电位分析仪(马尔文仪器有限公司), LE-1膜挤出器(楚业生物科技有限公司), ZF-Ⅰ 紫外分光光度计(上海顾村光电仪器厂), NicoletTMiS50傅里叶变换红外光谱仪(Thermo Fisher 公司), Transwell小室(NEST 公司)。
大豆卵磷脂(湖北健文生物有限公司), 胆固醇(上海伯奥生物科技有限公司), 牛血清白蛋白(北京索莱宝科技有限公司), 粘蛋白(北京谨明生物科技有限公司), 聚乙二醇10000(polyethylene glycol 10000, PEG10000, 上海展云化工有限公司), 壳聚糖(上海蓝季生物), 海藻酸钠(温州吉象化学股份有限公司), 无水乙醇(杭州双林化工试剂厂)。
1.2.1 ATR-FTIR光谱法定量测定方法学的建立
(1)光谱采集
在ZnSe的液体衰减全反射样品池中分别加入PEG10000、 壳聚糖、 海藻酸钠溶液, 使用配备有水平ATR晶体(ZnSe, 45° )的NicoletTM iS50 FTIR扫除背景后, 在波数4 000~400 cm-1内扫描并采集红外光谱数据, 扫描次数为32次, 仪器的分辨率是4 cm-1。
(2)标准曲线的绘制
分别称取PEG配制成1%~20%, 壳聚糖配制成0.1%~1.0%, 海藻酸钠配制成0.1%~1.0%(均为w/v)浓度的系列标准液, 按光谱采集方法测定其吸光度。
(3)重复性考察
取同一批溶液6份, 按上述方法测定含量, 计算指定峰面积, 得到其RSD值。
(4)精密度考察
吸取同一供试品溶液, 重复扫描5次, 测定指定峰面积, 计算其RSD值。
(5)脂质体的制备
包载牛血清白蛋白(bovine serum albumin, BSA)的脂质体纳米粒采用乙醇注入法[7]制备, 将其以恒定流速分别注入 4%(w/v)PEG10000、 0.4%(w/v)壳聚糖、 0.4%(w/v)海藻酸钠溶液中, 孵育30 min实现后修饰。 不同粒径PEG脂质体通过改变胆固醇与大豆卵磷脂质量之比、 超声时间、 PEG浓度以及水相与有机相体积之比来制备。
(6)脂质体表征
用纳米粒度分析仪测定不同电荷与粒径脂质体的粒径分布及Zeta电位; 采用超速离心结合考马斯亮蓝法测定脂质体包封率。
(7)BSA标准曲线的绘制
配制0.01、 0.02、 0.03、 0.04、 0.05、 0.06 mg· mL-1系列BSA溶液, 准确吸取1 mL 标准液, 加入5 mL考马斯亮蓝溶液, 在595 nm波长处测定吸光值, 以蛋白浓度对吸光度进行回归分析。
1.2.2 不同粒径与电荷脂质体渗透性测定
(1)ATR-FTIR法
以粘蛋白配制的模拟鼻黏液[8]为背景扫描后, 加入150 μ L供试品溶液, 在一定时间点下对样品进行扫描, 收集其FTIR谱图, 计算不同粒径PEG脂质体和不同电荷脂质体的黏液渗透性。 以表观渗透系数(Papp, cm· s-1)衡量, 计算公式如式(1)
式(1)中, dQ/dt是脂质体的扩散速率; c0为脂质体的初始浓度; A为渗透面积(cm2)。
(2)Transwell法
在12-Transwell板的受体室各添加1.5 mL磷酸盐缓冲液(0.01 mol· L-1, pH 7.4), 将 50 μ L模拟鼻黏液均匀铺在聚碳酸酯膜上, 分别添加测试样品到各自供体室后, 35 ℃孵育, 定时从受体室中取出等分试样, 并用等体积的缓冲液替换, 对每个收集的样品进行测定, 计算其表观渗透系数[9], 判断脂质体的跨黏液层运输。
(3)不同电荷脂质体与粘蛋白溶液相互作用
将粘蛋白溶液添加到ATR-FTIR光谱仪的ZnSe晶体池, 而后将等体积的不同处方脂质体添加至粘蛋白溶液中。 孵育30 min后, 记录ATR-FTIR光谱。 未处理的粘蛋白作为阴性对照。
如图1所示, PEG10000、 壳聚糖和海藻酸钠标准液的ATR-FTIR光谱图中, 分别在1 080、 1 048和1 049 cm-1出现一个明显的单峰, 并且随浓度变化最为明显, 故选择这三个单峰作为特征峰。
2.2.1 线性关系考察
如图2所示, 分别以PEG10000、 壳聚糖、 海藻酸钠浓度为横坐标(X), 所对应的红外特征峰吸收峰面积为纵坐标(Y)作标准曲线。 得到回归方程分别为: Y=2.386 6X+2.154, R2=0.991 6; Y=1.130 14X+0.060 9, R2=0.997 4; Y=1.870 3X+0.278 9, R2=0.992 7。 表明PEG10000、 壳聚糖、 海藻酸钠分别在2%~20%(w/v), 0.1%~1.0%(w/v), 0.1%~1.0%(w/v)的范围内呈现出良好的线性关系。
 | 图2 (a) PEG10000标准曲线图; (b) 壳聚糖标准曲线图; (c) 海藻酸钠标准曲线图Fig.2 (a) PEG10000 standard curve; (b) Chitosan standard curve; (c) Sodium alginate standard curve |
2.2.2 重复性考察
PEG脂质体、 壳聚糖脂质体、 海藻酸钠脂质体的供试品溶液的峰面积RSD值分别为0.83%、 0.97%、 0.88%, 表明该方法的重复性较好。
2.2.3 精密度考察
结果表明, 6次测定的PEG脂质体、 壳聚糖脂质体、 海藻酸钠脂质体的特征峰峰面积RSD 值分别为0.62%、 0.73%、 0.95%, 表明该方法的精密性很好。
2.3.1 不同粒径与电荷脂质体的表征
不同粒径脂质体的表征结果见表1。
| 表1 不同粒径 PEG 脂质体的表征(n=3) Table 1 Characterization of PEG liposomes with different particle sizes (n=3) |
不同电荷脂质体表征结果见表2。
| 表2 不同电荷脂质体的表征(n=3) Table 2 Characterization of liposomes with different charges (n=3) |
由表1和表2可知, 不同电荷与粒径脂质体大多粒径分布较为均匀[多分散系数(polydiseperse Index, PDI)< 0.3], 电荷的变化、 脂质体渗透的FTIR谱图(见下文)与不同脂质体特征峰的对应说明了不同脂质体表面的成功修饰[10, 11]。
2.4.1 BSA标准曲线绘制
以BSA浓度c为横坐标, 吸光度A为纵坐标绘制标准曲线, 得到标准线方程: Y=6.177 1X-0.002 2, R2=0.997 6, 结果表明, BSA在0.01~0.06 mg· mL-1浓度范围内线性关系良好。
2.4.2 脂质体包封率
不同粒径和电荷脂质体包封率见图3。
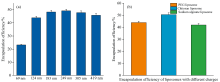 | 图3 (a) 不同粒径PEG脂质体的包封率; (b) 不同电荷脂质体的包封率Fig.3 (a) Entrapment efficiency of PEG liposomes with different particle sizes; (b) Entrapment efficiency of liposomes with different charges |
由图3(a)知, 不同粒径脂质体中69 nm的PEG脂质体包封率最低, 是由于较小的粒径显着限制了其药物有效载荷承载能力; 由图3(b)知壳聚糖脂质体包封率高于PEG脂质体和海藻酸钠脂质体, 可能的原因是由于脂质体表面电荷的影响, 壳聚糖和BSA之间的静电吸引力, 使得药物渗漏减小, 而海藻酸钠与BSA所带电荷相反, 由于静电排斥, 使得药物从脂质体中渗漏, 故其包封率低于壳聚糖和PEG 脂质体[11, 12]。
2.5.1 ATR-FTIR法
2.5.1.1 不同粒径PEG脂质体黏液渗透性测定
如图4所示为不同粒径脂质体添加到黏液层后, 获得的不同时间点下PEG脂质体的ATR-FTIR光谱。
如图4所示, 当与黏液接触时, 随着脂质体渗透并到达ZnSe界面, FTIR 光谱出现强度逐渐增加的样品吸收带。 可以初步看出, 随着粒径的增大, PEG 脂质体的ATR-FTIR在1 080 cm-1处吸收强度逐渐减小, 说明PEG脂质体渗透至ATR的ZnSe表面的量逐渐减少, 可能是由于黏液的孔径对大粒径脂质体的排阻作用。 不同粒径PEG脂质体的渗透系数见图8(a)。
2.5.1.2 不同电荷脂质体黏液渗透性测定
由图5可知, 不同电荷脂质体中, 近中性电荷脂质体黏液渗透性最高, 正电荷脂质体黏液渗透性最低。 由于PEG脂质体为电中性, 其与黏液的相互作用最小, 而海藻酸钠脂质体与壳聚糖脂质体会由于其所带的—COOH基团(前者)及与粘蛋白中带负电荷的唾液酸残基发生静电相互作用(后者)[13], 因而二者黏液渗透性低于PEG化脂质体。 不同电荷脂质体的渗透系数见图8(b)。
2.5.1.3 不同电荷脂质体与粘蛋白相互作用测定
如图6(a)所示, 粘蛋白的ATR-FTIR光谱有两个显著特征峰, 分别位于1 600~1 700和1 500~1 560 cm-1, 是粘蛋白蛋白质核心的特征, 主要归因于酰胺Ⅰ 的羰基C=O伸缩振动和酰胺Ⅱ 带的胺(C—N)伸缩振动。 结合图6(a)、 (b)可看出, 与空白组相比, PEG脂质体对粘蛋白的结构作用最小, 因PEG脂质体具有亲水性和接近中性电荷的表面, 可通过减少疏水性或静电相互作用来最大程度地减少与粘蛋白的相互作用, 从而增强纳米粒子的黏液渗透[14]。 其次为海藻酸钠脂质体, 其与粘蛋白的相互作用基于与后者聚合物链的相互渗透, 由于与粘蛋白带相同电荷, 海藻酸钠脂质体与粘蛋白产生静电排斥, 可能导致聚合物链的展开并促进链缠结和氢键的形成[15, 16, 17]。 对粘蛋白结构改变最大的是壳聚糖脂质体, 因为阳离子壳聚糖可以与粘蛋白中唾液酸的负电荷产生静电相互作用, 也可能是由壳聚糖的—NH2和粘蛋白中唾液酸的—COOH之间的氢键结合引起的[18]。
ATR-FTIR已被证明对蛋白质二级结构尤其敏感, 是获取有关蛋白质构象信息的强大技术之一。 酰胺Ⅰ 带对于研究蛋白质二级结构最有价值, 该振动频率受α -螺旋、 β -折叠、 β -转角和无规则卷曲的影响[19]。 利用Origin 2022b对粘蛋白与不同脂质体作用前后的酰胺Ⅰ 带进行二阶求导和Gaussian去卷积化处理, 其结果如图7所示, 根据积分面积计算粘蛋白二级结构各组分的相对百分含量, 见表3。
| 表3 不同电荷脂质体处理粘蛋白后蛋白质二级结构的含量 Table 3 Protein secondary structure content of mucin after treatment with different charged liposomes |
结合图7和表3可知, 未经处理的粘蛋白二级结构主要组成为β -折叠, 占总量的42.59%, α -螺旋为25.83%, 无规则卷曲为27.41%, β -转角含量最低, 为3.93%。 三种脂质体处理后的粘蛋白二级结构发生如下变化: α -螺旋是蛋白质二级结构中最稳定的, 而壳聚糖脂质体对α -螺旋和β -折叠和无规则卷曲的含量改变都较明显, 无规则卷曲含量的增加则表示经壳聚糖脂质体处理的粘蛋白部分有序结构逐渐向无规则卷曲结构转化[20], 证明该脂质体与粘蛋白产生较强的相互作用, 对蛋白质的二级结构有一定的改变; PEG脂质体对粘蛋白二级结构改变相对较小, 其ATR-FTIR谱图变化主要是由于PEG脂质体对C=O和N—H间的氢键作用[21]; 海藻酸钠脂质体对粘蛋白二级结构的改变主要体现在β -折叠含量的增加, 主要原因是蛋白质分子中氨基酸残基与海藻酸钠形成氢键。
2.5.2 ATR与Transwell方法比较
如图8所示, ATR-FTIR和Transwell均可对不同粒径与电荷脂质体的黏液渗透性进行测定, 不同的是, 后者所得出的信息较为局限, 而前者可实时进行测定, 操作简便, 并且能够检测出脂质体与粘蛋白之间相互作用的微小变化, 进而对纳米粒渗透黏液的机制进行阐述。
脂质纳米粒在药物和疫苗的体内递送中具有重要应用价值。 经表面修饰的脂质体在药物体内递送中具有延长半衰期、 增加靶向性、 提高药效等作用, 因而受到广泛重视[22]。 建立了一种针对不同性质脂质体的鼻黏液渗透性的体外评价方法, 即利用ATR-FTIR 在不同时间点对生物基质(即粘蛋白)进行扫描, 得到基质内药物制剂的一系列谱图, 根据药物制剂的化学结构、 谱图中药物特征红外吸收峰的强弱判断药物制剂在粘蛋白中的渗透性。 为进一步评估该方法的有效性, 将ATR-FTIR光谱分析与基于Transwell 室的检测分析对同一纳米药物的跨黏液转运进行对比, 证明了ATR-FTIR在体外评价药物在黏液中渗透性的可行性。 同时, 利用ATR-FTIR初步探索了药物渗透黏液的原理: 通过粘蛋白的微小结构变化, 即其二级结构变化, 检测并分析药物制剂与生物基质所发生的相互作用, 阐明了不同性质脂质体黏液渗透性强弱的机制。
鼻黏液的复杂结构和功能阻碍了颗粒和分子在粘膜中的运输, 是药物通过鼻黏膜上皮进行治疗递送的关键瓶颈。 目前, 用于体外评价鼻黏膜制剂的黏液渗透性有多种方法。 分别为Transwell法[9]、 细胞模型法[22]、 多粒子示踪技术(multiple particle tracking, MPT)[23]等, Transwell法优点在于操作简便, 普适性强, 但是获得的信息较为单一, 对进一步的研究具有局限性; 细胞模型法可用于评价不同药物的黏液渗透性, 但操作繁琐、 细胞培养周期长, 目前体外细胞模型有: Caco-2、 EpiAirway、 犬肾细胞(madin-darby canine kidney cells, MDCK)、 人类原代鼻上皮细胞等。 但是并非所有细胞模型都适用于经鼻给药的渗透性研究, 如MDCK细胞模型与Caco-2、 EpiAirway相比, 其跨膜电阻(trans epithelial electric resistance, TEER)较高, 细胞连接致密, 这将限制药物经细胞旁路途径的吸收, 该模型较适合用于血脑-屏障的研究, 并且, Caco-2肠细胞系是唯一获得FDA批准的评估药物吸收的体外预测模型, 但是Caco-2细胞起源于结肠, 不存在粘液层, 并且肠道与鼻屏障在形态和生理等方面均有较大的差异性, 故对于评价鼻黏膜制剂的黏液渗透性而言, 选择合适的细胞极其重要; MPT法可以动态检测颗粒在生物基质中的运动与相互作用, 但需要对药物进行染色或者标记, 在一定程度上可能改变了药物结构, 对其造成影响, 并且亦无法对药物的渗透机制进行具体的说明。 本工作利用药物制剂的结构特点与ATR-FTIR相结合, 既可定量检测药物在黏液中的渗透, 又可对药物渗透的机制进行分析和解释, 可为后续实验的方向选择和方案调整提供指导。
建立的基于ATR-FTIR的体外评价鼻黏膜制剂的黏液渗透性方法, 与其他方法相比, 不需要对药物进行标记, 因此不会对药物制剂结构造成影响, 简单可靠, 可实时进行检测, 并藉此可获得更丰富的分子间相互作用信息。 除脂质体等脂质纳米粒外, 本方法也可用于其他鼻黏膜制剂的黏液渗透性评价, 如微球、 纳米乳、 纳米凝胶等多种制剂(另文发表); 经适应性改进后, 还可用于药物制剂在其他黏液例如口腔黏液、 下消化道黏液和生殖腔道黏液中的渗透性评价, 应用前景广阔。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|








