作者简介: 龚梦洁, 女, 1997年生, 北京师范大学化学学院硕士研究生 e-mail: Monica_G@mail.bnu.edu.cn
达比加群酯(DE)是一种新型口服抗凝药, 用于预防非瓣膜性房颤患者的卒中和全身性血管栓塞。 达比加群酯本身没有药理活性, 其活性成分是在血浆和肝脏中经酯酶催化水解生成的达比加群(DAB)。 尽管已经被用于临床治疗, 活性成分达比加群的极性基团苯甲脒和羧基在其与凝血酶(Thr)结合时的作用机理仍不清晰, 并且目前还未找到针对达比加群的特定逆转剂。 采用稳态和瞬态荧光光谱、 分子对接模拟等方法研究了DAB与凝血酶在模拟生理条件下的相互作用。 通过研究极性基团酯化前后DAB与凝血酶作用时的时间分辨荧光光谱, 揭示了DAB对凝血酶的荧光猝灭包含动态猝灭和静态猝灭的双重机制, 指出DAB苯甲脒基团与凝血酶之间的静电导向效应是DAB与凝血酶快速有效形成复合物的关键动力学因素。 运用分子对接模拟方法研究了DAB与凝血酶相互作用时的分子构象, 探究DAB极性基团的酯化对两者结合能的影响。 通过比较DAB双极性基团酯化后的达比加群酯(DE)、 DAB羧酸基团酯化后的达比加群乙酯(DAE)、 以及DAB苯甲醚基团酯化后的达比加群己酯(DAH)与凝血酶相互作用的荧光光谱和分子对接模拟结果, 进一步验证了极性基团在DAB与凝血酶结合时的重要作用。 获得了DAB和DE与牛血清白蛋白(BSA)在生理pH条件下相互作用的稳态和瞬态荧光光谱的对照结果, 提出DAB的极性基团在其与凝血酶的选择性结合中发挥重要作用。 研究结果为提高达比加群药物生理活性以及逆转剂的研究提供了理论和实验依据。
Dabigatran etexilate (DE) is a new oral anticoagulant drug used to prevent non valvular atrial fibrillation stroke and vascular embolism. DE itself has no pharmacological activity. Its active component is Dabigatran (DAB), the product of DE by catalyzed hydrolysis in plasma and liver. However, the interaction mechanism between the polar groups of DAB and thrombin is still unclear, especially in physiological conditions, although the drug has already been used for clinical treatment. No specific reversal agent has been found for dabigatran.This work used steady-state and time-resolved fluorescence spectroscopy methods to study the interaction between DAB and thrombin in pH 7.4 phosphate buffer. A combination of dynamic and static fluorescence quenching of thrombin when in contact with DAB wasobserved, suggesting that the electrostatic effect between thrombin and the benzamidine group of DAB was the key factor of a fast and effective formation of the DAB-thrombin complex. The molecular conformation of DAB when in interaction with thrombin was studied by molecular docking simulation and the effect of DAB polar groups on the binding energy was investigated. By comparing the fluorescence spectra and molecular docking simulation results of the interaction between thrombin and dabigatran ester (DE, esterification of both DAB polar groups), dabigatran ethyl ester (DAE, esterification of DAB carboxylic group), and dabigatran hexyl ester (DAH, esterification of DAB benzamidine group), the role of polar groups in the combination of dabigatran and thrombin was further verified. Steady-state and transient fluorescence spectra of DAB and DE interacting with bovine serum albumin (BSA) under physiological pH conditions were also obtained,confirming that the polar groups of DAB play an important role in the selective binding of DAB with thrombin. The results provide theoretical and experimental bases for improving the drug efficiency and finding reversal agents.
抗凝药物在治疗及预防血栓相关的疾病以及心脏和血管支架植入术后治疗中有着十分广泛的应用[1, 2, 3, 4, 5]。 传统抗凝药物非特异性靶向于凝血级联的多个凝血因子, 主要包括肝素、 维生素K拮抗剂等。 这类抗凝药在使用中需要频繁监测凝血情况并实时调整用药剂量, 以防止药物导致的出血风险[1, 2]。 近年来, 直接作用于特定凝血因子、 不需要常规凝血监测的口服抗凝血药物的研究和应用受到了广泛关注[2, 3, 4]。 其中, 达比加群酯(Dabigatran etexilate, DE)是目前新型口服抗凝药中唯一一个直接特异性靶向于凝血级联最后一环凝血酶(Thrombin, Thr)的药物[1, 5]。 达比加群酯本身没有药理活性, 口服后可被迅速吸收, 在血浆和肝脏被羧酸酯酶催化水解为活性成分达比加群[5, 6]。 达比加群药物的口服抗凝效果得到了广泛印证, 近年来被多个国家批准临床使用[7]。 随着药物的使用, 研究达比加群与凝血酶在生理条件下的反应动力学是寻找达比加群特定逆转剂以应对紧急手术或消化道出血等情况的迫切需要[1, 2, 7]。
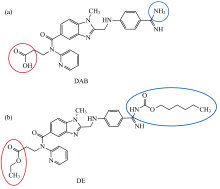
达比加群(Dabigatran, DAB)是一个三取代的苯并咪唑化合物, 分子包含苯甲脒和羧基两个极性基团[图1(a)]。 药理研究显示DAB可直接与凝血酶结合, 阻止其催化纤维蛋白原转化为纤维蛋白的活性, 从而达到抗凝血效果[1, 8]。 为了改善DAB的口服药效, 将其极性基团酯化, 成为其前药达比加群酯DE[5]。
然而, 极性基团在DAB抗凝过程中的作用机制仍存在很大争议。 Hauel等研究了DAB与凝血酶复合物的X射线晶体结构[5], 在DAB的苯甲脒和凝血酶的Asp189之间观察到一个盐桥, 而DAB的羧基与凝血酶没有氢键相互作用, 提出DAB与凝血酶的结合主要是通过疏水相互作用; 另一方面, 药物试验的结果显示, 在DAB的苯并咪唑模板中引入羧基显著提高了药物在体内的活性和抗凝效果。 Naik等研究了DAB与人血清白蛋白、 核糖二氢烟酰胺脱氢酶等人体中其他蛋白及酶的相互作用[9, 10], 提出极性基团提高DAB抗凝血能力的原因可能与增强了DAB与凝血酶结合的特异性有关。 Remko等的理论研究发现, 水对DAB和DE的几何结构有很大影响[11, 12]。 已有的研究结果表明: DAB和凝血酶在生理条件下相互作用的直接研究是探索疏水作用和极性作用在DAB与凝血酶结合过程中的动力学机理的迫切需要。
本工作中, 我们运用稳态和瞬态荧光光谱研究了DAB和凝血酶在模拟生理条件下(pH 7.4磷酸盐缓冲溶液中)的相互作用, 通过对DAB分子极性基团的酯化探究影响DAB抗凝效率的动力学因素; 基于凝血酶与DAB极性基团酯化前后的分子对接模拟, 分析两者相互作用时分子构象变化对结合能的影响, 阐述DAB的抗凝机理; 通过DAB与牛血清白蛋白相互作用的对比实验验证DAB与凝血酶结合的特异性。
达比加群(≥ 98%)、 达比加群酯(> 99%)、 达比加群乙酯(≥ 99%)购自上海麦克林生化科技有限公司。 凝血酶(1 000 U, 比活性> 2 000 U· mg-1蛋白质)购自大连美伦生物科技有限公司。 牛血清白蛋白(> 96%)购自上海生工生物科技有限公司。 本研究中使用的其他化学品购自北京化学试剂有限公司。 所有光谱研究均在10 mmol· L-1 pH 7.4的磷酸盐缓冲液中进行, 实验使用(Millipore, 18.2 MΩ · cm)超纯水。
稳态光谱实验在UV-2450光谱仪(Shimadzu Corporation)和FS5荧光光谱仪(Edinburgh Instruments)上进行。 瞬态荧光(时间分辨荧光)光谱实验在Tempro-01光谱仪(Horiba Jobin Yvon)上完成, 使用NanoLED为激发光源及时间相关单光子计数检测技术。 荧光寿命的拟合使用瞬态荧光光谱仪Tempro-01配套的数据拟合软件DAS6, 采用的是重卷积分(reconvolution)处理模式, 衰减函数i(t)用灯谱函数P(t)去卷积分处理, 然后与实际测得的衰减曲线F(t)比较给出拟合系数χ 2。 经过对F'(t)不断地重复计算直至找到最佳的拟合情况及最小的拟合系数为止, 通过拟合系数χ 2值和加权残差的随机性来判断拟合质量。 在单指数模型不足以描述测量的衰变的情况下, 使用多指数模型来拟合衰变, 所用公式为
式(1)中, F是荧光强度, Ai是描述激发物种比率的每个分量的相对振幅, τ i表示它们的寿命。
研究中, 采用分子对接模拟(molecular docking simulation)方法[13, 14]通过空间匹配和能量匹配模拟凝血酶和DAB的相互识别和结合过程, 分析并解释光谱实验结果。 模拟时, 凝血酶(PDB ID: 1KTS)的结构来源于RCSB Protein Data Bank[15]。 DAB及其衍生物首先在Gaussian16软件[16]中采用密度泛函理论B3LYP/6-31G* 方法进行结构优化, 然后将分子的稳定结构导入AutoDock Tools 1.5.6中进行分子的电荷分布计算、 设置分子可旋转的化学键等预处理[17]; 使用AutoDock Vina程序[18]预测凝血酶和DAB的结合构象和结合亲和力; 最终, 采用BIOVIA Discovery Studio Visualizer软件进行可视化分析。
DAB为极性分子, 其pKa1=4.24, pKa2=11.51[12], 在pH 7.4磷酸缓冲溶液中以两性离子形式存在。 DAB吸收峰位于300 nm处[图2(a)], 在390 nm有微弱的荧光发射。 当DAB的极性基团在DE中转化为酯时, DE的吸收光谱为290~320 nm的宽峰, 荧光强度略有增强并红移至410 nm[图2(b)]。 相比之下, 凝血酶在280 nm激发时, 在330 nm处具有很强的荧光。
 | 图2 凝血酶、 达比加群、 达比加群酯在pH 7.4磷酸缓冲溶液中的(a)吸收光谱和(b)荧光光谱Fig.2 (a) Absorption and (b) fluorescence spectra of thrombin, DAB, and DE in pH 7.4 phosphate buffer |
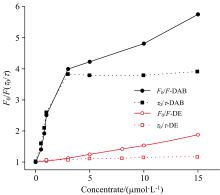
当DAB与凝血酶相互作用时, 凝血酶330 nm的荧光强度减弱, 并且随着DAB的浓度增加, 凝血酶的荧光猝灭更多, 直至DAB浓度达到3 μ mol· L-1时趋近饱和[图3(a)]。 此时, 稳态荧光呈现明显的双峰, 峰值分别在330和375 nm。 凝血酶+DAB混合样品的时间分辨荧光光谱显示, 随着DAB浓度的增加, 330 nm荧光的寿命逐渐变短, 当DAB浓度达到3 μ mol· L-1后不再继续改变[图3(b)]。 指数衰减分析表明(表1), 凝血酶本身在330 nm处的荧光由两个寿命成分组成τ 1=5.55 ns和τ 2=2.26 ns。 当DAB与凝血酶相互作用时, 出现了第三个短寿命组分(τ 3~700 ps), 并且τ 3组分的占比随着DAB浓度的增加而增加。 由于游离的DAB荧光微弱并且荧光寿命短于仪器的检测极限(~50 ps), 可以推测混合物中的τ 3组分来自一个新物质, 即凝血酶-DAB复合物。
| 表1 凝血酶(100 U· mL-1)以及凝血酶+DAB混合样品在330 nm的荧光寿命(激发波长为280 nm) Table 1 Fluorescence Lifetimes at 330 nm of Thrombin (100 U· mL-1) and Thrombin+DAB mixture excited at 280 nm |
不同浓度DAB和凝血酶混合样品的Stern-Volmer图显示(图4), 在DAB低浓度范围内(0.5~3 μ mol· L-1), 凝血酶的荧光被快速猝灭并且荧光强度和荧光寿命的变化相同, 表现出动态猝灭的特征。 当DAB的浓度达到3 μ mol· L-1以上时, 混合样品在330 nm的荧光寿命不会进一步改变, 但是仍然可以观察到一个较慢的荧光强度猝灭, 此时DAB对凝血酶的荧光猝灭为静态猝灭。 实验现象表明, DAB与凝血酶能够在低浓度时快速结合, 有效形成凝血酶-DAB复合物。 由于凝血酶分子在溶液中高度极化[12, 19, 20, 21], 其机制很可能是由于两者之间的静电相互作用。
当DE与凝血酶相互作用时, 凝血酶330nm的荧光强度随着DE浓度的增大缓慢下降[图5(a)]; 同时, 在400 nm处出现一个新的荧光发射峰。 当在310 nm激发凝血酶+DE的混合样品时, 400 nm荧光峰强度更高(图6)。 另一方面, 单独的凝血酶在310 nm处不能被激发, 游离的DE在310 nm激发时的荧光强度远远低于混合样品(图6)。 因此, 混合样品中400 nm的荧光必然来自一种新的成分, 即凝血酶和DE之间形成的复合物。 以310 nm激发凝血酶-DE复合物, 测定其在400 nm处荧光为单一短寿命~440 ps。
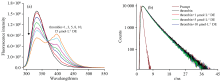 | 图5 凝血酶与不同浓度达比加群酯作用时的稳态(a)和瞬态(b)荧光光谱(λ ex=280 nm, 瞬态荧光检测波长λ em=330 nm)Fig.5 (a) Steady-state and (b) time-resolved (λ em=330 nm) fluorescence spectra of thrombin and thrombin+DE (λ ex=280 nm) |
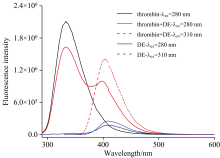 | 图6 分别在280和310 nm激发凝血酶、 达比加群酯、 凝血酶+达比加群酯混合样品的荧光光谱Fig.6 Fluorescence spectra of thrombin, DE, and thrombin+DE mixture excited at 280 and 310 nm, respectively |
凝血酶+DE混合样品在330 nm处的时间分辨荧光光谱[图5(b)]显示, 尽管凝血酶的荧光强度随着DE浓度的增加而降低, 但荧光寿命没有改变, 可见DE对凝血酶的猝灭是单纯的静态猝灭。 凝血酶+DE的Stern-Volmer图(图4)表明凝血酶+DE混合样品的荧光寿命保持恒定、 而荧光强度和DE浓度之间呈线性关系, 证实了DE对凝血酶的荧光猝灭是一种静态猝灭。
DE是DAB极性基团酯化后的产物, 两者的主要区别是电负性不同。 在pH 7.4缓冲溶液中, DAB为两性离子, 其苯甲脒基带正电荷、 羧基带负电荷; DE是一个微弱碱性物质, 在pH 7.4缓冲溶液中主要以中性形式存在。 DAB和DE对凝血酶荧光不同猝灭现象的实验结果支持我们关于DAB与凝血酶相互作用机理的推测, 即: DAB极性基团与溶液中高度极化的凝血酶分子之间的静电相互作用是DAB和凝血酶快速有效结合的关键动力学因素。
如果只将DAB的羧酸基团酯化可得到达比加群乙酯(Dabigatran ethyl ester, DAE)。 稳态和瞬态荧光光谱的研究发现, DAE与DAB对凝血酶荧光的猝灭现象非常接近, 即: 在低浓度时, DAE对凝血酶荧光表现快速的动态猝灭; 浓度大于3 μ mol· L-1时, 荧光寿命不再改变, 只有静态猝灭(图7)。 这一实验现象说明: DAB的苯甲脒基团是主导药物与凝血酶有效结合的动力学因素, 羧酸基团的影响很小。 在pH 7.4条件下, DAE的苯甲脒基带正电荷, 凝血酶带负电荷[21], DAE对凝血酶的光谱研究进一步证实溶液中DAB与凝血酶分子间的静电引力是两者有效结合的动力学驱动。
由于未能获得达比加群苯甲脒基团单一酯化的产物达比加群己酯(Dabigatran hexyl ester, DAH), 我们通过分子对接模拟方法对上述实验结论进一步验证。
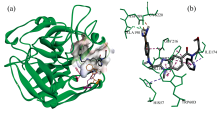
凝血酶属于血浆丝氨酸蛋白酶, 通过利用表面特征的活性位点裂缝和纤维蛋白原识别位点实现多重功能[21, 22, 23]。 活性位点区域包括三个不同的口袋[22]: 特异性口袋S1, 近端疏水口袋S2, 和远端疏水口袋S3。 特异性口袋S1的底部有酸性氨基酸天冬氨酸残基Asp189, 使得凝血酶活性口袋在溶液中富含负电性, 偏好具有碱性残基的底物[21, 22, 23]。 活性位点狭缝被Tyr60A-Pro60B-Pro60C-Trp60D环(60插入环)封闭, 该序列为凝血酶特有且呈现相对刚性。 该环在活性位点处形成了一个疏水性的“ 盖子” , 限制分子进入, 增强了凝血酶的底物特异性[23]。 DAB通过阻断活性部位的通路实现对凝血酶的抑制作用。 在分子对接模拟过程中, DAB能够自发对接到凝血酶的活性口袋, 表明DAB的结构具有非常强的凝血酶底物适配性。 如图8所示, 达比加群的中心骨架1, 2, 5-三取代的苯并咪唑环恰好能够“ 平躺” 进入主要由Leu99、 His57、 Tyr60A、 Trp60D残基侧链构成的S2口袋中; 苯并咪唑上的取代基向两侧“ 舒展” , 苯甲脒基团伸入S1特异性口袋, 与S1口袋底部的天冬氨酸Asp189形成氢键; 吡啶环伸入疏水口袋S3, 羧酸基团与凝血酶分子没有明确的相互作用。
当仅有羧基酯化时, DAE[图9(c)]与DAB[图9(a)]的构象在结构中心苯并咪唑环、 苯甲脒部分、 吡啶环部分基本一致; 但乙酯连接在手性N原子上的支链发生扭转, 从而导致乙酯链向凝血酶外延伸。 这说明缺乏羧基极性不会从根本上影响达比加群与凝血酶的特异性结合。 但比较DAE(-9.1 kcal· mol-1)和DAB(-9.8 kcal· mol-1)与凝血酶结合的Gibbs自由能变化(表2), DAB与凝血酶的结合更稳定。
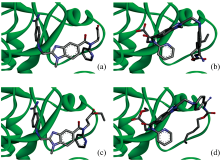 | 图9 达比加群DAB及其极性基团酯化后的衍生物与凝血酶的分子对接构象 (a): DAB; (b): DAH; (c): DAE; (d): DEFig.9 Molecular docking of (a) DAB, (b) DAH, (c) DAE, and (d) DE with thrombin |
| 表2 达比加群及其酯化衍生物与凝血酶的结合能 Table 2 Calculated thermodynamic parameters for dabigatran and its derivatives binding to thrombin |
当脒基酯化时, DAH[图9(b)]与凝血酶的对接构象和DAB相比发生很大改变, 两者的结合自由能也相差较大。 没有苯甲脒基与凝血酶Asp189残基之间的氢键作用, 更大体积的苯甲脒己酯导致分子不能很好的嵌入凝血酶的活性位点, DAH的苯并咪唑环在凝血酶活性位点的构象左右翻转, 苯甲脒己酯朝向凝血酶外侧。 这说明脒基的酯化直接影响药物分子与凝血酶的特异性结合, 分子对接的结果验证了光谱实验的结论。
当DAB的两个极性基团都被酯化时, 与DAH类似, DE分子的中心结构苯并咪唑环没有能够恰好“ 卡” 进凝血酶活性位点处的S2口袋内[图9(d)], 体积更大的苯甲脒己酯朝向凝血酶外侧。 分子对接的结果表明, 中心结构苯并咪唑与凝血酶间的疏水作用虽然能将DE定位到凝血酶的活性部位, 但由于没有苯甲脒基与S1口袋中酸性氨基酸残基的静电引导作用, 有效结合能力大大减弱。 DE与凝血酶结合的Δ G仅为-6.9 kcal· mol-1, 与DAB的-9.8 kcal· mol-1相差较大。
表2列出了DAB及其极性基团被酯化的三种衍生物DAE、 DAH、 DE与凝血酶分子对接的结合能, 对比它们与凝血酶结合时的分子构象, 结合荧光光谱的实验结果分析, 可以得出: 苯甲脒基在DAB与凝血酶特异性结合过程中起到引导药物分子以正确构象进入凝血酶活性口袋的作用; 疏水作用的结合是非特异性结合。
在DAB和DE与牛血清白蛋白BSA相互作用的对比实验中(图10), 观察到了DAB对BSA荧光强度的微弱静态猝灭, 但没有观察到荧光寿命的变化, 即不存在动态猝灭现象; DAB极性基团酯化后的DE对BSA的荧光猝灭也是单一的静态猝灭作用。 荧光光谱的实验结果显示DAB和DE与BSA之间的结合是非特异性结合。 在研究过程中, 我们也对比了DAB和DE对人血清白蛋白(HSA)荧光光谱的影响, 得到了和BSA基本一致的结果。 Simone等在DAB与HSA相互作用的研究中也观察到了与本实验结果相符的现象[9, 24]。
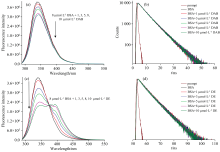 | 图10 达比加群和达比加群酯对牛血清白蛋白荧光光谱的影响(λ ex=280 nm, 瞬态荧光检测波长λ em=340 nm)Fig.10 Steady-state and time-resolved (λ em=340 nm) fluorescence spectra of BSA+DAB (a, b) and BSA+DE (c, d) (λ ex=280 nm) |
此外, 在与BSA作用的荧光光谱实验中, DAB对BSA荧光强度的猝灭弱于DE, 即DAB和BSA的结合能力比其极性基团酯化后的DE更弱[图10(a, c)]。 Naik等[10]在DAB与HSA相互作用的研究中曾推测: 羧基可以增加DAB的亲水性, 从而减少DAB与血浆中其他蛋白的疏水性非特异结合。 这一推测与我们在DAB和DE与BSA相互作用的荧光实验中观察到的现象一致。 然而, DAB和DAE与凝血酶相互作用的荧光光谱研究结果(图7)也显示, 在pH 7.4的磷酸缓冲溶液中, 羧基的引入在一定程度上减弱了DAB与凝血酶的结合。 如何修饰或改变羧酸基团以提高达比加群与凝血酶的结合能力以及药物的生理活性还有待进一步探索。
利用稳态和瞬态荧光光谱方法研究了DAB与凝血酶在溶液中的相互作用, 研究发现: DAB对凝血酶的荧光既有动态猝灭也有静态猝灭, 而DAB的极性基团酯化后对凝血酶的荧光只有静态猝灭。 通过分析DAB及其酯化产物在凝血酶活性位点的构象和结合能, 提出DAB抑制凝血酶活性的机理为: DAB的苯甲脒基团与凝血酶之间的静电导向作用是两者形成有效复合物的关键驱动, 疏水作用和苯并咪唑的分子骨架与凝血酶活性位点的空间适配度是两者稳定结合的基础, 羧酸基团的取向对于两者结合的稳定性有重要的辅助作用。 研究结果为口服抗凝药达比加群的临床应用和逆转剂的研究提供了理论和实验基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|