作者简介: 张 静, 女, 1989年生, 河口生态安全与环境健康福建省高校重点实验室教授 e-mail: jingz421@xujc.com
α-葡萄糖苷酶(GAA)作为一类重要的糖苷水解酶, 是维持人体血糖平衡的重要功能性蛋白质。 长期以来, 为实现高血糖人群的降糖, 研究人员多关注于探寻具有GAA活性抑制作用的食品、 药品, 但鲜有研究关注于人体非主动摄取的外源物质对GAA正常生理功能可能产生的影响。 该研究选取典型多环芳烃类物质—菲的羟基代谢产物9-羟基菲(9-OHPhe), 探究其对GAA活性功能的影响及潜在机制。 为获得9-OHPhe与GAA的结合作用信息, PARAFAC法被应用于光谱重叠的9-OHPhe和GAA的三维荧光光谱(EEM)数据的解析, 同时分子对接法被运用于分析分子层面两者结合的微观信息。 9-OHPhe对GAA的活性有抑制作用, 相应的IC50值为(7.59±1.91) μmol L-1; PARAFAC可有效应用于荧光光谱重叠的GAA和9-OHPhe反应体系的荧光数据解析; 9-OHPhe可引起GAA内源荧光的静态猝灭, 两者能形成1∶1复合物, 在298 K下其结合常数为(8.91±0.68)×103 L·mol-1; 9-OHPhe与GAA的GLN281、 LEU305、 ASN319、 LEU321、 TYR322、 LEU323和TYR352之间产生了疏水作用力, 与GLN309和ASN319分别形成了键长为2.71和3.05 Å的氢键; 低浓度的9-OHPhe可使GAA的二级结构变得稳定, 但过高浓度的9-OHPhe则会破坏GAA的结构稳定性。 9-OHPhe对GAA活性有明显抑制效应, 提示相关外源污染物进入健康人体后经这一途径所可能引起的血糖平衡紊乱值得关注和深入研究。
Alpha-glucosidase (GAA), as an important glycoside hydrolase, is avital functional protein to maintain human blood glucose balance. For a long time, researchers have focused on exploring foods and drugs with inhibition of α-glucosidase activity in order to reduce blood glucose in people with hyperglycemia. However, few studies have focused on the possible effects of non-active intake of exogenous substances on the normal physiological functions of GAA. Given this, 9-hydroxyphenanthrene (9-OHPhe), a hydroxyl metabolite of a typical polycyclic aromatic hydrocarbon—phenanthrene, was selected in this study to explore its influence on GAA activity and potential mechanism. In order to obtain the binding information of 9-OHPhe and GAA, the PARAFAC method was applied to analyze the three-dimensional fluorescence spectra (EEM) data of 9-OHPhe and GAA with overlapping spectra, and the molecular docking method was used to analyze the microscopic information of their binding at the molecular level. 9-OHPhe inhibited the activity of GAA, and the corresponding IC50 value was (7.59±1.91) μmol·L-1. PARAFAC method can be effectively used to analyze the fluorescence data of GAA and 9-OHPhe systems with overlapping fluorescence spectra. 9-OHPhe can cause the static quenching of endogenous fluorescence of GAA, and they can form a 1∶1 complex with the binding constant of (8.91±0.68)×103 L·mol-1 at 298 K. The hydrophobic interactions existed between 9-OHPhe and GLN281, LEU305, ASN319, LEU321, TYR322, LEU323, TYR352 in GAA, and two hydrogen bonds with bond lengths of 2.71 and 3.05 Å formed for 9-OHPhe with GLN309 and ASN319. A low concentration of 9-OHPhe can stabilize the secondary structure of GAA, while too high a concentration of 9-OHPhe will destroy the structural stability of GAA. 9-OHPhe showed anobvious inhibitory effect on the activity of GAA, suggesting that the glucose balance disorder which might be caused through this pathway after the relevant exogenous pollutants entered the healthy human body was worthy of attention and in-depth study.
α -葡萄糖苷酶(alpha-glucosidase, GAA)是一类广泛存在的水解酶, 主要作用是将机体无法吸收的寡糖和二糖水解为机体可吸收利用的单糖[1]。 以人体为例, GAA可促进体内葡萄糖的形成, 对维持人体的血糖平衡和正常的生理活动具有重要意义。 通过寻求高效健康的活性抑制剂来降低高血糖患者体内的血糖浓度, 一直是药品、 食品降糖研究的重要研究方向, 相关研究发现阿卡波糖[2]、 硝基呋喃酮衍生物[3]、 黄酮类物质[4]、 阿魏酸[5]、 苹果幼果多酚[6]等药品、 食品均具有很好的GAA活性抑制作用。 值得注意的是, GAA在高血糖患者体内的活性表达对患者具有负效应, 而正常人体内GAA的活性表达则具有正效应。 目前, 很少有研究关注于人体非主动摄取的外源物质对GAA正常生理功能可能产生的影响。
菲(phenanthrene, Phe), 作为一种典型的多环芳烃类物质(PAHs), 自2010年起即被国际癌症研究机构(IARC)列为了第3类致癌物。 与其他PAHs一样, Phe主要通过有机质的不完全燃烧进入环境[7], 从而对生物体构成潜在危害。 人体可通过多种途径暴露Phe等PAHs, 包括饮食摄入、 呼吸吸入和皮肤暴露[8]。 其进入人体后, 可被CYP450酶和环氧化物水解酶等代谢酶系统代谢为羟基化合物或其他代谢物, 这些代谢物常常可在人体尿液中检测到, 且相关研究发现其毒性往往高于母体PAHs[9]。 在评估Phe等PAHs对人体的健康效应时, 其羟基代谢产物不容忽视。
蛋白质与小分子的结合作用是探究小分子对蛋白质结构功能影响的重要内容。 荧光光谱法因其灵敏度高、 方便快速及成本低的优点, 被广泛用于蛋白质和小分子结合作用研究中[10, 11]。 当小分子存在自发荧光且光谱与蛋白质重叠时, 常规二维荧光光谱的应用会受到限制。 一些研究将三维荧光光谱(EEM) 与化学计量学方法[如平行因子分析法(PARAFAC)等]相结合, 以“ 数学分离” 代替或增强“ 物理、 化学分离” , 从而将光谱重叠的蛋白质和小分子的荧光数据解析出来, 以实现定性定量分析[12]。
本研究选取了Phe的羟基代谢产物9-羟基菲(9-OHPhe), 探究其对GAA活性功能的影响及潜在机制: 利用体外模拟实验研究了不同浓度的9-OHPhe对GAA活性的影响; 鉴于9-OHPhe与GAA荧光光谱的重叠, 利用PARAFAC法解析了反应体系的EEM数据, 并进行了荧光猝灭分析, 获得了相关作用信息; 利用分子对接法预测了9-OHPhe在GAA上的最优结合位点, 获得了分子层面的微观作用信息; 利用紫外-可见吸收光谱法研究了二者相互作用引起的GAA构象变化。 本研究的开展, 探索性地从分子水平了解PAHs羟基代谢产物对GAA正常生理功能的影响及机制, 所获得的结果有助于研究者从不同视角分析外源污染物对GAA生理功能的影响所可能产生的人体健康效应。
试剂: 9-OHPhe(纯度> 98%, 购自美国Sigma-Aldrich公司), GAA(100U, 购自美国Sigma-Aldrich公司); 对硝基苯基-α -D-吡喃葡萄糖苷(pNPG, 纯度> 99%, 购自美国Sigma-Aldrich公司)。 配制0.05 mol· L-1 pH为6.80的磷酸盐缓冲溶液(PBS), 并用其做溶剂, 分别配制4 U· mL-1的GAA储备液、 2.0× 10-3 mol· L-1的9-OHPhe储备液以及1.0× 10-2 mol· L-1的pNPG储备液, 均置于4 ℃冰箱保存。 其余试剂均为分析纯, 实验用水为Milli-Q超纯水(18.2 MΩ · cm)。
仪器: F-4600型荧光分光光度计(日立高新技术公司, 日本); UV-8000S紫外-可见分光光度计(上海元析仪器有限公司, 中国); HR-250A 型电子分析天平(日本株式会社A& D公司, 日本)。
1.2.1 9-OHPhe对GAA活性影响测定
实验方法参考文献[5]和[6]并根据实际情况有所调整。 于10 mL比色管中, 先后加入2 mL PBS 缓冲液、 200 μ L GAA储备液及不同体积的9-OHPhe储备液, 混合后加入PBS 缓冲液定容至5 mL, 作为样品组; 仅含PBS缓冲液和GAA的为对照组, 仅含PBS缓冲液的为对照空白组, 仅含PBS缓冲液和9-OHPhe的为样品空白组。
将比色管置于37 ℃恒温震荡培养箱震荡混合15 min(500 rpm), 震荡完成后将比色管取出放置在37 ℃恒温水浴锅中备用。 于2 mL的比色皿(1 cm)中分别加入0.75 mL反应溶液与0.75 mL的pNPG储备液, 利用UV-8000S紫外-可见分光光度计直接扫描混合溶液在400 nm 处110 s内的吸光度-时间曲线, 计110 s与0 s的吸光度差值为A。 测定完成后, 利用式(1)计算活性抑制率
1.2.2 荧光猝灭实验体系的溶液配制
9-OHPhe-GAA反应体系的配制: 向一系列10 mL比色管(含5、 10 mL刻度)中加入一定量9-OHPhe和GAA储备液, 并用PBS缓冲液定容至5 mL, 分别配置梯度浓度9-OHPhe与GAA的混合溶液、 对应单组分梯度浓度9-OHPhe溶液、 不同浓度单组分GAA溶液及空白溶液。 样品浓度配置详见表1。
| 表1 9-OHPhe-GAA反应体系的浓度设置 Table 1 The concentration setups of 9-OHPhe-GAA systems |
1.2.3 三维荧光光谱
室温(298 K)下, 利用F-4600型荧光分光光度计测定样品三维荧光光谱: 设定激发波长为200~340 nm, 扫描290~550 nm范围的发射光谱, 激发、 发射步距分别为2和1 nm, 激发、 发射狭缝均为10 nm, 扫描速度为12 000 nm· min-1。
1.2.4 PARAFAC分析
平行因子算法是基于交替最小二乘原理的迭代三维数阵解析算法。 利用MATLAB R2022a 软件, 对获得的三维荧光数据矩阵组(大小为71× 261× 18)进行PARAFAC解析, 方法参照文献[13]。 解析前先将样品的EEM光谱减去PBS溶液的EEM光谱, 并扣除瑞利散射及二级拉曼散射峰来减少散射光及其他背景干扰。 选用2~3组分模型对EEM数据组进行三线性解析。
1.2.5 紫外-吸收光谱
于室温(298 K)下, 扫描表1中2— 9号样品在190~450 nm范围内的紫外-可见吸收光谱, 狭缝宽度设置为1.0 nm, 中速扫描。
1.2.6 分子对接
从RCSB蛋白质数据库(http://www.rcsb.org/pdb/home/home.do)获得GAA晶体结构的pdb文件, 编码为5ZCC, 删去原有小分子配体。 利用GaussView 5.08软件绘制9-OHPhe的三维结构, 并用Gaussian 09软件通过DFT/B3LYP方法结合6-31G(d)基组进行优化得到能量最小的构象, 存为mol2文件。 利用AutoDockTools1.5.6软件去除GAA中的水分子, 并添加氢原子和原子类型, 导出为pdbqt文件备用; 为9-OHPhe添加氢原子、 Gasteiger电荷和原子类型, 导出为pdbqt文件备用。
参考文献[14], 利用AutoDock 4.2.6软件对GAA和9-OHPhe进行分子对接: 利用Autogrid程序设定网格大小和网格参数, 设置GAA中心为网格中心, 网格大小设置为126 Å × 126 Å × 126 Å , 格点间距设置为0.375 Å ; 利用Autodock程序, 通过拉马克遗传算法(LGA)预测GAA和9-OHPhe的最佳结合位置(参数: 遗传算法运行次数为25, 种群数为150, 最大迭代次数为250 000), 在获得的25个复合物构象中选取结合自由能最低的构象, 利用Protein-Ligand Interaction Profiler软件(https://plip-tool.biotec.tu-dresden.de/plip-web/plip/index)[15]和PyMOL软件[16]进行可视化研究。
利用体外实验研究了不同浓度9-OHPhe对GAA活性的影响。 由图1可知, 9-OHPhe对GAA的活性有抑制作用, 其抑制率与9-OHPhe的浓度成剂量-效应关系。 当9-OHPhe的浓度为2.4× 10-5 mol· L-1时, 对GAA活性的抑制率可达到93.2%。 利用GraphPad Prism 9软件自带的程序对该体系的IC50进行拟合, 得到9-OHPhe对GAA活性抑制的IC50值为(7.59± 1.91) μmol· L-1。 相似实验条件下相关研究得到的已商业化使用的GAA抑制剂阿卡波糖对GAA抑制的IC50值为1.18 μmol· L-1 [6]。 9-OHPhe的IC50值与阿卡波糖在同一数量级, 抑制能力(以IC50值计)约为阿卡波糖的16%, 表明9-OHPhe对GAA的活性有着较强的抑制作用。 以阿卡波糖为代表的GAA抑制剂能在寡糖与GAA的结合位点与后者结合, 从而抑制GAA活性。 因此, 为探究9-OHPhe对GAA活性抑制的内在机制, 需进一步获得9-OHPhe与GAA的结合作用信息。
GAA和9-OHPhe都有内源荧光, 在9-OHPhe对GAA荧光光谱无干扰的情况下, 可利用9-OHPhe对GAA荧光的猝灭效应获得两者的结合作用信息。 图2为9-OHPhe与GAA的荧光发射光谱, 两者光谱在420~470 nm范围内均受到二级散射的影响, GAA在445 nm处的峰即为散射峰。 由图2可知, 9-OHPhe对GAA的荧光发射光谱有明显影响, 一定范围内两者光谱重叠。 因此, 常规的二维荧光光谱法难以直接运用于9-OHPhe对GAA的荧光猝灭分析。 借助于PARAFAC分析法解析光谱重叠的9-OHPhe与GAA的三维荧光数据, 成为解决这一问题的有效途径。
 | 图2 GAA与9-OHPhe的荧光发射光谱 激发波长=222 nm; GAA浓度=0.2 U· mL-1, 9-OHPhe浓度=1.2× 10-5 mol· L-1Fig.2 Fluorescence emission spectra of GAA and 9-OHPhe Ex=222 nm; c(GAA)=0.2 U· mL-1, c(9-OHPhe)=1.2× 10-5 mol· L-1 |
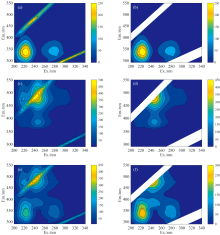
图3(a)、 (c)和(e)分别为GAA、 9-OHPhe和GAA-9-OHPhe复合体系的三维荧光光谱图。 原始图谱中存在的一级散射和二级散射峰有着较强荧光强度, 在使用PARAFAC解析时若不去散射会建立具有偏差的三线性模型。 因此, 在解析三维荧光数据前, 将散射峰荧光数据全部去除[如图3(b)、 (d)和(f)所示]。 利用PARAFAC法, 选用2~3组分模型来对表1中18个样品的EEM数据进行三线性解析。 经对比, 2组分模型解析出的荧光组分数据和光谱图形更为合理, 可得到荧光组分C1和C2(图4)。 对比图4中经PARAFAC解析得到的C1与C2的三维荧光光谱图和图3中GAA与9-OHPhe的真实光谱图, 可知C1和C2分别为拆分后的GAA和9-OHPhe的三维荧光光谱图。 值得注意, 解析出的三维光谱在已去除数据的二级散射峰位置存在图谱, 这是由于该方法依据邻近荧光数据得到模拟值并进行了数据插入。 为验证PARAFAC解析结果的准确性, 进一步对比解析出的GAA和9-OHPhe的二维荧光激发光谱图与两者各自的真实光谱图(图5)。 由图5可知, 解析出的光谱图能较好地反映出GAA和9-OHPhe的真实光谱的特征峰且光谱轮廓重叠性较好。 其中, 9-OHPhe的真实激发光谱在200~230 nm处因受到二级散射峰的影响与拆分的光谱有明显差异, 在三维光谱图中更为直观。 PARAFAC法用于解析三维荧光光谱数据时产生的误差也是真实光谱和拆分光谱存在差异的原因。
 | 图4 GAA-9-OHPhe反应体系经PARAFAC解析后获得的C1与C2 2个荧光组分的三维荧光光谱图Fig.4 EEM contours of the two fluorescent components (C1 and C2) of the GAA-9-OHPhe interaction systems |
经PARAFAC解析后, 获得了不同浓度9-OHPhe存在条件下GAA最大荧光峰强度(如图6所示)。 由图6(a)可知, 随着9-OHPhe浓度的增加, GAA荧光强度呈有规律地降低, 即9-OHPhe对GAA的荧光产生了猝灭效应。 为探讨9-OHPhe对GAA的荧光猝灭机制, 利用Stern-Volmer方程[式(2)]对GAA的荧光数据进行了分析。
式(2)中, F0和F分别为无9-OHPhe存在和不同浓度9-OHPhe存在条件下GAA荧光峰的相对荧光强度; [Q]是9-OHPhe的总浓度; KSV为动态猝灭常数; Kq为猝灭速率常数; τ 0为猝灭剂不存在时荧光体分子平均寿命(生物大分子的平均寿命约为10-8 s[17])。
以F0/F对[Q]作图[图6(b)], 由直线斜率得到9-OHPhe对GAA的动汰猝灭常数KSV为(2.01± 0.04)× 104 L· mol-1, 由此计算出相应的猝灭速率常数Kq值为(2.01± 0.04)× 1012 L· mol-1 s-1。 因9-OHPhe对GAA荧光猝灭的Kq值远大于各类猝灭剂对生物大分子的最大扩散控制的碰撞速率常数2.00× 1010 L· mol-1· s-1[18], 表明9-OHPhe对GAA的荧光猝灭为静态猝灭。
2.4 9-OHPhe与GAA的结合作用信息对于静态猝灭过程, 蛋白质荧光强度与猝灭剂浓度的关系满足Lineweaver-Burk双对数方程[19]。 以lg(F0/F-1)对lg[9-OHPhe]作图(图7), 由直线斜率和截距可求得GAA与9-OHPhe的结合位点数n值及结合常数Kb值分别为(0.93± 0.01)和(8.91± 0.68)× 103 L· mol-1。 298 K下GAA-9-OHPhe的n值约等于1, 表明在此条件下9-OHPhe与GAA形成了1∶ 1复合物。 GAA与9-OHPhe的结合常数接近104 L· mol-1量级, 与相关研究报道对GAA有明显活性抑制作用的黄酮类物质与GAA的结合能力接近[4]。
 | 图7 298 K下GAA-9-OHPhe体系的Lineweaver-Burk双对数方程拟合曲线Fig.7 Lineweaver-Burk plots of the GAA-9-OHPhe system at 298 K |
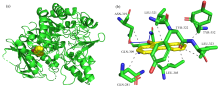
为进一步获得GAA 与 9-OHPhe的结合作用信息, 利用分子对接法研究了两者的结合模式, 并对获得的最优构象进行可视化分析, 所得结果见图8和表2。 图8(a)所示为9-OHPhe在GAA中的结合位点, 图8(b)为9-OHPhe与其结合位点周围氨基酸残基的非共价相互作用力信息。 由图8(b)和表2可知, 9-OHPhe结合位点周围主要有8个氨基酸残基与其产生非共价作用力。 9-OHPhe与GAA的GLN281(原子间距离d: 3.08 Å )、 LEU305(d: 3.18、 3.10 Å )、 ASN319(d: 3.67 Å )、 LEU321(d: 3.08 Å )、 TYR322(d: 3.49、 3.53 Å )、 LEU323(d: 3.08 Å )和TYR352(d: 2.92 Å )之间均产生了疏水作用力; 9-OHPhe分别与GLN309和ASN319形成了键长为2.71和3.05 Å 的氢键。
| 表2 GAA与9-OHPhe的非共价相互作用力信息 Table 2 Specific information on the non-covalent interactions between GAA and 9-OHPhe |
为研究9-OHPhe对GAA结构的影响, 测定了不同浓度9-OHPhe存在下GAA-9-OHPhe体系的紫外-可见吸收光谱。 由于9-OHPhe的吸收光谱与GAA的吸收光谱有重叠, 为观察GAA吸收光谱的变化, 将GAA-9-OHPhe混合体系的吸收光谱与相应浓度的9-OHPhe的吸收光谱作差谱得到图9。 由图9可知, GAA 在200 nm处有一个强吸收峰, 其反映的是GAA蛋白骨架的光谱性质。 在加入较低浓度(< 1.0× 10-5 mol· L-1)9-OHPhe时, 随着9-OHPhe的加入, 200 nm处的吸收峰强度逐渐增加, 表明在此浓度范围内9-OHPhe可使GAA的蛋白骨架变得紧密[20]。 即9-OHPhe促进了GAA中肽键的形成。 而随着更高浓度(1.2× 10-5 mol· L-1)9-OHPhe的加入, GAA的肽键含量则较低浓度9-OHPhe存在时明显减少, 但仍高于其初始值。 这表明, 低浓度的9-OHPhe可使GAA的二级结构变得稳定, 但过高浓度的9-OHPhe则会破坏GAA的结构稳定性。
PARAFAC可有效应用于荧光光谱重叠的GAA和9-OHPhe反应体系的荧光数据解析, 9-OHPhe可与GAA发生较强的结合作用从而使GAA的内源荧光发生静态猝灭, 其结合作用力主要为疏水作用力和氢键, 两者的结合作用可引起GAA构象的改变, 进而对GAA的活性产生影响。 9-OHPhe对GAA的活性有着较强的抑制作用, 表明9-OHPhe对生物体内GAA的正常生理功能有着潜在的负面效应。 提醒研究者, 对于健康人群, 具有GAA活性抑制效应的外源污染物的摄入, 可能引起的健康效应值得进一步关注和探究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|