作者简介: 朱少昊, 1999年生, 青岛农业大学化学与药学院本科生 e-mail: 642278247@qq.com
农药残留污染使得食品安全获得广泛关注, 发展快速准确和高灵敏的农药残留检测新方法, 具有一定的理论和实际意义。 利用金纳米在聚集和分散状态下, 等离子吸收光谱的变化以及荧光分子罗丹明110与金纳米吸收光谱产生内滤效应, 设计了比色和荧光双模式光学传感器用于农药残留的高灵敏检测。 采用柠檬酸盐还原法合成直径约13 nm表面带有负电荷的金纳米粒子, 在水溶液中呈分散状态, 呈酒红色, 溶液的最大吸收波长在520 nm处。 农药分子可与金纳米通过形成Au—N或者Au—O配位键而结合, 导致分散的金纳米在农药分子诱导作用下发生聚集, 溶液颜色逐渐由酒红色变为蓝紫色, 520 nm处的吸光度逐渐降低, 根据溶液吸光度的变化即可实现农药含量的测定。 溶液颜色的显著变色即便裸眼也可以观察, 该检测方式具有简便、 快速和成本低的优势。 尽管单一的比色检测模式简单, 但存在假阳性的可能。 为进一步验证结果的准确性, 同时提高检测的灵敏度, 在金纳米溶胶中引入带正电的荧光染料罗丹明110, 其吸附在带负电荷的金纳米表面, 此时金纳米在溶胶仍处于良好的分散状态。 由于罗丹明110的荧光光谱与金纳米的吸收光谱重叠, 即二者发生了荧光的内滤效应, 此时溶液的荧光强度很弱, 甚至不发射荧光。 一旦溶液中存在农药分子, 与金纳米表面的荧光染料竞争吸附, 从而诱导金纳米聚集, 溶液由酒红色变为蓝紫色, 同时释放到溶液中的罗丹明110分子的荧光得以恢复, 根据溶液吸光度和荧光强度变化实现对目标物的比色和荧光双模式检测。 以辛硫磷为模型分子, 测试该传感器的各项性能, 比色法和荧光法的检出限分别为15.0和4.0 nmol·L-1, 实际样品测试结果表明, 该传感器在食品安全检测中具有一定的应用潜力。
Food safety has attracted public attention because of pesticide residue contamination. It has certain theoretical and practical significance to develop fast, accurate and highly sensitive new methods for detecting pesticide residues. In this paper, a colorimetric and fluorescent dual-mode optical sensor has been designed for sensitive detection of pesticide residues by using the difference of plasma absorption spectrum of aggregation and dispersion gold nanoparticles and the internal filtration effect between fluorescent molecule rhodamine 110 and gold nanoparticles. Gold nanoparticles (AuNPs) with a diameter of about 13 nm and a negative charge on the surface were synthesized by the citrate reduction method. They were dispersed in an aqueous solution and showed wine red. The maximum absorption wavelength of the solution was 520 nm. Pesticide molecules can induce the aggregation of dispersed AuNPs by forming Au—N or Au—O coordination bonds, resulting in the color changes of the solution gradually from redwine to blue-purple. Pesticide content can be detected according to the change of absorbance of the solution at 520 nm. The significant color change of the solution can be observed even with the naked eye. The detection method has the advantages of simplicity, rapidity and low cost. Although the single colorimetric detection mode is simple, false positive is possible. In order to further verify the accuracy of the results and improve the detection sensitivity, fluorescent dye rhodamine 110 with the positive charge is introduced into the dispersed AuNPs solution, which can adsorb on the negatively charged AuNPs surface. In this state, the AuNPs are still well dispersed in the solution. The fluorescence spectrum of rhodamine 110 overlaps with the absorption spectrum of AuNPs, leading to the fluorescence internal filtration effect (IFE). The fluorescence intensity of the solution is very weak, even with no fluorescence emission. In the presence of pesticide molecules in the solution, they compete for adsorption with the fluorescent dyes on the surface of AuNPs to induce the aggregation of AuNPs. The color of the solution changes from redwine to blue purple. At the same time, the fluorescence of rhodamine 110 molecules released into the solution is restored. The colorimetric and fluorescence dual-mode detection of the targets is realized according to the changes insolution absorbance and fluorescence intensity. As a model molecule, phoxim was used to test the sensor's performance. The limit of detection for color imetry and fluorescence were 15.0 and 4.0 nmol·L-1, respectively. The test results of actual samples showed that the sensor had certain application potential in the food safety field.
俗话说“ 民以食为天” , 近年来农药残留引起的食品污染事件时有发生, 大多是残留农药污染的食物(如谷物、 蔬菜和水果等)而引起[1, 2]。 农药可与乙酰胆碱酯酶结合, 使其失去原有催化乙酰胆碱水解的功能, 造成乙酰胆碱大量蓄积, 对神经过分刺激而引起中毒, 中毒者表现为流涎腹泻、 震颤肌束颤动等症状, 严重者可导致瘫痪和死亡[3]。 发展快速、 简便、 准确灵敏的农药残留检测新方法, 加强对食品和农产中农药残留的监测, 对保证食品安全, 尤其对保障人类的健康具有重大的理论和现实意义。
食品成分复杂, 实现农药残留的监测, 必须使用特异性强, 灵敏度高的检测方法。 目前已报道的检测方法主要有色谱法[4]、 色谱-质谱联用法[5]、 免疫分析法[6]、 酶抑制法[7]和生物传感器等技术[8]。 色谱法需要复杂样品前处理, 与质谱联用所需仪器昂贵; 免疫分析法抗体制备复杂且难度大, 试剂盒的成本较高; 酶抑制法使用的酶易失活, 导致重现性差。 生物传感器具有简单快速, 选择性好, 可直接对复杂试样进行检测等优点, 在化学、 医学和食品安全检测等领域应用呈现快速发展趋势[9]。
生物传感器中, 比色法简单直观, 可以实现裸眼检测; 荧光法具有灵敏度高, 选择性好等优点在农药残留检测领域获得了较多进展[10]。 例如在氧化石墨烯的辅助下, 利用金纳米粒子聚集分散变色特性, Ritika等[11]开发了细胞中大肠杆菌的检测平台。 根据溶液颜色从红色变为蓝色, 肉眼观察到的检测限为102个细胞/毫升。 Lee等[12]首先将肽配体固定在纳米金上, 使得纳米金粒子均匀分散在溶液中, 借助真菌孢子与纳米金相互作用, 使得纳米金粒子沉淀, 导致上清液的颜色发生明显变化。 简单的比色法显示出约50个孢子的高灵敏度和小于10 min的快速检测时间, 并可与基于智能手机的图像分析应用程序一起使用。 Yu等[13]对多效唑溶液和苹果汁-多效唑混合溶液的荧光光谱及其导数光谱进行了回归分析, 分别得到了两种方法的浓度与荧光强度之间的预测模型函数, 为农药残留的定量检测提供了实验参考。 有报道研究了吡虫啉的荧光性质, 实现了对苹果汁中吡虫啉农药残留进行检测和分析。 尽管有关生物传感器用于农药残留的检测已有较大发展, 但是现有报道大多是单一的测定模式, 不仅检测结果存在假阳性的可能, 而且现有荧光检测方法大多需要荧光标记物, 标记过程繁琐, 价格高[14]。
本工作借助农药分子使分散的金纳米粒子聚集而引起溶液颜色发生变化的原理, 实现裸眼检测样品中的农药残留; 同时为了避免单一检测模式可能出现的假阳性, 利用荧光染料罗丹明110与金纳米发生荧光内滤效应的原理, 由于农药分子与金纳米的强相互作用, 使得吸附在金纳米表面的荧光染料重新释放到溶液中, 荧光得以恢复, 从而实现对农药残留的高灵敏检测。 以辛硫磷为模式目标物, 考察了该比色和荧光双模式传感器的性能及其在实际样品中农药残留检测的应用。 为进一步开发农药残留分析的新方法和新技术, 实现农产品和食品等复杂样品中痕量农药残留的特异性和高灵敏的快速检测提供新思路。
氯金酸, 辛硫磷, 马拉硫磷, 丙溴磷, 甲霜灵, 福美锌, 莠去津, 吡虫啉购自上海阿拉丁试剂有限公司, 柠檬酸钠, 氢氧化钠, 磷酸氢二钠, 磷酸二氢钠, 氯化钠, 乙腈, 醋酸钠, 无水硫酸钠和无水硫酸镁, 均购自上海国药集团化学试剂有限公司。 N-丙基乙二胺(PSA), C18, 石墨化碳黑(GCB)样品前处理材料购自天津博纳艾杰尔科技有限公司。 所用试剂均为分析纯, 实验用水为二次去离子水。
U-3900紫外-可见分光光度计(日立, 日本), F-7000荧光分光光度计(日立, 日本), PB-10酸度计(赛多利斯, 德国), HT7700透射电子显微镜(日立, 日本), 激光纳米粒度仪(马尔文, 英国)。
1.2.1 金纳米粒子的制备
纳米金的制备根据文献略做修改[15], 所有玻璃器皿在王水(浓盐酸:浓硝酸=3:1, V/V)中彻底清洗后, 用二次去离子水冲洗干净, 烘干备用。 制备过程: 在剧烈搅拌下, 将0.02%的HAuCl4(96 mL)水溶液煮沸, 将2%柠檬酸三钠(4.0 mL)水溶液快速添加至上述溶液中, 溶液颜色从灰黄色变为深红色, 继续回流20 min后停止加热, 待溶液冷却后用0.45 μ m滤膜过滤, 滤液置于棕色试剂瓶中, 于4 ℃冰箱避光保存备用。
1.2.2 金纳米粒子的结构表征
取一定量上述制备的金纳米溶液, 分别对其紫外-可见吸收光谱、 透射电子显微镜、 动态光散射及表面的Zeta电位进行测定。 同时在纳米金溶胶中加入一定量的荧光染料罗丹明110, 形成纳米金-罗丹明110纳米复合粒子后, 再次对其吸收光谱和表面电荷情况进行测定。
1.2.3 比色及荧光测定
取一定量的纳米金溶胶, 加入不同浓度的目标物后, 溶液颜色由酒红色逐渐变为蓝紫色, 溶胶的吸光度值的变化与目标物浓度具有定量关系, 据此实现农药残留的比色法检测。
取一定量的纳米金溶胶, 加入一定浓度的罗丹明110, 形成纳米金复合物, 测试其荧光强度, 作为空白对照。 加入不同浓度的目标物后, 再次测试体系的荧光强度, 荧光增强的程度与目标物浓度在一定浓度范围内具有定量关系, 据此实现农药残留的荧光高灵敏检测。
分别利用紫外-可见光谱(UV-Vis), 透射电镜(TEM)和动态光散射对制备的纳米金进行形貌表征, 如图1所示。 由图1(a)曲线1可以看到金纳米粒子的最大吸收波长约为520 nm, 金纳米粒子等离子体共振紫外可见吸收特征峰。 当形成金纳米-罗丹明110纳米复合粒子后, 其最大吸收波长没有明显改变, 但其吸光强度有所下降(曲线2)。 从图1(b)的TEM图可看出所制备的Au纳米粒子尺寸约为13 nm, 呈规整的球形, 边界清晰, 分散良好。 图1(c)为金纳米-罗丹明110复合物的TEM图, 可以看出粒子的直径大小几乎没有改变。 图1(d)的动态光散射结果显示绝大多数纳米粒子直径同样保持13 nm左右, 与TEM测试粒径保持一致。 图1(e)是金纳米-罗丹明110复合物的动态光散射结果, 可以看出粒径略微有少许增加。 图1(f)显示单独金纳米粒子表面的zeta电位为-44.1 mV, 金纳米-罗丹明110纳米复合粒子表面的zeta电位明显升高, 为-30.3 mV, 这是由于金纳米表面吸附了一定量带正电荷的荧光染料罗丹明110所导致。
农药残留的比色和荧光双模传感原理如图2所示。 柠檬酸盐还原法制备的AuNPs表面带有较多的负电荷, 即使在一定浓度盐存在下, 粒子之间的静电排斥力使得金纳米胶处于良好的分散状态, 其溶液显示酒红色。
当存在农药分子时, 与纳米金之间通过形成Au— N或者Au— O配位键结合, 导致分散的AuNPs在农药分子诱导作用下发生聚集, AuNPs溶液颜色由酒红色变为蓝紫色, 其在520 nm处的吸光度逐渐降低, 通过检测溶液吸光度的变化即可实现农药含量的测定。 溶液颜色的显著变色即便裸眼也可以观察, 该检测方式具有简便、 快速和成本低的优势。 单一的比色检测模式虽然简单, 但是其测试结果存在假阳性的可能。 为进一步验证结果的准确性, 同时提高检测的灵敏度, 本文利用荧光分子的发射与金纳米的紫外可见吸收产生内滤效应(IFE), 设计了荧光传感策略用于农药的高灵敏检测。 在金纳米溶胶中引入带正电的荧光染料罗丹明110, 由于静电作用, 罗丹明110会吸附在带负电荷的纳米金表面, 此时纳米金在溶胶中仍处于良好的分散状态, 溶胶显示酒红色。 而荧光染料罗丹明110发射的荧光正好可以被金纳米吸收, 此时溶液的荧光强度很弱, 甚至不发射荧光。 一旦溶液中存在农药分子, 与荧光染料产生竞争反应, 从而诱导金纳米聚集, 溶液由酒红色变为蓝紫色, 同时释放金纳米表面吸附的荧光分子到溶胶中, 实现荧光的恢复, 根据溶液吸光度和荧光强度变化实现对目标物的双模式检测。
2.3.1 比色法检测农药残留
分别对金纳米溶胶和加入辛硫磷后的金纳米溶胶进行紫外可见光谱扫描, 结果如图3(a)所示。 结果表明, 与单独的金纳米溶胶相比, 加入不同浓度的辛硫磷后的金纳米溶胶在520 nm波长处吸光度逐渐减小, 同时650 nm波长处吸光度逐渐增加。 这是由于辛硫磷的加入引起了分散的AuNPs团聚, 导致金表面等离子共振吸收峰发生位移。 溶胶在650与520 nm处吸光度的比值(A650/520)与加入的目标物浓度具有定量关系, 据此实现比色法测定辛硫磷的含量的目的。
2.3.2 荧光法检测农药残留
分别测试罗丹明110溶液, 金纳米与罗丹明110复合物溶胶以及加入一定量的农药后溶胶的荧光强度作对照, 其实验结果如图3(b)所示。 图中三条曲线的峰形及最大发射波长一致, 表明AuNPs、 辛硫磷并未与罗丹明 110作用生成新物质。 可以看出, 罗丹明110的荧光最强(曲线1), 其最大发射波长为520 nm; 而金纳米与罗丹明110复合物的荧光发射强度显著降低(曲线2), 这是由于罗丹明110分子可通过静电作用吸附在AuNPs表面, 此时, 由于AuNPs与罗丹明110分子间的IFE产生荧光猝灭效应; 当加入待测目标物农药后, 溶液的荧光强度又逐渐恢复(曲线3), 主要因为农药分子与纳米金的强结合能力, 使得吸附在纳米金表面的罗丹明110分子重新释放到溶胶中, 其荧光的恢复程度与目标农药的浓度具有定量关系, 据此, 实现高灵敏荧光检测农药残留量。
2.3.3 金纳米与罗丹明110的内滤光效应(IFE)
当溶液中某物质的吸收光谱与共存的某荧光分子的荧光光谱发生重叠或者部分重叠时, 则该物质将能猝灭荧光分子的荧光发射, 导致溶液的荧光强度减弱甚至消失, 这种现象称为IFE。 本实验金纳米粒子的吸收光谱与荧光染料罗丹明110的荧光光谱恰好发生了重叠, 如图3(c)所示。 结果进一步证实, 二者之间确实存在IFE。 上述结果表明, 本实验设计的比色和荧光双模式检测策略是可行的。
2.4.1 罗丹明110浓度的优化
实验中AuNPs和罗丹明110的相对量会直接影响荧光检测的灵敏度。 游离的罗丹明110分子在溶液中本身发射荧光, 如果其浓度过高, 会使检测的背景信号增大; 反之, 若罗丹明110浓度过低, 加入待测物质后, 形成的聚集态AuNPs使荧光恢复程度较小, 降低了测定的灵敏度。 固定金纳米溶液的浓度, 测试不同浓度罗丹明110的荧光强度与二者复合物溶液的荧光强度差值的变化情况, 如图4(a)所示。 可以看出随着罗丹明110的浓度的增加, 荧光强度差值逐渐增大, 当罗丹明110的浓度为0.5 μ mol· L-1时, 二者的差值达到最大, 罗丹明110的浓度再增大, 荧光背景增大, 二者的差值又逐渐减小, 因此, 选择0.5 μ mol· L-1的罗丹明110作为最佳实验条件。
2.4.2 体系酸度的优化
分别测试了不同酸度条件下, 体系的吸光度和荧光强度的差异, 结果如图4(b)所示。 表明pH值较低时, 利于罗丹明110的质子化, 其与AuNPs的作用力大, 不利于农药分子与罗丹明110在AuNPs表面的竞争, 因此, 体系的吸光度值(A650/520)较低, 荧光强度也比较弱。 随着pH值的增大, 吸光度和荧光强度均逐渐升高; 当溶液的pH超过7.5后, 体系的荧光强度有一定的下降, 可能是罗丹明110分子羧基中氢离子解离的缘故, 如图4(b)所示。 因此, 确定实验的最合适pH为7.5。
2.4.3 反应时间的优化
在最合适pH和浓度条件下, 分别改变目标物, 罗丹明110与金纳米作用时间, 测试溶液的吸光度和荧光强度的变化, 如图4(c)所示。 结果表明, 目标物与金纳米作用时间为60 min; 罗丹明110与金纳米作用时间30 min的情况下, 吸光度和荧光强度达到最佳。
2.5.1 农药残留的比色分析
选取辛硫磷为模型分析物, 验证基于纳米金比色传感策略的检测效果, 图5(a)是不同浓度的辛硫磷存在时, 溶胶的吸收曲线, 插图为相应浓度的目标物导致的溶液颜色的变化情况。 由图5(a)可知, 随着目标物浓度的增大, 520 nm处吸光度逐渐降低, 表现为从a到f颜色由酒红色逐渐转变为蓝紫色。 在0.05~10 μ mol· L-1浓度范围内, 溶液在650 nm处与520 nm处的吸光度比值, 即(A650/A520)与目标物浓度之间有良好的线性关系, 如图5(b)所示。 线性回归方程: A650/520=0.073c+0.083(A650/A520: 波长650与520 nm处吸光度比值; c: 目标物浓度, μ mol· L-1), 相关系数为0.997, 检出限为15 nmol· L-1。
2.5.2 农药残留的荧光分析
在最佳实验条件下, 测试了不同浓度模型化合物与溶液荧光强度的变化关系, 如图5(c)所示。 可以看出体系的荧光强度随着目标物浓度的增加辐逐步增大。 在目标物浓度从0.01~5 μ mol· L-1的范围内, 体系的荧光强度和目标物浓度之间存在良好的线性关系, 如图5(d)所示。 线性回归方程: I=26.60c+ 6.82(I: 荧光强度; c: 目标物浓度, μ mol· L-1), 相关系数为0.994, 检出限为4 nmol· L-1。
2.5.3 干扰实验
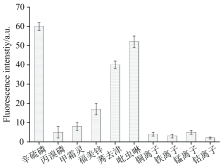
由于实际样品中可能有多种成分同时存在, 因此, 进一步研究其他的类似物如马拉硫磷, 丙溴磷, 甲霜灵, 福美锌, 莠去津和吡虫啉等农药存在时, 体系荧光的变化情况, 结果图6所示。 所有农药浓度均为2.0 μ mol· L-1, 可以看出, 该传感器对辛硫磷、 吡虫啉和莠去津的响应较好, 对丙溴磷和甲霜灵响应较差。 分析其分子结构可以得出, 响应好的农药分子具有较多的氮、 氧和硫原子, 但是福美锌分子同样具有较多的硫原子, 荧光响应一般, 可能是由于福美锌分子中的氮原子与锌形成了配位键, 导致其与金纳米表面作用力较弱的缘故。 同样测试了部分金属离子共存时, 体系的荧光响应情况, 结果表明, 金属离子几乎不影响体系的荧光, 可能是由于溶液中共存的金属离子经过样品预处理时, 与吸附剂中N-丙基乙二胺(PSA)的发生了配位结合而被去除的缘故。
在最佳实验条件下, 将该双模式传感器的荧光检测策略用于市场购买的生姜和天然水中农药残留量的测定。 新鲜生姜使用QuEChERS方法处理, 步骤如下: 取市售新姜10.000 0 g, 捣碎, 加入10 mL含1%醋酸的乙腈溶液和1 g醋酸钠, 摇匀后加入1 g氯化钠和4 g无水硫酸钠趁热剧烈震荡1 min, 以7 000 r· min-1离心5 min。 取上清液 5.00 mL, 加入0.25 g PSA, 0.25 g C18(碳18), 0.1 g GCB石墨化碳黑和6.25 g无水硫酸镁, 再次以7 000 r· min-1离心2 min, 取上清液待测。 天然水样取之青岛农业大学校园内虹子湖, 水样经0.45 μ m的滤膜过滤后, 待测。
在以上处理好的生姜提取液和水样中, 分别加入浓度为0.2和2 μ mol· L-1的辛硫磷, 混合均匀进行检测, 每个浓度进行6次重复的实验, 实验结果如表1所示。 与天然湖水相比, 生姜处理液的加标回收率检测结果偏差稍大, 可能与生姜处理液的成分相对复杂有关。 研究表明本方法具有良好的抗干扰能力, 可以用于实际样品的测定。
| 表1 生姜和天然水中辛硫磷残留的测定 Table 1 Determination of pesticide residues in ginger and natural water |
以柠檬酸为还原剂合成金纳米粒子, 设计与荧光染料罗丹明110发生内滤光效应, 导致金纳米对罗丹明110的荧光猝灭。 以辛硫磷农药为模型, 构建了比色和荧光双模式农药残留传感器。 通过目标物与金纳米粒子相互作用, 引起溶液吸光度与荧光强度变化, 实现了对辛硫磷农药残留的高灵敏检测, 并用于实际样品的测定。 相对于以往单一信号识别, 实现了农药残留检测双信号输出, 将在很大程度上避免假阳性出现的可能。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|