作者简介: 冷俊强, 1997年生,烟台大学化学化工学院硕士研究生 e-mail: 1974161019@qq.com
生物体的安全与健康一直备受关注, 金属离子存在于生物体内, 并对生物体的健康与疾病有着重要的影响。 人体内环境复杂, 金属离子在人体内具体的作用机理尚不清楚, 因此寻找一种方法可以实现对人体内金属离子的检测对于探索它们在人体内的作用具有重要意义。 分子荧光探针一般由识别基团、 荧光基团和连接基团三部分组成, 主要是利用探针识别基团与金属离子作用, 改变荧光探针的结构, 从而引起荧光性质的变化来检测金属离子。 这些荧光性质的变化涉及到不同的荧光机理, 比如光诱导电子转移机理, 荧光由于光诱导电子转移机理会出现荧光猝灭现象, 可以根据这个机理设计开-关或者关-开型荧光探针; 分子内电荷转移机理由于探针与检测物反应会引起红移或者蓝移, 适合比率型荧光探针的设计。 荧光成像技术因对检测物具有特异的高灵敏识别能力和能够在生物体内实时监测的优点得到了迅速发展, 已经广泛应用于生物体内活性物质的检测, 大量的金属离子探针也被报道。 本文主要根据检测不同种类的常见金属离子如铜离子、 铁离子、 锌离子、 汞离子等, 对他们在生物体中含量作用等做了研究。 综述了检测铜离子的胆固醇类探针、 新型开启式近红外荧光探针, 基于氧化还原特性及把具有独特的Fe2+脱氧作用的N-氧化物基团连接到荧光团上以特异性识别Fe2+机理设计检测铁离子荧光探针, 基于硫羧醛的脱保护反应构建检测汞离子荧光探针, 基于分子内电荷转移荧光共振能量转移效应的锌离子荧光探针, 检测镁离子的喹啉类荧光探针、 检测镉离子的吩恶嗪类荧光探针以及检测铬离子、 锡离子等各类荧光探针, 综述了近三年检测金属离子的不同种类荧光探针的优缺点、 设计机理、 作用机制、 研究进展及生物应用并对未被检测金属离子的荧光探针做了展望。
The safety and health of organisms have always been a concern. Metal ions exist in organisms and have an important impact on the health and disease of organisms. However, the human body environment is complex, and the specific mechanism of metal ions in the human body is still unclear. Therefore, finding a way to detect metal ions in the human body is of great significance for exploring their role in the human body. Molecular fluorescent probes are generally composed of three parts: recognition group, fluorescent group and linking group. It mainly uses the interaction between the probe recognition group and metal ions to change the structure of the fluorescent probe, thereby causing changes in fluorescence properties to detect metals ion. The changes in these fluorescence properties involve different fluorescence mechanisms, such as the photo-induced electron transfer (PET) mechanism. Fluorescence will appear fluorescence quenching phenomenon due to the PET mechanism, and on-off or off-on fluorescent probes can be designed according to this mechanism; The intramolecular charge transfer (ICT) mechanism is suitable for the design of ratiometric fluorescent probes due to the red-shift or blue-shift caused by the reaction between the probe and the detector. Fluorescence imaging technology has developed rapidly due to its specific and high-sensitivity identification ability and the advantages of real-time monitoring in vivo. It has been widely used in detecting active substances in vivo, and many metals ion probes have also been reported. This paper is mainly based on detecting different types of common metal ions such as copper ions, iron ions, zinc ions, mercury ions, etc., to study their content in the organism. Cholesterol probes and novel open-type near-infrared fluorescent probes for the detection of copper ions are reviewed, based on redox properties and the mechanism of linking N-oxide groups with unique Fe2+ deoxygenation to fluorophores to specifically recognize Fe2+. Design a fluorescent probe for detecting iron ions, construct a fluorescent probe for detecting mercury ions based on the deprotection reaction of thiocarboxaldehyde, fluorescent probes for zinc ions based on ICT and ESIPT effects, quinoline fluorescent probes for detecting magnesium ions, and fluorescent probes for detecting cadmium ions The advantages and disadvantages, design mechanism, mechanism of action, research progress and biological properties of different types of fluorescent probes for detecting metal ions in the past three years are reviewed. Application and prospect of fluorescent probes for unmonitored metal ions.
金属离子由于其对人类健康的影响而引起了人们的广泛关注[1, 2]。 金属离子会影响人体正常的生理功能, 引发疾病甚至危及生命。 因此, 对人体内各类金属元素的检测, 有利于了解人体内的金属元素参与生理活动的作用机理及其含量。
现常用检测金属离子的技术包括原子吸收光谱法(atomic absorption spectroscopy, AAS)[3]、 原子荧光光谱法(atomic fluorescence spectrometer, AFS)[4]、 电感耦合等离子体质谱法(inductively coupled plasma mass spectrometr, ICP-MS)[5]和高效液相色谱法(high performance liquid chromatography, HPLC)[6]、 电化学法、 比色法等[7, 8], 虽然这些方法能较为准确地检测出金属离子的含量, 但AAS测定难溶元素的灵敏度不高且测定每种元素都需要一个特定元素的设备, 这对同时测定试样中多种元素颇为不便。 此外, 不能反映所测元素的价态。 ICP-MS法和HPLC法所需仪器昂贵, 样品预处理复杂, 操作也比较繁琐。 总之传统检测的方法存在设备精准度要求严格、 成本较高, 选择性较低等, 不适用于在生物体内在线检测金属离子, 不能描述所测金属离子在细胞内的分布和动态变化[9], 所以在检测生物中铜离子、 铁离子、 汞离子等金属离子过程中较为困难。 因此, 开发一种低成本且高效检测细胞中金属离子的方法具有重要的研究意义。
近年来, 荧光成像技术因对检测物具有特异的高灵敏识别能力和能够在生物体内实时监测的优点得到了迅速发展, 已经广泛应用于生物体内活性物质的检测, 大量的金属离子探针也被报道[10]。 分子荧光探针一般由识别基团、 荧光基团和连接基团三部分组成。 常见的分子荧光基团有: 氟硼二吡咯[11]、 罗丹明[12]、 荧光素[13]、 香豆素[14]、 花菁素[15]等。 荧光探针识别基团与金属离子作用, 改变荧光探针的结构, 从而引起荧光性质的变化, 通过各种识别机理实现对被检测物的分析。 常见的荧光探针识别机理主要包括: 光诱导电子转移(photo induced electron transfer, PET)[16]、 分子内电荷转移(intramolecular charge transfer, ICT)[17]、 荧光共振能量转移(fluorescence resonance energy transfer, FRET)[18]、 激发态分子内质子转移(excited-state intramolecular proton transfer, ESIPT)[19]等。 表1列出了金属离子荧光探针的相关参数。
| 表1 金属离子荧光探针的相关参数 Table 1 Related parameters of metal ion fluorescence probe |
荧光探针[20]可以通过细胞成像实现对生物体内金属离子的检测, 本文主要总结了近三年来检测金属离子的分子荧光探针的设计与应用展望。 高灵敏度、 高特异性、 有较好水溶性且可实时检测生物体内金属离子的分子荧光探针将进一步揭示金属离子在生物体内的作用。
铜是人体必需的金属元素[44], 是多种金属酶的催化辅因子, 在生物体内发挥着关键作用[23, 45]。 如果铜含量异常会引起人体内各种神经系统疾病[46, 47, 48], 对人体健康有害, 严重损害肾脏和人体其他器官等[49, 50]。 近年来, 报道了多种检测活细胞中铜离子的方法[51], 这有助于了解铜离子对人体健康和病理状态的复杂作用, 对疾病的预防和早期诊断具有重要意义。
2019年, Yi等[21]研究了一种锌(Ⅱ)卟啉衍生物(ZPSN)探针1(图1), 该探针能快速、 高选择性、 可逆地与Cu+结合, 用于Cu+的荧光检测。 检测机制是Cu+将吡啶配体与锌中心之间的轴向配位破坏, 改变分子几何结构, 抑制分子内电子转移, 从而使探针红色荧光增强。 该探针能穿透活细胞, 在活细胞线粒体中定位和检测Cu+, 具有在生物系统特异性检测Cu+的能力。
 | 图1 探针1结构图和HeLa细胞中Cu+的共焦荧光成像[21]Fig.1 Molecular structure of probe 1and Confocal fluorescence imaging of Cu+ in HeLa cells[21] |
胆固醇作为一种生物两亲性物质, 是哺乳动物细胞膜的重要组成部分。 基于胆固醇与膜脂的同质性, Ting等[22]设计并合成了一种胆固醇共轭荧光探针2(图2), 该探针具有良好的细胞膜通透性, 可用在生物细胞中检测Cu2+。 探针对Cu2+基于可逆配位, 与铜离子螯合物形成开环复合物。 探针本身没有明显的荧光强度, 一旦暴露于Cu2+, 荧光增强, 出现强发射带。 Cu2+触发的荧光图像呈现了胆固醇的位置, 这表明探针2在追踪细胞中的胆固醇方面有潜在的用途。
Wu等[23]建立了一种新型的荧光探针3(图2), 该探针以2-吡啶羧酸盐为基础, 以7-羟基-4-甲基香豆素为荧光团, 基于Cu2+对吡啶羧酸位点的水解用于检测Cu2+。 探针3的荧光强度在0~16 μmol·L-1范围内与Cu2+浓度呈线性关系, 检出限为62 nmol·L-1, 随着浓度增加, 发光强度提高。 为检测生物体内的Cu2+提供了一种方法。
尽管有一些近红外荧光探针被报道可检测Cu2+, 但仍有一些挑战需要克服, 例如, 荧光响应时间较长[52], 检出限较高, 选择性低, 光稳定性差, 应用在细胞或生物体内毒性无法预测等。 因此, 开发新型的开启式近红外荧光探针对Cu2+的选择性、 灵敏、 快速检测具有重要意义。 Shen等[24]设计并合成了一种基于吩恶嗪的新型开启近红外荧光探针PZ-N(探针4)(图2)。 检测机制是Cu2+与PZ-N的酰胺部分结合形成一个高度不稳定的四元环, 然后, 一个水分子攻击羰基的碳原子, 导致四元环断裂, 生成不稳定的氨基甲酸。 最后, 氨基甲酸释放HCO2-生成不稳定的中间体, 该中间体将快速生成荧光团。 当加入Cu2+后, 探针能迅速与Cu2+反应, 发出强烈的荧光, 颜色由无色变为明显的蓝色。 反应时间较短而且效果明显, 解决了一些近红外荧光探针反应慢、 选择性低等问题。 该探针对活细胞中Cu2+的检测具有较低的细胞毒性和较高的特异性, 可用于生物体内Cu2+的检测。
铁是人体内最丰富的必需过渡金属离子, 在生物和环境系统中起着重要作用[53]。 二价铁离子的缺失会限制细胞供氧, 导致疲劳、 工作表现差和免疫力下降[54]。 三价铁离子的过量和不足都会导致各种疾病, 如心力衰竭、 肝肾损伤和糖尿病[49]。 近年来, 高效、 快速、 易操作的测量生物体内铁离子的荧光探针被不断报道, 对探索铁离子在生物体内的作用, 维护人类生命安全具有重要作用。
基于氧化还原响应特性, Gao等[25]构建了一种Fe2+荧光探针5(图3)。 探针包含一个荧光团(丹酰基酸)和Fe2+还原官能团(N-氧化物)。 在丹酰荧光团中引入N-氧化物基团, 由于π-共轭效应, 系统的荧光被猝灭。 Fe2+诱导的脱氧作用可以很容易和选择性地将N-氧化物切割成丹氨酸, 然后增强分子内电荷转移, 从而实现荧光恢复。 该探针对Fe2+具有高选择性, 表现出开启的荧光响应现象, 检出限为18 nmol·L-1。 而且, 该探针细胞毒性低, 可用于细胞成像研究Fe2+的生理作用。 Khatun[30]等开发了基于含氮氧化物的开启式荧光探针6(图3), 该探针具有高度的化学选择性, 在Fe2+存在时才响应荧光增强。 而且在缓冲液中加入三苯基膦离子, 大大提高了其溶解度, 增加了无毒探针6检测活细胞中不稳定Fe2+的能力。
把具有独特的Fe2+脱氧作用的N-氧化物基团连接到荧光基团上以特异性识别Fe2+的荧光探针获得了理想的结果。 Hirayama等[27]设计并合成了一种高度灵敏且稳定的荧光探针7(图3)。 探针中存在带有吸电子基团的哌嗪O-氧化物和一个哌嗪4位上的疏水性酰基增强了荧光探针的动力学特性和开/关对比度。 该探针在活细胞中对Fe2+高度敏感的反应和信号检测能力, 为铁稳态系统的生物学或生理学研究提供生物活性化合物和新的治疗靶点。 Hirayama等[28]开发了一种荧光探针8(图3)。 用于高尔基体特定的Fe2+检测。 二价金属转运蛋白1(DMT1)是Fe(Ⅱ)离子的主要转运蛋白。 使用该探针进行的成像结果表明DMT1运输机制的损害会影响亚细胞铁稳态, 使用新的以细胞器为靶点的Fe2+探针的互补成像方法显示DMT1的错误分选导致细胞内铁的异常分布。 检测不稳定Fe2+的荧光探针是研究铁稳态与膜运输和脑铁积聚神经退行性变NBIA相关的致病基因之间关系的有力工具。
基于分子内电荷转移效应, Ravichandiran等[29]成功合成了一种萘醌型荧光探针9(图4), 该探针用于Fe2+的选择性检测, 对Fe2+的检出限为0.272 μmol·L-1, 能够在各种金属离子中检测Fe2+。 探针分子内电荷转移(ICT)过程是通过共轭发生的, 与Fe2+反应后从浅褐红色变为浅黄色。 以探针9对癌细胞和斑马鱼中的Fe2+进行了成像, 可用于临床诊断中精确检测Fe2+的生物标记。
检测Fe3+探针也很多, 包括BOD-NHOH[55]、 RhB-EDA[56]等, 主要介绍一种检测 Fe3+的罗丹明型荧光探针10(图5)被报道[30], 该探针通过罗丹明和杂化铬氰酸形成螺内酯结构, 探针本身无荧光, 与Fe3+配位后由于螺内酰胺环被打开生成红色荧光, 该探针对Fe3+有很高的灵敏度, 可以用来测定生物体内Fe3+的含量。
汞是毒性最大的重金属之一, 它很容易与生物体中的巯基结合[57]。 汞及其衍生物通过食物链累积, 在体内长期存在, 具有生物富集效应[58, 59, 60], 它在人体内的生物累积趋势会导致中央神经系统功能障碍、 人体生理慢性中毒和水俣病等[61]。 虽然已有许多Hg2+的检测方法[62], 但由于高灵敏度和窄线性范围难以同时满足宽视场的检测要求[63], Mehta综述了多种可检测汞离子的荧光探针[64], 有利于环境监测和生物医学领域发展。
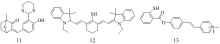
Hg2+引起硫缩醛脱保护反应为探针的设计提供了一种方案。 Wang等[31]基于天然和可再生樟脑构建了一种荧光开启探针11(图6)用于检测Hg2+。 由于Hg2+引起的硫缩醛的脱保护反应, 只有在Hg2+的参与下, 才能观察到明显增强的绿色荧光。 该探针对Hg2+的响应非常灵敏, 对Hg2+表现出比其他竞争性金属离子更高的特异性。 将探针11制成涂层测试条可快速轻松地观察Hg2+的存在, 用于肉眼检测Hg2+, 而且探针可以用作可视化活细胞中Hg2+的生物标记。
以一个七甲基花氨酸荧光团和一个巯基反应基团为基础, Wang等[32]设计并合成了探针12(图6)。 用于Hg2+的相关检测, 探究急性汞暴露与慢性汞暴露之间的差异。 已知HgS的Ksp为3×10-52, —SH基团稳定, 倾向于与Hg2+结合, 并作为Hg2+的响应位点。 鉴于三通道比值荧光探针的巨大优势, 用七甲基菁染料作为荧光团。 此外, 荧光团还有很大的优点, 荧光团的介观位置有利于取代—SH形成新的探针。 该探针可用于HEK 293细胞株(人体胚胎腺细胞)和小鼠模型的汞中毒检测。 通过该探针发现, Hg2+无论急性汞暴露还是慢性汞暴露, 主要积累在肾脏。 该探针是一种潜在的汞暴露准确诊断和疗效评价的候选探针。
基于Hg2+触发酯水解, 而且带正离子的荧光团会促进酯的水解。 Zhang等[33]研发了一种新型的开启式荧光探针13(图6), 该探针在线性范围为2~16 μmol·L-1, 对Hg2+的检测极限为6.5 nmol·L-1。 该化合物显示出明显的分子内电荷转移(ICT)观察到黄绿色荧光, 为探究生物体内Hg2+的生理作用提供了一种方案。
利用单一传感器从生物和环境样品中同时检测和解毒Hg2+的策略是有限的, 迄今为止还没有在活生物体中实现。 面对这一问题, Malek等[34]报道了一种高选择性小分子开启荧光探针14(图7), 用于同时检测和解毒无机汞。 探针14与Hg2+反应时, 传感器中的C—S键发生裂解。 这导致荧光探针的开启响应, 同时释放一种相当于水溶性Hg2+—二巯基琥珀酸的复合物, 从而产生同步解毒效果。 该传感器本身对培养细胞无毒, 并已被用于监测活细胞和斑马鱼幼虫对Hg2+的实时吸收。
锌离子是生物体中第二丰富的过渡金属离子, 也是人体100多种酶的主要成分[65, 66]。 锌离子是DNA聚合酶的重要组成部分, 缺锌会导致蛋白质合成困难, 从而引发各种疾病, 如侏儒症、 帕金森病、 阿尔茨海默病及缺血性中风[67]等。 此外, 锌离子在人体的各种基本生物过程中起着关键作用, 不仅可以清除胆固醇, 防止动脉粥样硬化, 而且可以预防癌症[68]。 锌离子的荧光探针对探究锌离子在人体内的生理作用具有重要意义。
基于ICT和ESIPT效应, Wang等[35]合成了一种基于亚胺简单受体用于检测锌离子的荧光探针15(图8), 该探针的开启荧光归因于分子内电荷转移以及激发态分子内质子转移的中断, Zn2+与亚胺和—OH基团的结合更强, 参与了ICT机制, 导致荧光发射有较大的红移, 可观察到明显的光物理变化, 而且不受竞争离子的干扰。 该探针对细胞的毒性很低, 可用于活细胞中的Zn2+成像, 有效地检测HeLa细胞中的Zn2+。
一些关于锌的荧光传感器已经在活细胞中被报道。 然而, 寻找具有良好水溶性和高特异性的可接近荧光Zn2+传感器仍然是一项具有挑战性的工作。 为此, Liu等[69]以亚氨基乙酸和亚氨基乙氧基乙酸为受体, 制备了一种新型水溶性4-氨基-1, 8-萘酰亚胺荧光探针16(图8)。 在生理pH条件下, pH敏感性较低且具有良好的水溶性, 探针在Zn2+的作用下基于光诱导电子转移(PET)表现出优异的荧光增强, 该探针成功应用于活细胞中Zn2+的荧光成像, 为检测生物内的Zn2+提供了一种方法。
近年来, 基于波长变化响应的荧光探针受到了相应研究人员的青睐和高度关注。 为了获得荧光波长变化的探针, 关键是设计和制备具有推拉结构的分子。 基于此, Kang等[37]设计了一种由香豆素和喹啉组成的荧光探针17(图8), 并通过酰基肼键合的方式合成。 由于该探针具有推拉结构, 对Zn2+具有较高的灵敏度, 荧光有明显的红移和可见的颜色变化。 探针对Zn2+的检测几乎不受其他离子的干扰, 并且基于分子内的电荷转移过程是可逆的。 可用于检测生物体内的Zn2+。
镁离子参与许多生理活动如细胞膜稳定、 三磷酸腺苷(ATP)利用率, 核苷酸的稳定, 细胞增殖[70, 71]。 镁离子含量异常可导致多种疾病, 如低钙血症、 高镁血症、 代谢综合征、 高血压、 恶心、 腹泻等[72, 73]。 基于分子间光诱导质子转移(PPT)原理, Fu等[38]合理设计了一种基于喹啉的荧光探针18(图9)来检测Mg2+, 其中8-羟基喹啉不仅是一个荧光基团, 而且是一个识别基团, 通过苯并噻唑基团修饰, 可以有效改善8-羟基喹啉分子间光诱导质子转移过程引起的微弱发光性能。 探针与Mg2+形成络合物后, PPT过程被抑制, 可以实现对Mg2+荧光比率变化的检测。 该探针显示出两种用于Mg2+高度选择性检测的荧光响应模式, 即荧光比率模式和开启模式, 加入Mg2+后, 溶液的颜色从无色变为黄色。 探针对Mg2+具有很高的选择性, 检测限低至0.142 μmol·L-1, 该值远低于细胞内浓度(0.5~1.2 mmol·L-1)。 该探针成功地用于检测和成像活细胞中的Mg2+, 表明该探针在检测Mg2+方面具有实际应用价值, 有利于开发其他分析物的荧光探针。
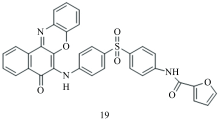
镉[74]可引起急性和慢性中毒, 并增加多种癌症、 肾功能障碍和钙代谢紊乱的发病率[75]。 Ravichandiran等[39]合成一个简单的基于吩恶嗪的荧光探针19(图10)用于检测Cd2+。 该探针是通过将呋喃-2-羧酰胺基团添加到吩恶嗪荧光团和苯基磺酰基螯合位点而合成的。 该探针对Cd2+具有荧光开启效应, 检出限为0.60 μmol·L-1。 该探针可用于检测活细胞和斑马鱼幼虫中的Cd2+。
钯是重要的多功能过渡金属元素, 在生理过程中发挥着举足轻重的作用[76]。 但过量摄入钯会伤害人体组织器官, 导致人类疾病和生理功能紊乱[77]。 开发简单有效、 快速简捷、 高选择性和高灵敏度的方法检测生物体内的钯离子对探究钯离子的生理作用尤为重要。 基于光诱导转移(PET)原理, Chen等[40]设计并合成了一种用于检测钯的v型双香豆素催化荧光探针20(图11)。 加入钯后, 探针的荧光增强。 基于钯催化的Tsuji-Trost反应过程和 PET机理, 探针能够在不同条件下区分和检测不同价态的钯。 该探针的检出限低至40.0 nmol·L-1, 具有良好的选择性和较高的灵敏度。
锡是影响人体健康的重要元素, 有助于人体肌肉的发育, 维持身体稳态, 在核酸和蛋白质的合成中起着有效的催化剂的作用[78], 并阻止癌细胞在人体内扩散。 缺乏锡会导致听力丧失、 呼吸困难和血红蛋白生成不足, 大量的锡积累会损害活细胞, 导致肺和胃系统疾病。 Palanisamy等[41]合成了一种比色荧光探针21(图12)用来对Sn2+进行选择性、 灵敏性检测。 其传感机制是在Sn2+的作用下, 探针21中的碳氧键被还原成碳羟基, 从而启动荧光开启模式。 在0.6~2.5 μmol·L-1范围内, 探针21的荧光强度与Sn2+浓度呈良好的线性关系, 对Sn2+的检出限为0.115 μmol·L-1。 该探针能有效的检测活细胞和斑马鱼中Sn2+, 能够区分人类癌细胞和正常活细胞中的Sn2+。
铬离子通过激活某些酶, 对碳水化合物、 蛋白质、 脂肪和核酸的代谢具有重要作用[79], 可作为转录因子和DNA复制过程的抑制剂。 但是铬离子可能导致基因毒性作用, 被认为是人类致癌物质。 Susanta等[42]研制了一种罗丹明荧光探针22(图13), 通过荧光共振能量转移(FRET)过程检测Cr3+, 为探究Cr3+在生命体的生理作用提供了一种方法。 该探针具有较好的灵敏度, 检测限低至1.81×10-6 mol·L-1, 关联常数为15.9×104 L·mol-1, 并且具有高选择性, 不受其他离子的干扰。
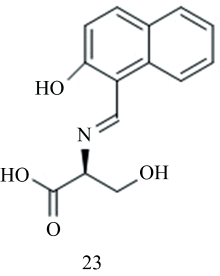
镓是一种稀有元素, 当镓浓度高时, 干扰铁代谢, 引起睾丸毒性。 然而, 低剂量镓离子及其复合物对肿瘤靶向具有高亲和力[80], 在临床实践中经常被用作恶性肿瘤、 难治性高钙血症等相关疾病的治疗药物[81]。 Yan等[43]利用2-羟基-1-萘醛与L-丝氨酸的席夫碱反应, 设计并制备了一种简单的检测Ga3+荧光探针23(图14)。 根据该探针的荧光变化可有效监测Ga3+, 光诱导电子转移(PET)过程和激发态分子内质子转移(ESIPT)过程的抑制是该探针荧光增强的主要原因。 该探针在其他金属离子和常见阴离子存在的情况下对Ga3+具有较高的特异性, 关联常数为7.63×103 L·mol-1, 检测限(LOD)为0.11 μmol·L-1。 该探针具有良好的细胞通透性, 能够检测活细胞中的Ga3+。
荧光探针具有灵敏度高、 可用于生物成像检测生物体内的金属离子等特点引起了人们的广泛关注。 本文主要综述了近三年金属离子荧光探针的设计合成与生物应用进展, 按检测不同的金属可将探针分为: 检测铜离子、 铁离子、 锌离子、 汞离子、 其他金属离子的荧光探针, 其中主要的荧光基团包括氟硼二吡咯、 荧光素、 香豆素、 花菁素等, 探针根据不同识别机理如光诱导电子转移、 分子内电荷转移、 激发态分子内质子转移而作用机理不同。 这些探针在细胞成像上的应用有助于了解金属离子在生物体生命活动中的重要意义。 由于金属离子的性质各不相同, 目前检测金属离子的荧光探针并不全面, 还有多种金属离子不能通过荧光探针的方法检测, 因此还需要不断设计新的荧光探针来检测那些未被报道的金属离子。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|