作者简介: 胡 斌, 1989年生, 浅水湖泊综合治理与资源开发教育部重点实验室(河海大学)讲师 e-mail: hubin@hhu.edu.cn
环境条件的变化能够影响和改变溶解态有机质(DOM)的组成结构及化学特征, 进而影响其生物地球化学循环过程。 采用同步荧光光谱、 三维荧光光谱、 傅里叶变换红外光谱(FTIR), 结合二维相关光谱分析方法, 研究了pH条件变化对DOM特性及其与Cu2+相互作用的影响。 结果表明, (1)随着pH值由5逐渐升高至10, DOM不同组分的荧光强度显著增强, 其中类腐殖酸组分变化最显著, 类富里酸组分变化最优先, 这是由于pH的变化引起的醛酮、 酚基、 羧基等相关基团暴露导致的。 (2)荧光光谱二维相关分析表明, pH的改变能够显著地影响DOM不同组分与Cu2+的结合能力, 但并不能影响其结合顺序。 三维荧光光谱结合平行因子分析共解析出3个荧光组分, 荧光组分的淬灭曲线非线性拟合结果更是定量验证了这一结果。 (3)FTIR结果表明高pH条件下DOM与Cu2+结合点位更多, 结合强度更强。 pH 5和pH 10条件下DOM官能团与Cu2+的结合顺序分别依次为: 多糖C—O>酚基>醛酮C=O>芳香族C—H和多糖C—O>酰胺Ⅱ带C—N>酚基>脂肪族C—H>醛酮C=O>羧基C—OH>芳香族C—H>羧基C=O。 荧光光谱和FTIR的异谱二维相关分析进一步表明Cu2+与DOM类腐殖酸组分的相互作用滞后于酚基和芳基等基团。
Changes in environmental conditions could alter the composition structure and chemical properties of dissolved organic matter (DOM), then affect its biogeochemical cycling processes. In this study, synchronous fluorescence spectroscopy, three-dimensional fluorescence spectrum, and Fourier transform infrared spectroscopy (FTIR) combined with two-dimensional correlation spectroscopy were applied to evaluate the effect of pH on DOM characteristics and its interaction with Cu2+. (1) Our results suggested that the fluorescence intensity of different DOM components increased remarkably along with the pH value increasing from 5 to 10. Humic-like components showed the most significant changes, and fulvic-like components responded fastest to pH changes. It was caused by pH changes induced exposure of some functional groups, such as carbonyl, phenolic, and carboxyl. (2) Two-dimensional correlation analysis of fluorescence spectra revealed that changes in pH could significantly affect the Cu2+-binding capacity of different DOM components but could not affect the binding sequence to Cu2+ with DOM. Three fluorescent components were identified by parallel factor analysis of the three-dimensional fluorescence spectrum. The nonlinear fitting of quenching curve for fluorescent components quantitatively verified our results. (3) FTIR results showed that, under hinger pH conditions, DOM has more binding sites and stronger binding affinities with Cu2+. The structural change of DOM upon Cu2+ addition under pH 5 and 10 conditions followed the order ofpolysaccharide C—O>phenols>aldehyde and ketone C=O>aromatic C—H and polysaccharide C—O>amide II C—N>phenols>aliphatic C—H>aldehyde and ketone C=O>carboxyl C—OH>aromatic C—H>carboxyl C=O, respectively. Furthermore, two-dimensional hyperspectral correlation analysis of fluorescence spectra and FTIR indicated that humic-like fractions of DOM participated in the Cu2+binding after the phenolic and aryl groups.
溶解态有机质(dissolved organic matter, DOM)是环境中普遍存在的重要物质之一, 其能够影响氮磷和重金属等污染物的溶解性、 迁移转化和生物可利用性等生物地球化学过程, 具有重要的生态和环境意义。 pH等环境条件变化、 微生物作用、 光化学反应等一系列环境行为能够影响和改变DOM的组成结构及化学特征, 进而影响污染物的迁移转化和生物有效性[1, 2, 3]。 例如, pH能够对DOM的光降解过程产生不同程度的影响[2, 4]。 自然水环境中风化矿化、 生物降解、 降雨和藻类生长等对水体pH有一定程度的影响[5, 6]。 已有的研究表明pH条件的变化能够对DOM结构组成及其荧光特性产生不同程度的影响[7]。 有研究发现, pH对南明河DOM不同组分的荧光峰强度都有影响, 随着pH的升高(2.0~10.0)荧光强度总体呈增大趋势。 然而, 目前关于pH变化对DOM与重金属相互作用的影响机制尚不清晰。
DOM通常由腐殖酸(HA)、 氨基酸、 脂肪族与芳香烃类物质组成, 结构异常复杂, 常规的分析手段很难揭示各组分相应丰度及组成结构。 由于光谱吸收能够定性、 定量揭示DOM浓度、 组成成分及结构等特征, 比如紫外可见光吸收光谱能够半定量表征DOM的浓度及结构组成[8, 9]; 荧光光谱能够定性、 半定量揭示DOM的浓度、 组成成分、 来源[10, 11]; 傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)则能够定性揭示DOM的官能团结构, 近年来常被用于不同水环境生态系统中DOM的地球化学过程研究[12, 13]。 二维相关光谱(two-dimensional correlation spectroscopy, 2D-COS)能够将外部扰动(如浓度、 时间、 pH等)产生的动态光谱扩展到两个维度, 进而判断不同组分的变化顺序[8, 14]。 2D-COS异谱相关则可以研究不同波段的相关性, 并对扰动引起的结构变化给出互补关系[12, 13]。 Cu是水体中常见的重金属且其生物可利用性比重较高, 对水生生物影响较大。 本研究采用同步荧光光谱和傅里叶红外光谱, 结合2D-COS分析方法, 探讨pH条件变化对DOM特性及其对与Cu2+相互作用的影响, 为进一步了解自然环境中DOM的生物地球化学过程提供一定的科学依据和研究基础。
将1 g美国Sigma-Aldrich公司的腐殖酸溶于1 L的0.1 mol· L-1NaOH溶液中得到1 g· L-1的DOM储备液, 置于4 ℃冷藏柜中避光保存。 将一定量的Cu(NO3)2溶于100 mL的Milli-Q超纯水中获得0.02 mol· L-1的Cu2+储备液, 置于4 ℃冷藏柜中避光保存。
太湖和洪泽湖表层水体DOC含量范围分别为2.2~8.7 mg· L-1 [15]和12.6~16.9 mg· L-1 [11], 设置实验DOM浓度为10 mg· L-1。 天然地表水的pH值通常在6~9之间, 设置不同pH为5、 6、 7、 8和10。 使用1 mol· L-1的HCl和NaOH溶液调节DOM溶液的pH, 使用0.22 μ m聚醚砜树脂滤膜过滤后分别装入40 mL棕色玻璃管中, 分别滴加不同梯级的0.02 mol· L-1 Cu2+储备液, 使不同pH条件下DOM溶液中Cu2+浓度分别为0、 5、 10、 15、 20、 30、 40、 50、 75、 100、 150、 200和250 μ mol· L-1, 最后置于25 ℃间歇式恒温震荡仪中避光震荡反应24 h, 经0.22 μ m滤膜过滤后立即测定光谱。
使用日本Hitachi公司的F-7000荧光光度计测定Cu2+添加前后样品的荧光光谱, 光源为150 W连续输出氙弧灯。 同步荧光光谱测定为同步模式, 激发波长范围为275~540 nm, 设定发射波长与激发波长的恒定间隔为60 nm。 使用Milli-Q超纯水作为空白样品进行校准并归一同步荧光光谱的荧光强度。 选定特征峰345和468 nm分别代表类富里酸(F345)和类腐殖酸(F468)[12]。 将Cu2+浓度作为外扰因素, 采用“ 2D shige” 软件建立同步和异步二维相关光谱[16]。
三维荧光光谱测定激发波长范围为235~450 nm, 步长5 nm, 发射波长范围为250~600 nm, 步长1 nm。 使用Milli-Q超纯水作为空白样品用于消除水拉曼效应造成的荧光光谱拉曼峰。 使用MATLAB软件采用平行因子分析法对三维荧光光谱进行解析[8], 并使用Ryan-Weber模型对解析出的不同组分荧光淬灭曲线进行非线性拟合[17], 以评估DOM不同组分与重金属Cu2+的相互作用。
将Cu2+添加前后样品冷冻干燥后与光谱纯溴化钾以100:1的比例混合, 研磨压片后, 使用Nicolet 370傅里叶红外光谱仪在0.5 cm-1分辨率下扫描, 得到1 800~700 cm-1范围内的FTIR。 所得红外光谱结果均进行水汽校正。
使用日本岛津UV-3600紫外-可见光分光光度计测定样品的紫外-可见光吸收光谱。 设定光谱扫描范围为200~800 nm, 光程路径1 cm, 扫描间隔1 nm, 以Milli-Q超纯水为基线矫正和空白参照。 对紫外-可见光吸收光谱进行解析, 计算得到吸收系数A254和吸收光谱斜率比值SR分别表征DOM的相对丰度和分子量大小[11, 18, 19]。
不同pH条件下DOM的性质差异如表1所示。 随着pH值的升高, DOM的相对丰度A254逐渐增加, 并在碱性条件下趋于稳定。 由于DOM的浓度均为10 mg· L-1, 表明pH的改变对DOM的芳香性有显著的影响。 不同pH条件下DOM的SR值均在0.97± 0.1范围内, 表明pH变化并没有改变DOM分子量的大小。 由表1发现, pH 5时DOM的荧光强度最弱, 类腐殖酸F468和类富里酸F345荧光强度分别为11.05和10.99, 随后分别增加至92.85和27.43。 这一结果表明, pH的变化能够显著的影响DOM的荧光强度。
| 表1 不同pH条件下DOM的性质变化 Table 1 Changes in DOM characteristics under different pH conditions |
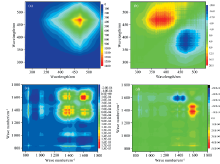
为进一步了解pH对DOM荧光强度的影响, 以pH为扰动因子, 采用二维相关光谱对DOM同步荧光光谱进行分析, 结果如图1(a— d)所示。 同步二维相关光谱在对角线468 nm存在一个明显的正值峰, 表明DOM在相对应波长处的荧光强度受pH变化的影响最大。 如图1(b)所示, 异步二维相关光谱图峰值呈对角线分布, 在对角线下方存在负值峰。 根据Noda法则[16], pH引起的荧光谱峰的变化次序为335~420 nm> 468 nm。 随着pH的增加, DOM在波长335~420 nm范围内的荧光性质比468 nm处更先发生改变。
为了研究因pH改变导致的DOM结构的转变过程, 采用FTIR光谱开展二维相关光谱分析, 结果如图1(c)和(d)所示。 同步二维相关光谱对角线存在7个自相关峰。 异步二维相关光谱结果表明, pH引起的FTIR谱峰的变化次数为: 1 620> 1 400> 1 360> 1 450> 1 725> 830> 1 040 cm-1。 有研究表明[12, 17, 20], 在1 725、 1 620、 1 450、 1 400、 1 360、 1 040和830 cm-1附近出现的峰分别为羧基的C=O振动、 醛酮的C=O、 羧基上的不对称伸缩振动或C— OH的变形振动、 酚基的C— O或O— H振动、 脂肪族C— H振动、 为多糖C— O振动、 为芳香族C— H振动。 随着pH的改变, DOM官能团变化次序为: 醛酮C=O> 酚基> 脂肪族C— H> 羧基C— OH> 羧基C=O> 芳香族C— H> 多糖C— O。
由于腐殖酸分子中含有大量的羧基和酚羟基等酸性官能团, 在较低pH下腐殖酸分子构型呈卷曲状态, 大部分官能团受限于其内部, 随着溶液pH的增大溶液中的OH-浓度不断增加, 酸性官能团中的H+不断发生解离导致HA大分子内部斥力增大, 分子构型由卷曲伸展为线性结构, 从而有更多的相关基团暴露出来, 使腐殖酸的荧光强度增强, 表明官能团发生了变化[7, 12]。
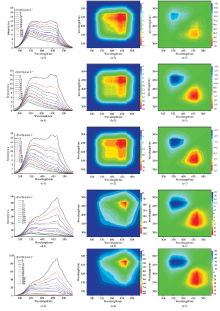
随着Cu2+浓度从0 μ mol· L-1增加至250 μ mol· L-1, 不同pH条件下DOM不同波长的荧光强度均呈现明显的下降趋势, 如图2(a— e)所示, 表明在Cu2+的作用下DOM均发生了淬灭效应。 为了进一步掌握不同pH条件下Cu2+与DOM的结合点位和结合顺序, 以Cu2+浓度为扰动因子, 采用二维相关光谱解析同步荧光光谱, 结果如图2(a2, a3, b2, b3, c2, c3, d2, d3, e2, e3)所示。 不同pH条件下DOM同步荧光2D-COS图均在对角线出现2个主要的自相关峰, 分别位于468和345 nm, 且468 nm处自相关峰峰强均高于345 nm, 表明类腐殖酸与Cu2+的结合能力均强于类富里酸。 随着pH值增加, 468和345 nm处的自相关峰强度也逐渐增强, 尤其是碱性条件下(pH 8和10)自相关峰峰强显著高于酸性和中性条件(pH 5、 6和7), 表明pH的改变能够显著地影响DOM与Cu2+的结合能力。 异步二维光谱图[图1(b, d)]的峰值呈对角线分布, 在对角线右下方均存在正值峰。 根据Noda法则, 不同pH条件下DOM与重金属Cu2+的结合顺序依次为468 nm> 335~420 nm。 这一系列结果表明, DOM不同点位与Cu2+的结合顺序并不受pH变化的影响, 但是结合强度受pH变化的影响, DOM与Cu2+的结合强度随着pH升高呈现增强的趋势。 分析认为pH的升高使得更多的相关基团暴露, 增加了DOM与Cu2+的相互作用。
为了进一步了解pH对DOM与Cu2+相互作用的影响, 采用平行因子法对三维荧光光谱进行解析, 基于残差分析和分半验证结果, 共解析出3个荧光组分。 根据荧光组分的光谱特征, C1[Ex/Em=260/510 nm]和C3[Ex/Em=< 235/540 nm]为类腐殖酸物质, C2[Ex/Em=250/415 nm]为类富里酸物质[21, 22]。 采用Ryan-Weber模型对不同pH条件下DOM不同组分与Cu2+相互作用荧光淬灭曲线进行非线性拟合, 结果如表2所示。 由表2可以看出, 类腐殖酸组分C1与Cu2+的结合参数均高于类富里酸组分C2。 随着pH的增加, 组分C1和C2与Cu2+的结合参数均显著增加。 这一结果与同步荧光光谱分析结果相一致, 均表明pH的增加能够提升DOM与重金属Cu2+的结合能力但并不影响DOM点位与重金属Cu2+的结合顺序。
| 表2 基于Ryan-Weber模型确定的荧光组分与Cu2+相互作用结合参数(n=13) Table 2 Values of binding parameters for fluorescence components with Cu2+ determined by Ryan-Weber model (n=13) |
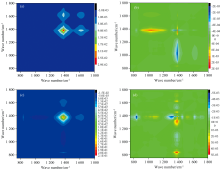
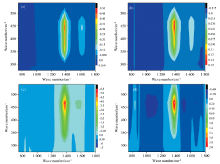
选择pH 5和pH 10条件下DOM与重金属Cu2+结合后FTIR光谱进行进一步分析, 以了解不同pH条件下DOM与重金属Cu2+的相互作用机制, 结果如图3所示。 由图3(a)和(c)可以看出, pH 5和pH 10条件下DOM与Cu2+结合后的FTIR均在1 380和1 620 cm-1波段存在正值自相关峰, 在1 380/1 620 cm-1存在正值交叉峰。 pH 10条件下自相关和交叉峰的强度均高于pH 5条件下的峰强度。 这一结果表明, 相比于pH 5的条件, pH 10更利于DOM与重金属Cu2+的结合, 且主要结合官能团可能为醛酮C=O、 酚羟基C— O和脂肪族C— H。 根据Noda法则, pH 5条件下DOM不同官能团与重金属Cu2+的结合顺序依次为: 1 040> 1 380> 1 620> 830 cm-1, 即多糖C— O> 酚基> 醛酮C=O> 芳香族C— H。 pH 10条件下DOM官能团的结合的顺序为1 040> 1 520> 1 380> 1 350> 1 620> 1 450> 830> 1 710 cm-1, 即多糖C— O> 酰胺Ⅱ 带C— N> 酚基> 脂肪族C— H> 醛酮C=O> 羧基C— OH> 芳香族C— H> 羧基C=O。 pH 10条件下DOM官能团结合点位多于pH 5条件, 分析认为pH 10条件下更多的基团暴露在外所导致。 总之, pH的改变能够显著影响DOM官能团与Cu2+的结合强度、 结合点位及其结合顺序。
为确定荧光和红外光谱对应基团的相互关联, 并进一步了解DOM与Cu的结合过程, 采用2D-COS开展了异谱二维相关分析, 分别如图4(a— d)所示。 在pH 5和pH 10条件下, 同步二维相关光谱图中出现了2个负值交叉相关峰, 位于红外区域的1 380和1 620 cm-1和荧光区域的335~500 nm。 表明DOM中酚基和芳基是类腐殖酸和类富里酸组分的基元[12]。 在异步二维相关光谱图中, pH 5条件下, 坐标(1 380cm-1, 468 nm)和(1 620 cm-1, 468 nm)处符号为正, 表明类腐殖酸组分的荧光变化滞后于酚基和芳基的振动变化。 pH 10条件下, 坐标(1 380 cm-1, 468 nm)和(830 cm-1, 468 nm)处符号为正, 表明类腐殖酸组分的荧光变化滞后于酚基和芳基的振动变化。 强度的变化次序与二维荧光和二维红外相关分析得到的变化次序一致。
(1)pH的改变能够显著的影响溶解态有机质(DOM)的性质。 pH由5升高至10能使得更多的醛酮、 酚基、 羧基等相关基团暴露, 增加DOM的荧光强度, 其中对类腐殖酸组分的影响程度最大, 而类富里酸组分最易受影响。
(2)pH的改变能够影响DOM不同组分与重金属Cu2+的相互作用。 随着pH由5增加至10, DOM不同组分与Cu2+的结合强度均逐渐增加, 但DOM不同组分与Cu2+的结合顺序不受影响。
(3)pH的改变能够显著的影响DOM官能团与Cu2+的结合强度、 结合点位及其结合顺序。 高pH条件下DOM与Cu2+结合点位更多, 结合强度更强。 Cu2+加入后DOM中的酚基和芳基等组分的响应最快速, 然后发生DOM组分的荧光猝灭。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|