作者简介: 汤 泉, 1973年生, 贺州学院材料与化学工程学院高级实验师 e-mail: tangquan010@126.com
植物修复是一种绿色有吸引力的重金属污染修复技术。 了解重金属在植物体内不同部位的分布, 有助于深入了解重金属植物修复的分子机制。 激光诱导击穿光谱技术(LIBS)在元素原位快速分析时拥有突出的技术优势, 尤其是具备无需复杂样品前处理、 可对固体样品直接分析的突出特点, 目前元素扫描成像是LIBS技术的重要研究及应用方向。 设计并搭建了基于纳秒脉冲激光器的元素成像LIBS装置, 系统光斑分辨率50 μm, 样品移动步距为100 μm, 成像分析速度为6.25 mm2·min-1, 装置可实现自动化扫描, 满足实际分析需求, 系统采用多通道平面光栅光谱仪, 光谱范围180~800 nm, 目标元素光谱经基线扣除, 峰面积拟合及归一化处理后绘制分布热图, 并以伪彩呈现样品不同区域的元素分布。 以豌豆为水培植物模型, 利用所搭建的元素成像LIBS装置开展豌豆植株的在体原位元素成像分析, 分析了Ni、 Cu、 Cr及Pb重金属在植物体内的差异性分布, 并研究了上述四种重金属的吸收途径。 结果显示, 该元素成像装置可以对植物体内存在的C、 Mg、 Fe、 Ca、 Na、 K等主要基体元素进行有效分析, 经过重金属胁迫后, 豌豆植物体内存在明显的重金属累积且不同重金属在植株中呈现不同的分布趋势, 镍离子在胚轴、 胚芽部位大量存在, 与镍离子分布不同的是, 植株大量吸收铜离子并富集在根部初生结构中; 重金属铬在豌豆根的中部和胚芽、 胚轴大量积累, 而重金属铅则大量富集在胚轴、 胚芽中, 根尖的含量最少。 该研究表明, 元素成像LIBS技术可实现对植物体内多种重金属的在体同时分析, 这对辅助研究环境水体重金属污染植物修复的机理有意义, 同时可为植物生理学和生态毒理学等领域的相关研究提供装置和新方法。
Phytoremediation is a green and attractive technique for remediating heavy metal pollution. Understanding the distribution of heavy metals in different plant parts can provide insight into the molecular mechanisms of heavy metal phytoremediation. Laser-induced breakdown spectroscopy (LIBS) has outstanding technical advantages for the rapid in situ analysis of elements, especially for the direct analysis of solid samples without complex sample pre-treatment. Elemental scanning imaging is currently an important research and application direction of LIBS technology. A nanosecond pulsed laser-based elemental imaging LIBS device was developed with a spot resolution of 50 μm, a sample movement step of 100 μm and an imaging analysis speed of 6.25 mm2·min-1. The spectra of the target elements were normalized by baseline deduction, peak area fitting and normalization to produce a distribution thermogram with a pseudo-color representation of the elemental distribution in different regions of the sample. The in situ elemental imaging of pea plants was carried out using a hydroponic model, and the in situ elemental imaging of Ni, Cu, Cr and Pb were carried out using the imaging LIBS device. The results show that the device can effectively analyze the major matrix elements, such as C, Mg, Fe, Ca, Na and K, present in the plant and that after heavy metal stress, there is a significant accumulation of heavy metals in pea plants and different distribution trends of different heavy metals in the plant. Different from the distribution of nickel ions, the plant absorbed many copper ions and enriched it in the primordial root structures.The chromium accumulatedin the middle of the pea roots andin the germ and embryonic axis. However, large amounts of heavy metal lead was enrichedin the germ and embryonic axis, with the least amount in the root tip. This study shows that the elemental imaging LIBS technique enables the simultaneous in vivo analysis of multiple heavy metals in plants, which has implications for aiding the study of the mechanisms of phytoremediationin environmental waters. The imaging LIBS is a potential deviceand new method for related research in plant physiology and ecotoxicology.
因无需复杂的样品前处理、 可对固体样品进行直接分析的突出特点, 激光诱导击穿光谱(laser-induced breakdown spectroscopy, LIBS)在原位元素分析领域展示出卓越的优势[1]。 近年来, 充分发挥LIBS技术快速分析的优势, 元素扫描成像LIBS技术逐步受到研究人员的重视[2]。 该技术利用LIBS对不同类型的样品进行表面扫描, 获得样品组成元素的光谱信息, 通过对光谱数据的重构, 绘制样品表面不同元素的分布图像。 相比于现有的元素成像技术, 如基质辅助激光解析电离质谱技术(matrix-assisted laser desorption/ionization-mass spectrometry, MALDI-MS)[3], X射线荧光光谱技术(X-ray fluorescence spectrometry, XRF)[4]而言, LIBS成像技术装置更简单, 大气开放环境即可运行。 因此, 当前在生物组织成像[5, 6]、 地质分析[7]、 工业检验[8, 9]等领域都有相关研究报道。
另一方面, 植物修复技术是一种绿色有吸引力的重金属污染修复方法[10, 11], 可以利用植物吸收环境中的重金属。 而原位分析植物吸收重金属, 重金属在植物体内的分布情况, 对植物修复的分子机制, 培育对重金属有特定吸收能力的植物等研究, 意义重大。 鉴于此, 本研究利用自行设计的LIBS成像装置, 以水培豌豆为植物模型, 建立了LIBS技术分析豌豆植株中重金属的成像方法, 对比了不同重金属在豌豆植株中的分布差异。
实验选定麻豌豆(Pisum sativum Linn.)为研究对象。 种豆用20 ℃温水浸泡14 h, 然后在室温25 ℃下使用无菌水在育苗盆中发芽培育, 72 h后选出长度相近, 根长约1 cm, 长势健康的幼苗进行重金属胁迫。 选择氯化铜(CuCl2)、 重铬酸钾(K2Cr2O7)、 六水硝酸镍[Ni(NO3)2· 6H2O]及硝酸铅[Pb(NO3)2]四种重金属化合物, 配置浓度为1 000 μ g· g-1的重金属储备溶液, 进行幼苗的重金属胁迫实验。 以室温25 ℃, 自然光照条件下培养5 d后观察植物生长结果。 设立三个相互平行的实验组。
选择长势良好的植株, 先用去离子水冲洗掉植株表面附着的重金属离子, 后采用自然干燥的方式进行干燥定型(1 d), 保持样品干燥的形态并避免脱水萎缩现象的发生, 以获得平整的分析样本。
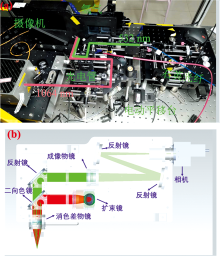
实验中采用的LIBS成像装置为四川大学分析仪器研究中心设计搭建。 装置实物图如图1(a)所示, 光路示意图如图1(b)所示。 该系统采用纳秒Nd:YAG脉冲激光器(Innolas, German, 1 064 nm)为等离子体激发源, 在优化激光光斑及光谱信噪比的基础上, 最终设置激光脉冲能量25 mJ, 延迟时间2.0 μ s, 脉冲频率5 Hz。 光谱仪采用多通道平面光栅光谱仪(Avantes 2048CL, 北京爱万提斯科技有限公司), 光谱范围180~800 nm, 以四通道组合形式, 每个通道光谱范围覆盖约200 nm区间, 满足全光谱最优分辨率0.1 nm。 光谱仪通过数字脉冲延时器(DG535, Stanford Research Systems)与脉冲激光器之间形成同步, 数字脉冲延时器通过光路中设置的快速光电管(DET10A, Throlabs)实现外部触发, 并同时与1 064 nm脉冲激光器, 多通道光谱仪及三维样品台控制系统相连。 三维样品台由软件自动控制, 样品台处于外触发工作模式, 待接收到激光脉冲的信号后, 可根据设置的分析路径及样品尺寸实现样品的自动移动, 完成区域面积内的光谱信号采集。 三维样品台与激光器之间由数字脉冲延时器实现同步控制。 在本研究中, 该系统成像分析速度为6.25 mm2· min-1, 光斑分辨率为50 μ m, 电动样品台步距为100 μ m。 成像系统中设置有波长为532 nm激光器, 可通过该激光器的可见斑点实时了解激光分析位点。
分别对不同重金属胁迫的样本进行成像分析, 获取覆盖植株全区域的光谱数据。 对Cu元素, 提取Cu(Ⅰ ) 324.7 nm处324.5~325.5 nm范围内峰面积; 对Ni元素, 提取Ni(Ⅰ ) 341.5 nm处341.0~342.0 nm范围内峰面积; 对Pb元素, 提取Pb(Ⅰ ) 405.6 nm处405~406 nm范围内的峰面积; 对Cr元素, 提取Cr(Ⅰ ) 425.43 nm处425~426 nm范围内的峰面积。 上述重金属胁迫后的植株光谱经过基线扣除, 峰面积拟合及全谱归一化处理后, 通过MATLAB 2018b绘制目标元素的分布热图, 最终以伪彩表示重金属分布的变化。
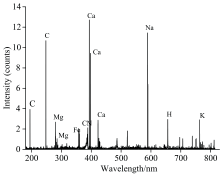
利用LIBS对豌豆植株进行原位光谱分析, 可以获得植株自身的元素信息, 实验结果如图2所示。 结果显示, 植物体内存在的元素主要有C, Mg, Fe, Ca, Na, K元素, 上述元素在LIBS光谱中存在明显的发射谱线, 与此同时, CN分子谱也呈现明显的信号, 这主要是由于植物体内有机质的存在。
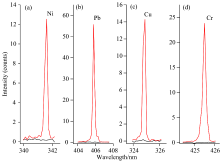
水体中重金属对植物存在较强的胁迫作用。 对比正常情况下生长的植株, 实验组的植株出现了明显的异常情况, 包括生长速度减缓, 表面被重金属离子染色等, 甚至还出现了发黄、 枯萎等现象, 这些现象的出现是由于重金属离子抑制了叶绿素合成, 结合转运蛋白阻碍植物养分运输等原因所致[12, 13]。 相较自来水水培豌豆植株而言, 经过重金属胁迫后, 植物体内存在明显的重金属累积, 如图3所示, 重金属Cr, Pb, Cu和Ni出现明显的光谱信号。 特征谱线的出峰位置分别为: Cu (Ⅰ ) 324.7 nm, Ni (Ⅰ ) 341.5 nm, Pb(Ⅰ ) 405.6 nm, Cr(Ⅰ ) 425.43 nm。 结果体现了LIBS在分析植物体内重金属时无需消解直接分析的优势。
进一步对植株中重金属分布进行成像分析。 图4为四种重金属在豌豆植株中的分布图。 结果显示, 四种不同重金属在植株中呈现不同的分布趋势。 在镍离子胁迫下, 样品长约15 mm, 呈黄棕色, 根部颜色较深。 镍离子在该样品的胚轴、 胚芽部位大量存在, 其次存在于根尖。 值得注意的是, 相对于其他结构, 根的中部初生结构和次生结构检测到的镍离子较少。
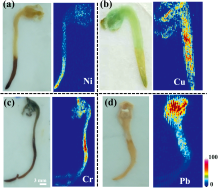 | 图4 不同重金属胁迫下豌豆植株的元素分布成像 (a): 镍分布; (b): 铜分布; (c): 铬分布; (d): 铅分布Fig.4 Element distribution imaging of Pisum sativum Linn under different heavy metal stresses (a): Ni; (b): Cu; (c): Cr; (d): Pb |
在铜离子胁迫的样本中, 样品长约20 mm, 植株的颜色整体颜色偏绿, 根尖稍黄。 与镍离子分布不同的是, 植株大量吸收铜离子并富集在根部中间段, 即初生结构。 吸收的铜离子其次存在于胚轴、 胚芽中, 根尖的分布最少。 这说明豌豆主要在根部的初生结构通过表皮对重金属Cu进行吸收, 再经过皮层横向运输到维管柱, 最后从维管柱向上运输, 到达其他部位。 在该过程中, 铜离子大量富集在初生结构, 部分随维管组织输送并富集在胚轴、 胚芽中。
在铬离子胁迫的样本中, 植株长约24 mm, 普遍长于其他重金属离子胁迫的样本。 植株整体呈深棕绿色, 在胚芽、 胚轴和根中部颜色较深, 其余部位颜色较浅。 对比元素分析结果图4可知, 上述部位的铬离子积累量也显著高于其余部位, 铬离子在根的中部和胚芽、 胚轴大量积累。
在铅离子胁迫的样本中, 植株长约22 mm, 根部发育完善, 但茎、 芽均未长出, 表明重金属铅对植株发育抑制作用明显。 植株的整体颜色呈淡黄褐色, 胚轴、 胚芽的颜色明显较深。 在元素成像结果图中, 大量铅富集在胚轴、 胚芽中, 根尖的含量最少。 这说明铅离子在植株体内易于从根尖向上运输, 并且能较为完整地富集在胚芽、 胚轴的部位, 在根尖部位以及输送的途中较少残留, 最终实现在胚芽、 胚轴部位的大量富集, 破坏植株在该部位的发育[图4(a— d)]。 从植株颜色可见, 铅离子对样品植株中的叶绿素造成了严重的破坏, 可以影响植物的细胞色素, 阻碍光合作用, 危害植物健康。
LIBS技术为植物在体元素成像提供了更加便捷、 快速、 高效的有力手段, 小型化仪器将有望用于现场分析, 展现更大的潜力。 此外, 目前亦有研究发现许多植物针对重金属离子存在多种精密且相互错综复杂的解毒机制, 研究植物对水体重金属的吸收及植物在体重金属分布同样也有利于重金属污染植物修复技术的研究。 作为食物链中的重要角色, 能够从环境中吸收、 富集重金属的植物是人类受到重金属危害的重要来源之一, 但因其可富集、 可解毒的特点有望成为治理重金属污染的重要途经。 通过LIBS这种高效、 低成本、 便捷的技术来了解植物在体重金属分布, 对研究植物的运输机理和评价作物的健康状况等研究都具有重要意义, 同时也为环境治理和食品安全的保护提供了一种新途径。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|