作者简介: 王 秋, 女, 1996年生, 华东交通大学智能机电装备创新研究院硕士研究生 e-mail: 765806657@qq.com
油茶(Camellia oleifera)炭疽病是油茶产业普遍发生的一种破坏性极强的病害, 严重制约了油茶产业的发展, 油茶患炭疽病初期只需及时修除树上的患病部位, 随着病情的加重需铲除患病枝干, 患病严重的病株要及时砍伐。 针对目前检测油茶炭疽病等级的实验复杂、 判定精度不高等问题, 提出采用激光诱导击穿光谱(LIBS)结合傅里叶变换近红外光谱检测油茶叶片炭疽病等级判定的方法, 以实现油茶炭疽病等级的快速、 高效和高精度判定。 健康和感染不同程度炭疽病油茶叶片的LIBS光谱中Fe、 Ca、 Mn、 CaⅡ等元素健康油茶叶片与患病油茶叶片存在显著差异, 且随着患病程度的增加元素的特征峰强度逐渐降低, 主要原因是这几类元素都是油茶生长所必需的元素; 健康油茶叶片与患不同程度炭疽病油茶叶片的傅里叶变换近红外光谱的吸光度也存在差异, 随着油茶叶片炭疽病等级的加重傅里叶变换近红外光谱的吸光度逐渐降低, 主要是由于傅里叶变换近红外光谱能够反映样品的物理特性。 分别采用归一化(Normalization)、 多元散射校正(MSC)、 标准正态变换(SNV)预处理方法结合竞争自适应重加权采样(CARS)、 连续投影算法(SPA)变量筛选方法建立了偏最小二乘判别分析(PLS-DA)和支持向量机(SVM)的油茶炭疽病等级的融合光谱分类模型。 PLS-DA模型中LIBS(Normalization-CARS)-NIR(Normalization-CARS)-PLS-DA的预测集RMSEP=0.173, $R_{P}^{2}$=0.987, 误判率为0; SVM模型中LIBS-NIR-CARS-SVM的建模集精度100%, 预测集精度为97.59%。 实验结果表明: 基于LIBS与傅里叶变换近红外光谱融合检测油茶叶片炭疽病等级中PLS-DA模型比SVM模型的定性分析精度更高, 模型更稳定。 研究表明: LIBS光谱联合傅里叶变换NIR光谱可高效、 快速、 高精度地区分健康油茶叶片与各个等级的炭疽病油茶叶片。
Anthracnose of Camellia oleifera is a highly destructive disease commonly occurring in the Camellia oleifera industry, seriously restricting the development of the Camellia oleifera industry. In theearly stage of Camellia oleifera anthrax. It only need to repair the sick part of the tree in time. As the disease worsens, the affected branches must be eradicated, and seriously sick strains should be cut down in time. Aiming at, the current problem that the detection of Camellia oleifera anthrax is complex and the judgment accuracy is low, this paper proposes a method to determine the detection of the degree of Camellia oleifera anthracnose using laser-induced breakdown spectroscopy (LIBS) and Fourier transform near infrared spectroscopy (NIR), to achieve rapid, efficient and high-precision determination of the degree of anthracnose of Camellia oleifera. Fe, Ca, Mn, CaⅡ, and other elements in the LIBS spectrum of healthy Camellia oleifera leaves and diseased Camellia oleifera leaves were significantly different, and the characteristic peak intensities of the elements increased with the degree of disease. The main reason is that these elements are all necessary elements for the growth of Camellia oleifera. The absorbance of the Fourier transform near-infrared spectra of healthy Camellia oleifera leaves and Camellia oleifera leaves with different degrees of anthracnose also differs, mainly due to the ability of Fourier transform NIR to extract the physical properties of the sample. Using normalization, multivariate scatter correction (MSC), standard normal variate (SNV) preprocessing method combined with competitive adaptive reweighted sampling (CARS), Successive projection algorithm (SPA) variable screening method to establish fusion spectral classification model of anthracnose grades of Camellia oleifera by partial least squares discrimination analysis (PLS-DA) and support vector machine (SVM). Among them, the Root mean square error of prediction (RMSEP) and the prediction determination coefficient $R_{P}^{2}$ of LIBS (Normalization-CARS)-NIR (Normalization-CARS)-PLS-DA of prediction set are 0.173 and 0.987 respectively and the misjudgment rate is 0. In the SVM model, the accuracy of the modeling set of LIBS-NIR-CARS-SVM is 100%, and the accuracy of the prediction set is 97.59%. The experimental results show that: the PLS-DA model based on the fusion of LIBS and Fourier transform NIR spectra for detecting anthracnose grades of Camellia oleifera leaves higher qualitative analysis accuracy and more stability than the SVM model. The results showed that: the LIBS spectrum combined with Fourier transform NIR spectrum could be used to separate healthy Camellia oleifera leaves from various grades of anthracnose of Camellia oleifera leaves efficiently, quickly and accurately.
油茶(Camellia oleifera)被称为世界四大木本油料植物, 它主要生长在中国的南方, 是我国特有的一种纯天然高级油料, 有良好的经济效益。 近年来, 油茶种植面积不断扩大, 油茶产业也带动着当地的经济。 但是, 随着种植面积的扩大, 油茶病虫害日益严重, 不仅影响了油茶产业的发展和油茶种植地的经济效益, 也为预防、 消除油茶病虫害提出了新的难题。 油茶炭疽病是油茶树的主要病害, 该病破坏力极强, 严重时会导致油茶树落花落果、 枝干枯死、 最后整株衰亡, 主要在我国油茶中心分布区的湖南、 江西和广西等省区发生普遍[1]。 油茶患病初期只需及时修除树上的患病部位即可, 随着病情的加重应及时铲除患病枝干, 患病严重的病株必须要及时砍伐。
目前, 检测植物病害主要有两大方面[2], 一是实验室检测技术, 如帅小春[3]等通过组织分离法分离纯化病健交界处病原菌, 采用形态学方法初步鉴定了7株典型炭疽属真菌; Wang[4]等采用常规聚合酶链式反应(polymerase chain reaction, PCR)技术检测油茶炭疽病病菌; 刘燕德[5]等利用火焰原子吸收光谱法(flame atomic absorption spectrometry, FAAS)检测油茶叶片炭疽病。 这些检测技术虽然精度高但实验处理过程太过繁琐而且对实验人员的要求高, 还会造成二次污染。 另一方面是光谱检测、 图像纹理检测等, 如Abdulridha[6]采用高光谱成像技术检测番茄叶片早期病害并实现了健康番茄与不同病害程度番茄的分类; 赵艳茹等[7]应用激光拉曼光谱判别油菜叶片核盘菌早期浸染。 光谱检测和图像检测虽然比实验室检测简便、 快速, 但在植物病害等级检测中却很少, 因此需要寻找一种快速、 高效、 简便、 高精度的方法来检测植物病害。
激光诱导击穿光谱(laser induced breakdown spectroscopy, LIBS)是一种基于原子发射光谱和激光等离子体发射光谱的元素分析技术, LIBS实验方法简单, 是快速、 直接、 多元素分析技术[8, 9], 近年来被广泛应用于植物元素分析中[10]。 Martin等[11]采用LIBS技术检测杨树叶片中的元素, 实验结果表明LIBS是一种快速、 准确的元素检测技术; Denilson等[12]应用LIBS技术检测蔬菜样品中的微量元素和常量元素; Tripathi等[13]采用LIBS技术检测小麦幼苗中的铅含量, 对比AAS与ICAP-AES的检测结果, 发现LIBS技术具有更好的效果。 LIBS技术能够检测植物元素但是不能检测化学键, 而傅里叶变换近红外光谱(near-infrared reflectance, NIR)技术可实现物质化学键的检测, 其产生的光谱信息提供了油茶叶片中不同物质的信息。 近红外光谱属于分子振动光谱的倍频和主频吸收光谱, 具有较强的穿透能力, 近红外光谱承载的信息包括O— H、 N— H、 C— H等含氢基团振动的合频与倍频特征信息, 其中包含了大多数类型有机化合物组成和分子结构的信息[14]。 Atanassova等采用可见近红外光谱技术检测黄瓜白粉病, 正确识别健康植株、 无症状期感染植株和患病植株[15]; 宋雪健[16]等采用傅里叶近红外光谱技术准确鉴别不同产地的大米; Má rquez[17]等采用傅里叶变换拉曼光谱(Fourier transform infrared Raman, FT-Raman)和NIR光谱融合定性检测坚果掺假。
本工作针对目前检测油茶叶片炭疽病程度的方法复杂、 效率低、 污染环境和精度不高等问题, 以LIBS和傅里叶NIR相互补这一特性, 提出了LIBS联合傅里叶NIR结合化学计量学方法检测油茶叶片炭疽病, 以实现无损、 快速、 高效、 高精度地检测油茶叶片炭疽病。
本研究所用的实验样品是在江西省南昌市油茶种植区采摘的健康油茶叶片和炭疽病油茶叶片, 采集完成的油茶叶片先进行PCR检测, 区分出健康叶片和炭疽病油茶叶片。 分别采摘了5种不同类型的油茶叶片, 其中轻度油茶叶片炭疽病样品、 轻中度油茶叶片炭疽病样品、 中度油茶叶片炭疽病样品、 重度油茶叶片炭疽病样品和健康油茶叶片样品分别为40、 40、 40、 40和92, 样品由叶片表面光滑无任何病斑的健康油茶叶片和叶片上黑褐色病斑面积占叶片总面积不同比例的炭疽病油茶叶片组成。 其中油茶叶片上炭疽病病斑面积小于1/4的叶片称为轻度炭疽病油茶叶片, 病斑面积小于1/2大于1/4的称为轻中度炭疽病油茶叶片, 病斑面积大于1/2小于3/4的称为中度染病油茶叶片, 病斑面积大于3/4的称为重度染病油茶叶片。 实验样品的处理过程: 采摘、 冲洗(用去离子水)、 分类、 烘干(60 ℃烘6 h)、 研磨、 过筛(200目筛)、 压片(10 MPa压1 min)、 装袋、 标号。
检测油茶叶片中营养元素采用海洋光学公司型号为MX2500+的LIBS仪器, 固体激光器— — Nd:YAG激光器(Quantel, Big Sky Laser Ultra50), 产生1 060 nm光激励, 该仪器包含5个通道。 LIBS光谱强度受聚焦透镜与样品之间距离和延迟时间的影响, 因此对LIBS设备参数进行相应的设置及优化, 通过LIBS光谱信号对比分析, 得LIBS设备最优参数设置为: 单激光触发、 激光能量为50 mJ、 光谱仪的波长范围为198.71~727.69 nm、 光学分辨率为0.1 nm、 积分时间为1 μ s、 聚焦透镜到样品表面之间的距离为4.1 cm、 延迟时间为2.5 μ s。 每个样本分散采集4个LIBS光谱数据值, 取其平均值, 目的是减小误差, 同时降低油茶叶片元素分配不均的影响。
将实验测得的谱线数据与美国国家标准与技术研究院(NIST)数据库中的数据进行对照, 然后在误差允许范围内对元素进行标定。 本实验LIBS仪器检测到的元素如图1所示, 图1(a)是257~262 nm内LIBS所检测的元素, 分别为Al 257.49, FeⅡ 259.94, MnⅡ 260.568, 图1(b)是278~282 nm光谱段内所检测到元素信息, Mn 279.482和Mn 280.108, 图1(c)是392~398 nm光谱段内检测到的元素信息, CaⅡ 393.41和CaⅡ 396.91, 图1(d)是422~447 nm光谱段内检测到的元素, 包括Ca422.70、 Fe438.41、 Ca443.56、 Ca445.63四条特征谱线。 从图1可知: 健康油茶叶片的特征谱线特征峰强度高于患病的油茶叶片, 患病油茶叶片的四条特征谱线特征峰强度随着患病等级的增加逐渐降低。 分析认为这几类元素都是油茶生长所必需的元素, 随着油茶叶片炭疽病程度的加重, 这几类元素含量逐渐降低。
实验所用傅里叶变换近红外光谱仪为布鲁克(BRUKER)公司研制, 型号为: TENSOR37, 在傅里叶近红外光谱数据采集过程中, 试验参数波数设置为10 000~4 000 cm-1, 扫描次数设置为32次, 分辨率设置为4.0 cm-1。 为了减小误差, 每个样品测4个点, 取其光谱平均值进行实验分析, 在采集叶片光谱之前, 先采集背景光谱。
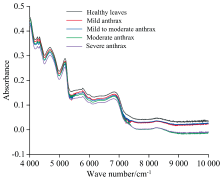
图2为5种样品的傅里叶近红外光谱图, 随着波数的增加, 样品的吸收系数增大, 傅里叶近红外光谱能够提取样品的物理信息, 体现样品的不同特性, 由图2可知健康叶片与患病叶片的吸光度有明显的区别, 且随着油茶叶片患病等级的加重吸光度逐渐降低。
在取平均值之后的252个油茶叶片样本, 用K-S(Kennard-Stone, K-S)按照3:1分类, 分为建模集样品169个, 其中轻度炭疽病样品、 轻中度炭疽病样品、 中度炭疽病样品、 重度炭疽病样品和健康油茶叶片样品分别为30、 30、 30、 24和55个; 预测集样品83个, 其中轻度、 轻中度、 中度、 重度和健康油茶叶片分别为10、 10、 10、 16和37个。
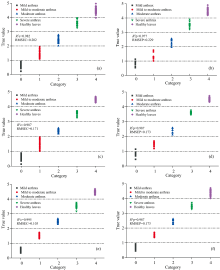
由表1中可知, 傅里叶变换近红外检测油茶叶片炭疽病等级, 对比了三种预处理和两种特征提取方法, 其中经过标准正态变换(standard normal variate, SNV)预处理、 竞争自适应重加权采样(competitive adaptive reweighted sampling, CARS)特征提取过后的分类结果较好, 误判率相对其他几种预处理方法比较低, 但整体上傅里叶变换近红外结合几种预处理方法的偏最小二乘判别模型的检测精度较低。 由表1可知, LIBS检测油茶叶片炭疽病等级经过三种预处理、 连续投影算法(successive projections algorithm, SPA)特征提取后的偏最小二乘判别(partial least squares discrimination analysis, PLS-DA)模型稳定性以及误判率较CARS特征提取的模型结果差; LIBS检测在经过三种预处理、 CARS特征提取后建立的PLS-DA模型的决定系数达到了0.9以上, 均方根误差则在0.2左右, 误判率相对较低。 经过归一化(Normalization)预处理、 CARS特征提取后的LIBS检测油茶叶片炭疽病等级的PLS-DA模型的结果最好, 校正均方根误差(root mean square error of calibration, RMSEC)0.202、 校正决定系数(
| 表1 单个光谱和融合光谱的PLS-DA建模 Table 1 PLS-DA modeling of single spectrum and fusion spectrum |
为了提高检测精度, 尝试把LIBS光谱与傅里叶变换NIR光谱结合起来检测油茶叶片炭疽病, LIBS与FT-NIR的光谱简单拼接之后再经过三种预处理和两种变量筛选, 最后建立PLS-DA模型, 由表1可知, LIBS-NIR的检测结果比单独的LIBS检测结果更好, 其中经过SNV预处理、 CARS特征提取过后的PLS-DA模型结果最好, RMSEC=0.171、
LIBS-NIR低级融合提高了油茶叶片炭疽病检测精度, 在此基础上本文决定进行中级融合, 研究能否进一步提高检测精度。 首先, 分别通过多元散射校正(multi-scatter calibration, MSC)、 Normalization、 SNV对LIBS和傅里叶变换近红外光谱进行预处理, 然后再把经过预处理后的光谱分别用CARS、 SPA进行变量筛选, 最后经过变量筛选的光谱进行光谱拼接再建立PLS-DA模型。 由表1可知, 经过Normalization预处理、 CARS变量筛选之后的LIBS(CARS)-NIR(CARS)中级融合光谱建立的PLS-DA模型结果最好, RMSEC=0.103、
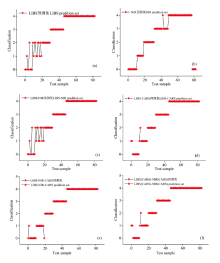
五类样品分别用0、 1、 2、 3、 4表示, PLS-DA模型的输出分类值, 0— 1、 1— 2、 2— 3、 3— 4、 4— 5分别表示五类样品的分类范围, 超出分类范围则认为分类错误, 选取每类光谱中分类结果最好的数据画图, 分析各类光谱的误判情况。 由图3(a)、 (b)可知LIBS-CARS-PLS-DA的不同等级样品误判图, 建模集误判1个, 预测集误判2个。 经过低级融合之后, 图3(c)、 (d)LIBS-NIR-SNV-CARS-PLS-DA误判率降低, 建模集误判0个, 预测集误判1个, 比LIBS单个光谱建立的PLS-DA模型建模集误判少1个, 预测集误判少1个, 建模集达到了零误判, 证明LIBS与NIR结合提高了检测油茶叶片炭疽病程度的精度。 从图3(e)、 (f)的误判率对比可知LIBS与NIR中级融合检测油茶叶片炭疽病等级, 经Normalization预处理、 CARS变量筛选之后的PLS-DA模型建模集和预测集误判率均为0, 各个患病等级与健康叶片之间没有误判。 因此, 基于LIBS和傅里叶NIR光谱融合的PLS-DA模型降低了误判率, 且中级融合比低级融合误判率低。
将单个、 联合的特征波长点导入支持向量机(support vector machine, SVM)中, 在建立支持向量机模型过程中, 采用网格搜索方法用于选择最优支持向量机参数惩罚因子c和核参数g。 对模型进行交叉验证, 最后留出一部分未参与建模的样本进行模型预测。 样品分为5类, 分别是健康油茶叶片、 轻度炭疽病油茶叶片, 轻中度炭疽病油茶叶片, 中度炭疽病油茶叶片, 重度炭疽病油茶叶片。 由表2可知, 傅里叶变换NIR的SVM模型中, 训练集、 校正集以及预测集的检测准确率均约为80%, 模型较稳定。 LIBS的SVM模型中, 虽然建模集检测准确率为100%, 但校正集和预测集的检测准确率与建模集检测准确率相差较大, 模型稳定性不强。 基于CARS、 SPA变量筛选的LIBS光谱检测油茶叶片炭疽病等级的SVM模型中, 变量筛选之后提高了模型的检测精度与模型稳定性。
| 表2 单个光谱和融合光谱的SVM建模 Table 2 SVM modeling of single spectrum and fusion spectrum |
为进一步提高模型的检测精度, 本研究决定采用LIBS与傅里叶NIR结合建立检测油茶叶片炭疽病等级的SVM模型。 LIBS光谱检测油茶叶片炭疽病等级的SVM模型中, LIBS-NIR-SVM、 LIBS-NIR-CARS-SVM的检测精度高于单个LIBS、 傅里叶NIR光谱的SVM模型, 且模型的稳定性也得到了提高。 但LIBS-NIR-SPA-SVM模型的检测精度低于LIBS-SPA-SVM, 分析认为低级融合时SPA进行变量筛选时挑选的光谱变量较少, 导致联合光谱的检测精度低于单个光谱的检测精度。 CARS变量筛选更适合于LIBS-NIR-SVM模型, 且基于CARS变量筛选的低级融合SVM模型检测精度高于基于CARS变量筛选的单个光谱SVM模型。
采用CARS、 SPA变量筛选后再进行光谱拼接建立的SVM中级融合模型, 由表2可知, 中级融合模型检测精度低于低级融合模型检测精度, 分析认为LIBS结合傅里叶NIR检测油茶叶片炭疽病等级的SVM模型中所需的一些光谱信息, 在进行中级融合之前的变量筛选中被剔除了, 证明了LIBS-NIR光谱中级融合检测油茶叶片炭疽病不适用于SVM模型。
SVM的模型预测集部分分类结果如图4所示, 由图4(a)、 (b)可知, LIBS的SVM模型中预测样品被分错了8个, 傅里叶近红外的SVM模型中预测样品被分错了14个。 图4(d)进行CARS特征提取之后再建立SVM模型时, LIBS的SVM模型中预测集被分错了3个, 其中2个轻度炭疽病样品错分为轻中度炭疽病样品, 1个轻中度炭疽病样品错分为中度炭疽病样品。 由于采用CARS特征提取的傅里叶NIR的SVM模型结果较差, 不具有对比性, 文中不予列出。 图4(e)基于CARS的低级融合SVM模型中, 预测集样品被分错了2个, 比单个光谱模型LIBS-CARS-SVM少分错1个, 其中1个轻度炭疽病样品错分为轻中度炭疽病样品, 1个轻中度炭疽病样品错分为轻度炭疽病样品。 图4(f)基于CARS的中级融合模型中, 预测集样品被分错了3个。 综上所述, 基于CARS低级融合的误判率低于单个光谱、 中级融合光谱的误判率, 相对于单个光谱, LIBS结合傅里叶NIR检测油茶叶片炭疽病等级的SVM模型提高了模型的检测精度。
表3对比了PLS-DA、 SVM中各类光谱的最优模型的结果, 最好的模型是LIBS(Normalization-CARS)-NIR(Normalization-CARS)-PLS-DA, 建模集、 预测集误判率均为0, 分类精度为100%, 其模型分类精度最高、 模型稳定性最好。
| 表3 PLS-DA、 SVM模型结果对比 Table 3 Comparison of PLS-DA, SVM model results |
采用LIBS光谱联合傅里叶NIR光谱技术并结合化学计量学方法, 实现了油茶叶片炭疽病等级的快速、 精准判定。 首先建立了PLS-DA模型, 根据模型结果LIBS(Normalization-CARS)-NIR(Normalization-CARS)-PLS-DA的建模集RMSEC=0.103,
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|