作者简介: 刘美君, 女, 1996年生, 沈阳师范大学物理科学与技术学院硕士研究生 e-mail: liumj127@163.com
卵母细胞质量是影响哺乳动物体外受精能力、 胚胎体外发育潜能以及妊娠成功与否的关键因素, 显著影响着人类的辅助生殖、 动物的育种、 品种改良及保存濒危物种等工作, 对其质量的研究具有重要的应用价值。 目前常规的质量评估手段主要从形态学角度、 从生化分析角度展开。 但传统的基于卵母细胞形态甄选评估其发育质量的方法, 其结果的可靠性较强地依赖于技术人员的经验, 具有主观性较强的特点; 新型的基于生物学技术检测生化指标的方法虽能弥补基于形态检测方法的不足但仍存在侵入式研究、 生物操作步骤繁琐复杂、 实验耗时长, 影响卵母细胞后续发育的缺点。 众所周知, 生物组织异变往往伴随着内部生化组分的改变, 而生化组分的改变往往表现出光谱的差异。 鉴于此, 利用紫外-可见分光光度计和自改建多光谱成像系统研究卵母细胞的光谱, 并分析了未成熟与成熟卵母细胞、 新鲜成熟与排卵后老化卵母细胞的光谱差别。 研究发现, (1)与新鲜成熟卵母细胞的紫外-可见光谱(190~1 100 nm)相比, 未成熟与排卵后老化卵母细胞的光谱均出现数个峰位的增减变化。 未成熟卵母细胞与新鲜成熟卵母细胞的紫外-可见光谱相比, 缺失了205和579 nm两个峰位以及894~941 nm的波段, 增加了593 nm处的峰位; 排卵后老化卵母细胞与新鲜成熟卵母细胞的紫外-可见光谱相比, 缺失了205、 445和579 nm的三个峰位以及846~941 nm的波段, 也增加了593 nm处的峰位。 (2)可见光波段的多光谱成像数据显示, 与新鲜成熟卵母细胞相比, 未成熟卵母细胞各生物结构在451和467 nm处的透射光谱强度下降, 排卵后老化卵母细胞各生物结构在425、 431、 571和669 nm处的透射光谱强度降低。 综上可见(特别是新鲜成熟与老化卵母细胞之间在多光谱成像中展现的光谱差别), 光谱检测在甄别卵母细胞质量方面展现出了巨大的可行性。
Oocyte quality is the key factor to affect the ability of in-vitro fertilization, the potential of embryo development in vitro and the success of pregnancy of mammals, there by significantly affecting the assisted reproduction of human beings, the breeding of animals, the improvement of varieties and the preservation of endangered species. The research on oocyte quality has important application value. Currently, the common quality assessment methods are mainly performed from the morphology and biochemistry analysis perspective. However, the traditional method of evaluating the development quality of oocytes based on morphological selection has the characteristics of strong subjectivity, and the reliability of the results strongly depends on technicians’ experience. Although the new method of detecting biochemical indexes based on biological technology can make up for the shortcomings of morphological detection methods, there are still some shortcomings of invasive research, complicated biological operation steps, long experimental time-consuming and affecting the subsequent development of oocytes. As we all know, Abnormal changes in biological tissue are often accompanied by changes in its internal biochemical components, which often shows spectral differences. Thus, this paper used ultraviolet-visible (UV-Vis) spectrophotometer and self-modified multispectral imaging system to study the spectra of oocytes, and the spectral data were analyzed between immature and mature oocytes, fresh mature and postovulatory aged oocytes. It was found that (1) compared with the UV-Vis spectra (190~1 100 nm) of fresh matured oocytes, the spectra of immature oocytes and aged oocytes showed several peak changes. The UV-Vis spectra of immature oocytes missed two peaks of 205 and 579 nm and the band of 894~941 nm and added the peak of 593nm compared with that of fresh matured oocytes. For the UV-Vis spectra of the aged oocytes, three peaks of 205, 445 and 579 nm and the band of 846 to 941 nm disappeared and the peak at 593 nm also increased. (2) The visible-band multispectral imaging data showed that compared with fresh matured oocytes, the transmission spectrum intensity at various biological structures of immature oocytes decreased at 451 and 467 nm, and the corresponding data of aged oocytes decreased at 425, 431, 571 and 669 nm. In summary (specially, the spectral differences between fresh matured and aged oocytes in multispectral imaging), it is thus clear that spectral detection shows great feasibility in identifying oocyte quality.
卵母细胞作为雌性动物特有的生殖细胞, 在生物与医学领域具有巨大的研究及应用价值, 对其质量的评价具有明确的现实意义。 很多研究指出, 卵母细胞的质量显著地影响着体外受精及胚胎移植的成功率, 从而影响人类的辅助生殖及动物的育种, 品种改良及保存濒危物种等工作[1, 2]。 目前评估卵母细胞质量的常见方法有[3, 4, 5]: (1)通过评估卵母细胞的细胞核及细胞质的成熟情况, 从形态学角度分析卵母细胞的发育质量; (2)通过测量卵母细胞内纺锤体、 线粒体等细胞器的功能, 分析其发育质量; (3)通过检测包裹卵母细胞的颗粒细胞的基因表达及端粒长度等指标, 评估卵母细胞的发育质量。 这些方法虽能从某种程度上分析卵母细胞的质量, 然而仍存在某些缺陷。 例如, 有的方法过度地依赖于技术人员的主观判断; 有的采用了侵入式研究手段, 检测后可能会影响到卵母细胞的后续发育; 有的是一种非直接检测手段且实验操作繁琐。 可见, 有效评估卵母细胞质量具有重大的意义, 然而仍缺乏恰当的检测手段。
众所周知, 生物组织的结构与成分往往随着其病理状态而变化, 同时伴随着其内部光学性质的改变, 这将影响到光在生物组织内的强度分布及反射与穿透能力。 光谱技术可以迅速便捷地标定健康组织的特征, 并检测出因结构组分差异导致的光谱差别, 例如, 利用光谱技术可以标定健康人血红蛋白的特征光谱, 可以区分癌变组织等[6, 7, 8, 9]。 卵母细胞不同的发育质量与其内部各种成分的改变关联紧密。 因此, 通过检测卵母细胞的光谱, 可以区分不同发育质量的卵母细胞。 本工作通过两种手段进行光谱检测, (1)通过紫外-可见分光光度计对裂解的不同发育质量的卵母细胞进行光谱检测。 紫外-可见分光光度计是常见的光谱分析仪器, 可测量蛋白质/DNA等生物大分子的光谱。 (2)通过多光谱成像技术对活体卵母细胞进行光谱检测。 多光谱成像是一种在不同波段光照明下获取样品图像的技术, 该技术同时兼具光谱分析的功能及样品空间形态采集的功能, 可以获得样品不同空间位置的光谱信息, 是一种“ 图谱合一” 的成像方法。 利用自主改建的多通道LED照明显微系统, 采集并比较了不同发育时期及不同发育质量的卵母细胞的多光谱图像。 将光谱技术应用到卵母细胞质量评价中, 其研究结果将为卵母细胞质量评价工作提供全新的思路及有价值的参考。
实验动物: 7~8周龄的ICR雌性小鼠。
生发泡期(germinal vesicle, GV)卵母细胞: 小鼠经脱颈椎处死后, 无菌摘取其卵巢。 体视显微镜下无菌针头反复刺扎卵泡释放裸卵, 挑选生发泡完整、 胞质均匀的GV期卵母细胞用于实验研究。
体内成熟的卵母细胞: 体视显微镜下分离卵巢与输卵管, 无菌针头划破输卵管膨大处释放卵丘-卵母细胞复合体, 将该复合体于37 ℃, 5%的透明质酸酶中孵育5 min, 挑选带有极体, 胞质均匀的卵母细胞用于实验研究[该卵母细胞处于第二次减数分裂中期(metaphase Ⅱ , MⅡ )]。
排卵后老化的卵母细胞: 将获取到的MⅡ 期卵母细胞继续体外培养24 h, 即得到了排卵后老化的卵母细胞。
裂解卵母细胞: 10 μ L蛋白酶抑制剂(phenylmethylsulfonyl fluoride, PMSF)加入到1 mL细胞裂解液(radio immunoprecipitation assay, RIPA)中混匀备用。 取180个卵母细胞加入到375 μ L的上述混合液中, 振荡混匀, 以备紫外-可见分光光度计检测。
紫外-可见分光光度计(UV-3101PC), 氘灯发射紫外光, 钨灯发射可见及红外光, 扫描范围190~1 100 nm, 参照池为350 μ L的RIPA与PMSF的混合液, 样品池为350 μ L加入卵母细胞的RIPA与PMSF的混合液。
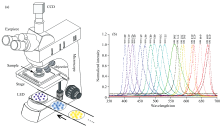
多光谱成像: 改装了商业显微镜(Cossim FR-4A)的照明光源, 将原有的卤素灯改为单色的LED光源[图1(a)]。 改装后的显微镜, 可同时实现图像采集(显微镜系统实现)与光谱分辨(多通道LED光源实现)的功能。 选用40倍物镜(N.A=1.0)用于成像研究, 500 nm光源下其分辨率约为0.3 μ m。 改造的光源为19个光谱间隔约为16 nm的窄带LED光源, 光谱范围为400~700 nm。 各个波段的LED光源均由多个单色的发光二极管构成, 其发射光谱如图1(b)所示, 半峰全宽约为15 nm。 显微镜经改造后, 通过更换不同波段的光源, CCD(像素数为3 072× 2 408)即可采集到样品的单色光谱图像。 卵母细胞某位置的透射光谱定义为T(λ )=
各实验至少重复三次, 各实验使用卵母细胞数目至少20。 数据以平均值± 标准误差的形式表示。 单因素方差分析用于比较两组数据之间的显著性差异。
利用紫外-可见分光光度计对GV期、 MⅡ 期及排卵后老化卵母细胞在190~1 100 nm范围内进行了光谱检测。 结果见图2, 发育成熟的新鲜的MⅡ 期卵母细胞(MⅡ group)的紫外-可见光谱在190~1 100 nm的范围主要有13个峰, 峰位分别位于205、 254、 353、 445、 466、 579、 609、 863、 908、 941、 995、 1 034和1 063 nm处; 未成熟的GV期卵母细胞(GV group)主要有11个峰, 峰位分别位于254、 353、 445、 466、 593、 609、 863、 894、 995、 1 034和1 063 nm处; 排卵后老化卵母细胞(Aged group)主要有9个峰, 峰位分别位于254、 353、 466、 593、 609、 846、 995、 1 034和1 063 nm处。 与新鲜的发育成熟的卵母细胞相比, 未成熟的卵母细胞缺失了205和579 nm两个峰位以及894~941 nm的波段, 增加了593 nm处的峰位; 排卵后老化的卵母细胞缺失了205、 445和579 nm的三个峰位以及846~941 nm的波段, 也增加了593 nm处的峰位。 可见, 光谱检测能够区分不同发育时期及不同发育质量的卵母细胞。 有文献报道[10, 11, 12, 13], 蛋白质中芳香族氨基酸(酪氨酸、 色氨酸、 苯丙氨酸)紫外光谱的峰位约在280 nm附近, 缩氨酸的峰位在210 nm以下; 嘌呤与嘧啶(核酸组分)的紫外光谱在260~290 nm间有峰位; 新鲜成熟卵母细胞内线粒体较丰富, 富含铁元素的细胞色素c位于线粒体内膜空间, 细胞色素c的光谱在可见光范围内存在多个峰位; 生物大分子中的C— H键、 N— H键、 O— H键的振动形成了近红外光谱。 观察到的未成熟、 排卵后老化卵母细胞与新鲜成熟卵母细胞之间的光谱差别, 可能与蛋白质及核酸的组分、 结构的改变有关。 由于利用紫外-可见分光光度计测量卵母细胞的光谱, 需要将多个卵母细胞裂解后, 才能进行测量, 可见, 这种方法只能得到多个卵母细胞群体的光谱。
为得到单个活体卵母细胞及其生物结构的光谱信息, 我们对卵母细胞进行了可见光范围内的多光谱成像(400~700 nm)。 以GV期卵母细胞为例, 图3(a)展示了不同光源照射下采集到的卵母细胞图像。 GV期卵母细胞包含多种生物结构, 如卵胞质、 核区、 核仁及透明带等[图3(b)]。 经对比各生物结构的灰度发现, 不同波长照射下所获得的卵母细胞图像具有相似的特点: (1)各生物结构的灰度值几乎一致, 仅透明带区域略强于其他区域; (2)除卵胞质区域的标准误差较大外, 其他生物结构的标准误差均较小。 以669 nm波长下GV期卵母细胞图像为例展示了上述特点[图3(c)]。 接下来, 绘制了GV期卵母细胞不同生物结构的光谱曲线, 可见各生物结构的光谱曲线无明显差别[图3(d)]。
 | 图3 GV期卵母细胞多光谱图像(a)及其透射光强分析(b— d)Fig.3 Multispectral images of GV oocytes (a) and transmission intensity analysis (b— d) |
同样的方法, 我们得到了新鲜成熟的卵母细胞(MⅡ 期)及排卵后老化卵母细胞中各生物结构的光谱曲线。 新鲜成熟与老化的卵母细胞含有卵胞质、 透明带、 卵周间隙、 极体等生物结构[图4(a, b)]。 与新鲜成熟卵母细胞相比, 老化卵母细胞质量差, 形态上表现出卵胞质内缩、 卵周间隙变大、 卵母细胞轮廓变形等变化[图4(a, b)]。 图4(c, d)是新鲜成熟卵母细胞与老化卵母细胞的各生物结构的光谱曲线, 可见, 各生物结构的光谱曲线也无明显差别。
上述结果可见, 同一类型的卵母细胞其各生物结构的光谱曲线无显著差别, 因此, 我们以一种生物结构的光谱曲线来代表这种卵母细胞的光谱特性。 我们以卵胞质为代表, 比较了不同发育时期[未成熟的GV期(GV group)与成熟的MⅡ 期(MⅡ group)]、 不同发育质量卵母细胞[新鲜成熟的卵母细胞(MⅡ group)与老化的卵母细胞(Aged group)]的光谱差别(图5)。 可见, 未成熟卵母细胞的光谱与发育成熟的卵母细胞相比, 二者光谱形状比较相似, 仅在451和467 nm处有差别, 在这两种光照下, 未成熟卵母细胞的透射率稍低一些。 老化卵母细胞的光谱与新鲜成熟的卵母细胞相比, 二者的光谱形状差别较大, 老化卵母细胞失去了在425~431及571 nm处的峰, 669 nm处的峰高明显下降, 老化卵母细胞表现出在425、 431、 571和669 nm光照下透射率更低的特点。 可见, 光谱检测能够甄别卵母细胞的质量。
光谱检测可用于甄选卵母细胞质量, 在未成熟与成熟卵母细胞之间、 新鲜成熟(质量好)与老化(质量差)卵母细胞之间, 均展现出明显的光谱差别。 两种光谱分析显示, 与新鲜成熟卵母细胞相比, 未成熟与老化卵母细胞表现出部分峰位的增减或峰强的下降。 特别是可见光波段新鲜成熟与老化卵母细胞之间的光谱差别将更有利于将基于光谱技术的卵母细胞质量甄选方法推向实际应用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|