作者简介: 刘 蓉, 1978年生, 天津大学精密测试技术及仪器国家重点实验室副教授 e-mail: rongliu@tju.edu.cn
在近红外光谱分析应用中, 温度扰动导致的光谱变化对于定量分析的准确度影响较大。 针对温度扰动识别及定量分析的需要, 研究了基于双光谱二维相关谱(2T2D-COS)的光谱扰动分析方法。 选择葡萄糖水溶液为样本, 根据人体血糖浓度范围和在体组织温度范围设计实验, 测量样本在浓度扰动和温度扰动下的透射光谱。 对其进行基线校正和滤波预处理后, 通过2T2D-COS分析得到浓度扰动和温度扰动下的异步谱。 结果表明, 温度扰动引起的交叉峰出现在强氢键结合水对应的特征吸收波长(1 474 nm)和弱氢键结合水对应的特征吸收波长(1 410 nm)附近, 而葡萄糖浓度扰动引起的交叉峰出现在水分子对应的特征吸收波长(1 450 nm)和葡萄糖分子对应的特征吸收波长(1 595 nm)附近。 为了定量分析样品温度, 进一步提取了温度扰动异步谱交叉峰1 410 nm波长下的切片谱, 其在1 410~1 600 nm波段的相关峰强度随温度的升高而增大, 与样品温度之间具有较好的相关性; 选择波长(1 475±4) nm范围内的切片谱, 对谱峰强度积分后进行线性拟合, 建立样品温度的线性回归模型, 对温度的预测均方根误差可以达到0.125 9 ℃。 以上结果表明, 双光谱二维相关谱只需要对两条光谱进行运算, 就可以通过异步谱中交叉峰的位置判别扰动来源, 还可以根据交叉峰的强度对温度进行定量分析, 且只需要较窄特征波段的光谱就可以建立高精度的温度预测模型, 为简化在体光谱测量系统的设计, 减少在体温度变化的影响提供了重要参考。
The near-infrared absorption features are easily affected by temperature changes, which reduce the accuracy of quantitative analysis. This paper presents the methods for analysing the source and amplitude of temperature disturbance based on the theory of two-trace two-dimensional correlation spectroscopy (2T2D-COS). The absorption spectra of glucose solution, with a concentration of 0~200 mg·dL-1, are measured in the temperature range of 34~38.5 ℃ with a stepwise of 0.5 ℃. After baseline correction and noise filtering, the concentration-dependent and temperature-dependent spectra are analyzed with the 2T2D-COS algorithm. In the asynchronous spectrum of temperature-dependent spectra, the cross-peaks are observed at 1 474 and 1 410 nm, corresponding to strong and weak hydrogen-bonded water, respectively. While in the asynchronous spectrum of concentration-dependent spectra, the cross peaks at 1 450 and 1 595 nm are related to the characteristic absorption of water and glucose. From the slice spectrum at 1 410 nm, the intensity of the peaks in the range of 1 410n~1 600 nm is increased with temperature, demonstrating good correlation between the cross peaks and temperature variance. The calibration model is established for the quantitative analysis of sample temperature with the cross peak intensity range of (1 475±4) nm. The root mean square error achieved 0.125 9 ℃ for sample temperature prediction with linear regression. The experimental results demonstrate that the temperature disturbances could be identified and qualified with distinctly separate cross peaks in the asynchronous spectrum, obtained using only a pair of spectra. The proposed approach also provides a reasonable way for researchers to simplify the in vivo measurement system and establish a more stable calibration model.
近红外光谱分析技术可以获取物质的组成与分子结构信息[1], 具有无损、 快速、 多成分同时分析、 成本低等优点, 广泛应用于各种物质的定性定量分析[2]。 近红外范围(1 000~2 500 nm)内的光谱吸收主要由分子振动产生, 以含氢基团X— H (X=C, N, O)的倍频和合频吸收为主[3], 光谱吸收峰较宽, 并且不同谱峰之间容易产生重叠。 吸收光谱中谱峰的位置和强度是定性定量分析的关键信息, 但是容易受到外部因素的扰动, 从而造成谱峰漂移与强度变化。 其中, 温度会对分子化学键的振动或转动能级跃迁产生影响, 很容易造成近红外吸收光谱的谱峰发生强度变化、 漂移以及展宽[4], 影响建模分析结果。
在温度对近红外光谱的影响机理方面, 有报道研究了温度引起的水光谱特征变化, 分析了温度诱导水分子团簇形成或解离的机制, 并通过实验验证了温度变化引起的水分子吸收谱带强度变化趋势[5]。 温度引起的光谱变化是对体系中感兴趣成分进行定量分析的主要误差来源, 有研究评估了温度变化对无创血糖测量的影响, 结果表明温度变化对葡萄糖定量模型误差的贡献可达50%以上[6, 7]。 为了减小温度对定量分析的影响, 可以将温度作为定量分析模型中的新变量。 Shao等采用偏最小二乘回归法(partial least squares regression, PLSR)建立了近红外吸收光谱与温度之间的定量光谱温度关系(quantitative spectra-temperature relationship, QSTR)模型, 并通过分析不同溶液的温度模型预测结果差异, 定量反映溶液中的浓度关系[8, 9]。 Shao等采用多级同时成分分析(multilevel simultaneous component analysis, MSCA)方法研究了不同温度下不同浓度样品的近红外光谱数据, 建立了描述温度效应的中间温度模型和描述浓度变化的温度模型[10]。 同时, Shao等还提出了利用互因子分析法(mutual factor analysis, MFA)提取不同温度或不同浓度的光谱中包含的共同特征, 发现提取的光谱特征中相对数量与温度或浓度成正比, 以此建立了可靠的葡萄糖测量校准模型[11]。
由于近红外范围内光谱多为官能团的倍频与合频吸收, 谱峰易重叠, 从原始光谱中很难直接分辨温度变化引起的谱峰漂移与强度变化。 二维相关光谱方法可以将光谱信号扩展到第二维, 以方便分析各种弱峰、 覆盖峰、 偏移峰等变化, 尤其有利于分析微弱吸收成分的变化及扰动[12, 13]。 为了提高二维相关光谱分析的效率, Noda提出了双光谱二维相关分析法(two-trace two-dimensional correlation spectroscopy, 2T2D-COS), 利用两条光谱计算得到二维相关谱, 获取两个样品光谱之间的异步变化特征。 在光谱分析应用中, 可基于该方法获得的异步交叉峰来识别原始光谱中重叠的分子振动变化特征, 为分析光谱的微弱变化特征奠定了基础。 相对于传统二维相关光谱分析方法, 2T2D-COS可简化实验过程, 并且对发生微小变化的两条光谱具有更高的分析效率[14, 15, 16]。
针对近红外光谱无创血糖检测需要, 研究了基于双光谱二维相关谱的葡萄糖溶液温度扰动分析方法, 以实现对近红外光谱中温度扰动的特征识别与定量分析。 实验样品为葡萄糖水溶液样本, 根据在体组织温度的变化范围设计实验, 测量样本在浓度扰动和温度扰动下的透射光谱。 采用2T2D-COS分析浓度扰动和温度扰动下的光谱特征, 考察异步谱中交叉峰的位置及强度变化规律。 与此同时, 提取异步谱中温度扰动产生的交叉峰处的切片谱, 建立样品温度的预测模型, 为在体测量光谱中扰动来源的识别及定量分析提供参考。
实验样品为葡萄糖水溶液, 根据人体血糖浓度的变化范围, 样品中葡萄糖的浓度分别为0, 100, 150和200 mg· dL-1。 每个浓度配制三个样品, 共12个样本。
采用傅里叶变换红外光谱仪(Frontier, Perkin Elmer, USA)测量样品的透射光谱, 实验参数设置为: 光谱范围1 000~1 700 nm, 光谱分辨率8 cm-1, 扫描速度0.2 cm-1· s-1, 每个样品扫描16次取平均。 样品置于光程长为1 mm的石英比色皿中, 由高精度温控器(Falcon NIR, PIKE, US)进行温度控制, 控制精度0.1 ℃。 温度范围选取了与人体温度相近的34~38.5 ℃, 温度间隔为0.5 ℃, 共在10个温度下测量不同糖浓度样本的透射光谱。 为了减少实验误差, 样品测量顺序随机选取, 在每个温度下分别采集蒸馏水以及样本的透射光谱, 每条光谱重复测量两次。
2T2D-COS异步谱可以通过对两条光谱进行互相关计算得到[16]。 在两个不同条件下测量的样品光谱, 可以将其分别定义为扰动样本光谱s(ν )和参考光谱r(ν ), 则异步谱Ψ (ν 1, ν 2)可以计算为
式(1)中, ν 1和ν 2分别为对应波长/波数。 2T2D-COS异步谱具有丰富的交叉峰峰型, 适合对分子间相互作用进行表征。 如果异步交叉峰为正, 即Ψ (ν 1, ν 2)> 0, 则说明与参考光谱相比, 扰动样品光谱中频率ν 1相关的分子振动变化大于ν 2所表征的部分; 反之, 若Ψ (ν 1, ν 2)< 0, 则说明与参考光谱相比, 扰动样品光谱中频率ν 1相关的分子振动变化小于ν 2所表征的部分[16]。 根据异步谱图中交叉峰的位置及相对变化, 可以判断样品光谱相对于参考光谱变化的扰动来源。 而对于同一来源的扰动, 扰动大小不同也会影响异步谱交叉峰的相关强度。 利用这一特性, 不仅可以识别温度对光谱特征的影响, 而且可以获取样品温度参数, 为获得高精度的成分定量校正模型提供参考。
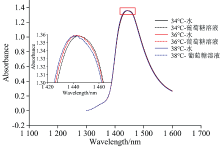
为了消除漂移和噪声影响, 首先对原始光谱进行滤波去噪和基线校正处理。 其中, 基线校正主要针对水的一级倍频区1 300~1 600 nm范围, 并采用二阶21点Savitzky Golay 滤波去噪, 以提高光谱信噪比。 预处理后的光谱如图1所示。
由图1所示, 1 300~1 600 nm范围内水溶液和100 mg· dL-1葡萄糖水溶液在34, 36和38 ℃下的吸光度光谱中可以看出, 1 450 nm附近波长范围内的谱峰较宽且光谱重叠, 其中包括了水分子的不同结构和葡萄糖分子中羟基、 甲基的吸收特征。 放大1 425~1 465 nm范围内的吸收光谱细节后可以观察到, 在温度扰动下, 水溶液和葡萄糖水溶液的吸收峰随温度的升高向短波方向移动, 但是从吸收光谱中无法分辨二者的差别。
为了分辨吸收光谱中温度及浓度扰动对吸收峰造成的微小变化, 采用式(1), 计算不同扰动下葡萄糖水溶液的吸收光谱的异步谱, 结果如图2和图3所示。
图2(a)和(b)为100 mg· dL-1的葡萄糖浓度下温度扰动导致的2T2D-COS异步谱(参考光谱温度: 34 ℃, 样本光谱为: 36 ℃)。 从图中可以看出, 不同温度扰动下的2T2D-COS异步谱峰值大小不同, 但都在1 474和1 410 nm附近都形成了正的交叉峰, 分别对应于水分子的强氢键特征吸收和弱氢键特征吸收波长。 这表明, 当样本光谱的温度高于参考光谱的温度时, 样本光谱弱氢键对应的吸收峰增强, 而强氢键对应的吸收峰减弱。 分析认为当温度升高, 会引起氢键断裂, 水团簇解离, 导致强氢键结合水向弱氢键结合水方向转换。
图3(a)和(b)为36℃时糖浓度扰动导致的2T2D-COS异步谱(参考光谱: 0 mg· dL-1, 样本光谱分别为: 100和200 mg· dL-1)。 从图中可以看出, 不同糖浓度扰动的异步谱在(1 450, 1 380 nm)和(1 582, 1 448 nm)位置附近都形成了正的交叉峰, 且峰值大小接近。 其中, 1 448 nm对应于水分子一级倍频区的特征吸收波长1 450 nm, 1 582 nm对应于葡萄糖分子羟基的特征吸收波长1 595 nm。 这表明, 当样本光谱中葡萄糖浓度大于参考光谱时, 浓度扰动产生的异步谱特征在葡萄糖及水的特征吸收位置均有明显体现, 并且与温度扰动的特征差异较大。
不同扰动下的实验结果表明, 2T2D-COS异步谱可以有效地区分糖水溶液吸收光谱中的温度扰动特征和浓度扰动特征。 温度扰动引起的糖水溶液2T2D-COS异步谱交叉峰出现在强氢键结合水和弱氢键结合水对应的特征吸收波长处, 而糖浓度扰动引起的2T2D-COS异步谱交叉峰出现在水分子一级倍频区和葡萄糖分子羟基对应的特征吸收波长处。 由于不同温度扰动引起的一部分谱峰强度差异较大, 因此可以根据2T2D-COS异步谱中特征峰的强度变化, 进一步定量分析样品中温度扰动的大小。
根据2T2D-COS异步谱分析可知, 1 410 nm处的交叉峰主要与温度扰动相关。 分别提取34~38.5 ℃范围内温度扰动下的所有样品2T2D-COS异步谱中的切片谱(切片方向如图2中黑色虚线位置), 对每个温度下所有样品的切片谱取平均值, 如图4所示。 分析切片谱的结果可知, 1 410~1 600 nm波段对应的切片谱相关强度随温度升高而增大, 与温度变化之间具有较好的相关性。 尤其在1 471~1 479 nm处形成了较为明显的峰值, 峰值强度与温度之间存在较为明显的线性关系, 随着温度的升高, 吸收峰的强度增大, 为基于光谱特征的样品温度定量分析提供了基础。
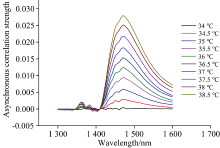 | 图4 不同温度下葡萄糖水溶液2T2D-COS 异步谱1 410 nm处的切片谱Fig.4 The slice spectrum at 1 410 nm of 2T2D-COS asynchronous spectra of glucose aqueous solution at 1 410 nm under different temperatures |
由于原始光谱中温度的变化特征比较复杂, 往往需要借助多变量分析方法, 其精度容易受到光谱测量范围及分辨率的影响。 而借助2T2D-COS异步谱, 可以提取温度扰动明显的交叉峰, 简化定量分析模型, 并降低对系统测量范围和波长分辨率的要求。
为了方便对比, 分别基于原始光谱和2T2D-COS异步谱建立了温度校正模型。 其中, 基于原始光谱的模型以1 300~1 600 nm范围内全部波长下的光谱(共301个波长)为输入, 采用偏最小二乘回归法建立温度预测模型; 基于2T2D-COS异步谱中温度扰动的特征波长1 410 nm下的切片谱, 以波长(1 475± 4) nm范围内交叉峰强度积分为输入, 建立谱峰强度与温度之间的线性回归模型。 在测量得到的240条光谱基础上, 使用Kennard-Stone算法划分校正集和预测集, 表1中对比了两种温度校正模型的结果。
| 表1 两种温度校正模型的结果对比 Table 1 The comparison of results of the two temperature calibration models |
从表1中的分析结果可以看出, 利用2T2D-COS分析方法提取的交叉峰特征, 可以在有限的波长范围及分辨率较低的情况下比较准确地预测每条光谱的温度。 基于2T2D-COS异步谱建立的温度校正模型的预测能力, 与基于高分辨宽谱段光谱的偏最小二乘回归模型相当, 或稍有提高。
在实际应用中, 2T2D-COS分析方法只需要对两条测量光谱进行运算, 就可以通过异步谱中交叉峰的变化, 判别扰动的来源, 还可以根据交叉峰的强度对扰动的大小进行定量分析, 具有较好的应用前景。 以在体无创血糖检测应用为例, 由于在体测量中扰动因素较多, 从原始光谱中很难分辨扰动的来源及大小。 根据本研究结果, 基于2T2D-COS的异步谱, 可以分辨出光谱中葡萄糖浓度扰动及温度扰动的交叉峰及特征波长范围; 同时, 基于温度扰动的特征波长1 410 nm下异步谱的切片谱, 对(1 475± 4) nm范围内的交叉峰进行强度积分后与温度进行线性回归, 可以准确地获取样品温度。 该方法所用的建模数据只需要较窄的特征波段范围, 与常用的单波长激光器的谱宽近似, 为简化在体光谱测量系统的设计, 减少在体温度变化的影响提供了重要参考。
针对近红外光谱分析应用需要, 提出了一种基于2T2D-COS的温度扰动光谱特征识别及定量分析方法。 根据无创血糖在体测量条件, 配制了与人体血糖浓度接近的葡萄糖水溶液样本, 并测量了样本在体温变化范围内的透射光谱。 基于2T2D-COS分析了浓度扰动及温度扰动下的样品光谱, 采用异步谱中交叉峰的位置及变化特征, 可以准确地识别光谱变化的扰动来源。 进一步, 提取了异步谱中温度扰动特征波长下的切片谱, 利用切片谱中(1 475± 4) nm范围内的谱峰强度积分对样品温度建立了线性回归模型, 预测能力与基于原始全波段光谱的偏最小二乘回归模型基本相当。 这表明, 2T2D-COS分析方法不仅可以准确分辨光谱变化的扰动来源, 还可基于较窄特征波段范围内的数据实现对样品温度的准确预测, 为简化在体光谱测量系统的设计、 减少温度扰动对在体光谱测量的影响提供了重要参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|