作者简介: 李帅伟, 1997年生, 太原科技大学应用科学学院硕士研究生 e-mail: lishuaiwei@stu.tyust.edu.cn
目前, 核酸检测已成为了我国新型冠状病毒感染确诊的“金标准”, 然而核酸检测在检测过程中受到病程、 标本采集、 检测过程、 检测试剂等因素的影响, 容易出现检测结果“假阴性”而漏诊的情况。 检测血清中的新型冠状病毒特异性IgM和IgG抗体已作为新冠病毒检测的辅助手段, 可以用来弥补核酸检测的“假阴性”短板, 提高检测阳性率。 论文介绍了一种成本低的便携式新冠IgM和IgG抗体定量检测仪。 检测仪由CPU信号处理模块、 光源驱动模块、 多光谱探测模块、 电源模块、 显示存储和通信模块等组成。 采用荧光免疫层析技术使待测样本中的IgM和IgG抗体与量子点相结合, 并将其截留在试纸条的T线。 方波调制后的光源驱动模块驱动紫外LED, 其出射紫外光通过一种屋脊形的光学系统垂直照射在免疫荧光层析试纸条的T线和C线上, 量子点标记物被光源激发辐射出红色荧光, 红色荧光透过窄带滤光片后被多光谱探测模块所捕获; 多光谱信号在CPU中进行FFT变换得到其频谱特征量, 利用信号波段和参考波段的特征量的比值进行归一化处理消除背景和环境干扰信号计算得到荧光强度, 根据标定系数, 从而确定IgM和IgG抗体的含量。 最终检测结果显示到UI界面上同时上传到服务器数据库中, 可通过计算机端进行远程查询实现数据共享和信息化管理。 采用正常人血清样本作为测量试剂, 进行了重复性实验, 实验表明, CV值在0~8.30%之间, 其中T线的CV值仅为3.45%。 将含有IgG与IgM抗体的溶液, 利用梯度稀释法得到一系列不同质量浓度的样品溶液进行线性度实验, 采用线性度最小二乘法对检测结果进行曲线拟合, 拟合系数为0.997 5。 最后, 通过新冠疫苗血清抗体检测的实验表明, 检测仪的阳性检出率为75%。 该检测仪结构精巧、 功耗低、 操作简便、 性能良好, 可作为辅助手段有效提高新型冠状病毒感染的阳性检出率。
Nucleic Acid Testing (NAT) has become the “gold standard” for diagnosing SARS-Cov-2 infections in China. However, NATis affected by factors such as the disease course, specimen collection, the testing process, which are prone to false positives and missed diagnoses. The detection of SARS-Cov-2-specific IgM and IgG antibodies in serum has been used as an auxiliary method for SARS-Cov-2 detection, which can remedy the “false negative” shortcomings of NATand improve the positive rate of detection. A low-cost portable device is proposed in the paper for SARS-Cov-2 IgM and IgG antibody quantitative measurement. The device comprises a CPU signal processing module, a light source driver module, a multi-spectral detection module, a power supply module, and a display storage and communication module. Fluorescence immunochromatography technology combines the IgM and IgG antibodies in the sample to be tested with the quantum dots and trapsthem on the T line of the test strip. The light source driver module with a square-wave modulation is utilized to simulate the ultraviolet LED. Consequently the emitted ultraviolet light illuminates the T line and C line of the immunofluorescence chromatography test strip through a roof-shaped optical system. The quantum dot marker is excited by the light source to emit red fluorescence, and then the red fluorescence is captured by the multi-spectral detection module passing through the narrow-band filter. Then, the multi-spectral signal is subjected to the FFT transformation in the CPU to obtain its spectral feature. The ratio of the feature of the signal band and the reference band is applied for normalization processing to eliminate the background and environmental interference signal and to calculate the fluorescence intensity. The final detection results are displayed on the UI and uploaded to the server database, and data sharing and information management can be realized through a remote query on the computer. Therefore, the contents of IgM and IgG antibodies are determined according to the calibration coefficient of the feature ratio. Repeated experiments have been carried out using normal human serum samples as measurement reagents. The experimental results show that the CV value ranges from 0 to 8.30%, among which the CV value of the T line is only 3.45%. Two types of solution containing IgG and IgM antibodies are used to prepare a series of sample solutions with different mass concentrations using the gradient dilution method for the linearity experiment.The result is fitted by the least square method with a fitting coefficient of 0.997 5. Finally, the serum antibody test of the SARS-Cov-2 vaccine shows that the positive detection rate is up to 75%. The device has a tiny structure, low power consumption, simple operation and good performance. Therefore, it can be applied as an auxiliary means to improve the positive detection rate of SARS-Cov-2 infection effectively.
由严重性呼吸综合征冠状病毒-2(SARS-CoV-2)引起的新型冠状病毒肺炎(COVID-19)是一种呼吸道传染病[1]。 新型冠状病毒肺炎大规模流行已经持续很长时间了, 由于SARS-CoV-2可通过呼吸道传播, 因此早期诊断对切断传播途径仍具有很重要的意义[2]。
目前COVID-19检测使用最广泛最常用的是RT-PCR核酸检测技术[3], 但是由于标本采集、 检测过程、 检测试剂等因素的影响, 容易出现“ 假阴性” 的情况[4], 因此仍需要快速、 灵敏的血清学抗体检测。 由于人体在感染SARS-CoV-2之后并不会马上产生IgG和IgM新冠特异性抗体[5], 因此抗体检测主要作为核酸检测的一种补充测试, 从而减少核酸检测的“ 假阴性” 情况, 并且能够识别既往感染者或者新冠疫苗接种者。
酶联免疫法和免疫层析胶体金法是目前检测SARS-CoV-2抗体的两种常用方法。 酶联免疫法需要由专业的操作人员使用昂贵的实验设备来检测, 而且消耗时间长[6]。 虽然免疫胶体金法具有操作方便、 成本低、 检测快速的优点, 但仍存在背景干扰大、 检测灵敏度低、 无法定量检测等缺陷。 国外的Grzelak等开发了一种通过在人类胚胎肾293T细胞表面表达S蛋白来检测抗棘突蛋白抗体的技术, 该技术将细胞与人血清样本和荧光抗体IgG或抗体IgM一起孵育, 然后通过流式细胞术进行评估[7]。 Horndler等通过在人类白血病T细胞系上表达SARS-CoV-2 S蛋白开发了一种类似的方法[8]。 然而, 这些方法不适用于即时检测, 因为它们需要流式细胞仪设备和细胞培养, 必须保持稳定才能提供敏感检测。 Cameron等描述了一种检测抗N、 S和受体结合域(RBD)抗体的检测方法[9], 然而此方法只能在实验室中实现[10]。 针对以上几种方法的不足, 本文设计了一种快速、 定量、 便携、 低成本、 易于操作的多光谱量子点新冠IgM和IgG抗体定量检测仪。 该方法不需要专业的医护人员, 可进行大规模筛查, 检测样本容易获取, 无需某些实验室专用设备, 允许在医疗机构、 家庭和现场使用, 同时具有高灵敏度高特异性的特点, 可作为核酸检测的一种补充测试, 为战胜疫情提供有力支持。
论文所采用的荧光免疫层析试纸条主要由样品垫、 结合垫、 NC膜、 吸水纸和支持板组成, 结合垫上喷涂有SARS-CoV-2 N蛋白-量子点微球标记物, NC膜上设有含抗人IgG抗体或含抗人IgM抗体的检测线T线和质控线C线[11]。 样品垫上滴加的血清样本在毛细作用下向吸水垫方向流动, 如果血清样本中含有抗SARS-CoV-2 IgG和IgM抗体, 在流经结合垫时便会与量子点微球标记物相结合。 当样本流经NC膜时, 抗IgG抗体或抗IgM抗体结合在T线上, 如果样本中不含有抗SARS-CoV-2 IgG和IgM抗体, 则不会在T线截留量子点微球标记物。 紧接着剩余的混合物会流动到控制线区域。
量子点是目前在生物医学领域前景非常广阔的纳米材料, 其相比于传统的荧光染料, 具有连续且范围宽的激发光谱、 光化学稳定性良好、 受外部因素干扰小。 论文选用了上海昆道生物技术有限公司的免疫层析专用量子点纳米球(QDNBs), 其粒径为(100± 20) nm, 激发波长为365~450 nm, 发射波长为(620± 10) nm。
量子点微球在365 nm紫外激发光下, 会产生红色荧光信号, 量子点标记物浓度不同荧光信号强度也会不同, 如图1所示。 当激发光照射在NC膜上, 且T线上含有量子点微球标记物, 则T线会发出红色荧光变成红色线条, 而无论样本中是否含有IgG和IgM抗体C线都会变成红色, 如果C线未显色则说明本次检测结果无效。 本文所设计的检测仪便是通过检测荧光强度来得知血清中抗SARS-CoV-2 IgG抗体和IgM抗体的浓度, 从而确定样本是否为阳性及其强度。
采用了一种方波调制与频谱分析相结合的方法, 对测量波长和参考波长的光谱信号使用快速傅里叶变换(FFT)由时域转换到频域进行分析处理, 从而极大地提高了检测仪的灵敏度和信噪比。 首先, CPU获取到经过紫外LED方波调制后激发量子点荧光的多光谱信号, 获取到的多光谱信号为方波信号。 通过串口把测量波长和参考波长的方波信号数据保存到电脑中, 使用MATLAB读取电脑中保存的数据, 用小波滤波算法对读取到的数据进行滤波, 把优化后的小波滤波系数写入CPU的存储模块。 然后, CPU处理模块就可以通过存储的滤波系数对实际测量时采集到的多光谱信号数据进行分块卷积运算以便进行后续信号处理。 经过多次测试表明, 光源噪声和探测器噪声能够被此方法有效滤除, 从而提高检测仪的探测灵敏度[12]。
通过FFT变换将滤波后的方波信号由时域转换到频域[13]。 多光谱芯片采集回来的每一个通道的方波信号可由式(1)表示
$\begin{array}{*{35}{l}} {{I}_{\text{in}}}=\frac{4}{\text{ }\!\!\pi\!\!\text{ }}A\left( \text{sin}\omega t+\frac{1}{3}\text{sin}3\omega t+\frac{1}{5}\text{sin}5\omega t+\frac{1}{7}\text{sin}7\omega t+\ldots \right) \\ =\frac{4}{\text{ }\!\!\pi\!\!\text{ }}\text{A}\overset{\infty }{\mathop{\underset{n=1}{\mathop \sum }\,}}\,\frac{1}{2n-1}\text{sin}\left[ \left( 2n-1 \right)\omega t \right] \\ \end{array}$(1)
式(1)中, Iin为发射光强, A是幅度常数, ω 为基频。
方波信号的拉普拉斯变换为
$\text{L}\left( {{I}_{\text{in}}} \right)=\frac{4}{\text{ }\!\!\pi\!\!\text{ }}\text{A}\overset{\infty }{\mathop{\underset{n=1}{\mathop \sum }\,}}\,\frac{\ \ \ \omega \ \ \ \ }{{{s}^{2}}+{{[\left( 2n-1 \right)\omega\ ]}\ ^{2}}}\ \ $(2)
通过传递函数将荧光信号表示为
$\text{Y}\left( \text{s} \right)=\text{G}\left( \text{s} \right)\frac{4}{\text{ }\!\!\pi\!\!\text{ }}\text{A}\overset{\infty }{\mathop{\underset{n=1}{\mathop \sum }\,}}\,\frac{\omega }{{{s}^{2}}+{{[\left( 2n-1 \right)\omega ]}\ \ ^{2}}}\ \ $(3)
时域输出信号可以表示为
$\text{y}\left( \text{t} \right)=\frac{4}{\text{ }\!\!\pi\!\!\text{ }}\text{A}\overset{\infty }{\mathop{\underset{n=1}{\mathop \sum }\,}}\,\frac{1}{2n-1}\left| G\left( i\left( 2n-1 \right)\omega \right) \right|\cdot \text{sin}\left[ \left( 2n-1 \right)\omega t+{{\varphi }_{2n-1}} \right]$(4)
式(4)中, |G(i(2n-1)ω )|为信号特征量, 使用ST公司提供的DSP库做快速傅里叶变换能够计算出频谱信号。
特征量为频谱信号中基频、 三次谐波和五次谐波的幅度值, 量子点的发射光峰值波长为624 nm, 试验中将多光谱芯片630 nm通道的数据作为测量波长, 将590 nm通道的数据作为参考波长, 求得630 nm通道与590 nm通道的特征量比值, 即
${{R}_{1}}=\frac{{{I}_{\lambda =630\text{nm}}}\ \ \ \ \ \ }{{{I}_{\lambda =590\text{nm}}}\ \ \ \ \ \ }\ \ \ $(5)
荧光强度关系由630 nm通道与590 nm通道的特征量比值标定, 把标定好的系数存于内部存储模块中, 实际测量时, 将测量到的R1值代入到标定好的荧光强度关系式中, 计算出试纸条C线和T线的荧光强度。 最后将试纸条T线的荧光强度与C线的荧光强度代入到标定好的浓度关系式中得出抗体浓度。
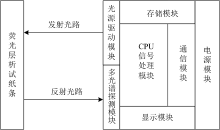
检测仪主要包括CPU信号处理模块、 光源驱动模块、 多光谱探测模块、 电源模块、 显示存储和通信模块, 设计框图如图2所示。 CPU信号处理模块选用了ST公司的STM32F405RGT6微处理器, 将发射角为60° 的紫外LED灯作为光源, 其发射波长为365 nm, 功率为250 mW, 多光谱探测模块选用了艾迈斯半导体的AS7341L多光谱芯片。 检测仪的工作原理为: STM32芯片产生频率为5 Hz的调制方波信号驱动紫外LED灯发射出365 nm的紫外光, 试纸条T线和C线上的量子点标记物被经过调制的紫外光激发产生620 nm左右的红色荧光。 AS7341L将经过滤光片的荧光信号捕获转换成数字信号, 然后通过IIC总线传给STM32芯片。 STM32芯片对读取到的数字信号进行运算得到荧光强度, 结果和检测信息在显示模块上显示出来, 通过存储模块和通信模块进行数据本地存储和云端存储。
多光谱芯片AS7341L是一款专用于移动设备光谱识别和分析应用的10通道光谱传感器芯片。 其中有1个近红外通道、 1个全光域通道和8个覆盖可见光谱的光学通道, 光谱的响应波长为350~1 000 nm。 其可见光谱范围内的8个光学通道如表1所示, 本文检测仪将F7通道(带宽为50 nm)采集回来的波长信号作为测量波长, 将F6(带宽为40 nm)通道采集回来的波长信号作为参考波长。
| 表1 AS7341L光学通道 Table 1 AS7341L optical channel |
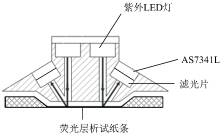
传统的光学传感器检测方法, 光路设计都十分复杂, 而且会被激发光和背景光等各种光源影响。 本文独创性地设计了一种屋脊形的机械光学系统, 可以有效去除紫外LED背景波长和环境光信号, 同时提高了多光谱探测灵敏度。 检测仪的机械光学系统设计如图3所示。 屋脊形的机械装置包含了发射光路和反射光路。 两个紫外LED灯分别安装在荧光层析试纸条T线和C线的正上方。 发射光路和反射光路呈45° 角, 可有效提高反射光信号的接收效率, 滤光片和多光谱探测模块装在反射导光孔上。
紫外LED灯发射出经过调制的紫外光信号垂直照射在试纸条的T线和C线, 量子点标记物辐射出的荧光在45° 角方向上经过滤光片。 带通滤光片中心波长为(620± 10) nm, 带宽为± 40 nm, 可滤除其他紫外LED光源及环境背景等噪声光信号。 AS7341L将经过滤光片的荧光信号捕获转换成数字信号传给CPU处理模块。
所有实验均在山西瑞豪生物科技有限公司完成, 该公司具有GMP体外诊断试剂生产和研发实验室, 免疫层析试纸条、 血清样本以及疫苗抗体试验均在该公司完成。
将正常人血清进行重复性测试, 连续测试6次, T和C分别表示T线和C线的荧光强度, 测试数据如表2。
| 表2 检测仪重复性测试结果 Table 2 Repeatability test results of the detector |
使用变异系数(CV)来评价检测仪的重复性, CV值为标准差与平均值的比值。 从表2可以看出, 检测仪的检测结果CV值在0~8.30%之间, 其中T线的CV值仅为3.45%。
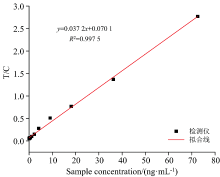
为了测试检测仪的线性度, 将含有IgG与IgM抗体的溶液, 梯度稀释后得到72.5、 36.25、 18.125、 9.06、 4.13、 2.27、 1.13、 0.57、 0.28、 0.14、 0.071、 0.035和0.018 ng· mL-1等不同质量浓度的样品溶液。 将不同质量浓度的溶液加样在荧光免疫层析试条上, 经过特定反应时间后, 用本检测仪依次进行测试。 以标准样品中IgG和IgM抗体的浓度(ng· mL-1)为横坐标, T线与C线的比值为纵坐标, 对测试结果进行线性拟合, 结果如图5所示。 其中线性拟合度> 0.99, 实验结果表明, 在该浓度范围内, 仪器的线性度良好。
从山西瑞豪生物科技有限公司选取36名已接种两剂新冠疫苗的员工, 其中18名为男性18名为女性, 大部分员工接种疫苗的时间不相同。 从这些员工身上采集36份血清样本使用本文所设计的检测仪进行检测, 检测时间为2021年7月30日。 由于IgM抗体具有维持时间短的特点, 本文只对维持时间长且浓度更高的IgG抗体进行检测, 与正常人血清的测试结果相比较判定阴性与阳性, 检测结果如表3所示。
| 表3 正常人血清样品IgG抗体检测 Table 3 IgG antibody detection in normal human serum samples |
9份阴性样本的员工信息如表4所示, 其中5名员工的接种时间均已超过半年, 1名员工第二剂接种时间未超过一周, 剩余3名员工在IgG抗体产生的时间范围内, 但用本文检测仪检测为阴性。
| 表4 IgG抗体阴性样本信息 Table 4 IgG antibody negative sample information |
介绍了一种以STM32F405为核心的便携式量子点新冠IgM和IgG抗体定量检测仪, 使用量子点作为抗体的荧光标记物, 通过对多光谱芯片采集到的荧光光谱信号进行方波调制与频谱分析, 实现了对人体内IgG和IgM抗体水平的快速定量检测。 在检测仪的重复性测试实验中, 变异系数小于10%; 在线性度测试实验中, 检测仪检测到的T线与C线荧光强度的比值与IgG和IgM抗体的浓度呈良好的线性关系, 线性拟合相关度达0.997 5; 在实际新冠疫苗血清IgG抗体的检测中, 阳性检出率为75%。 本检测仪体积轻小, 操作简单, 可实时上传数据, 方便信息化管理, 同时重复性好, 线性度好, 灵敏度高, 可作为一种辅助核酸检测手段, 为疫情提供有力支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|