作者简介: 温平威, 1984年生,江西师范大学化学化工学院博士研究生 e-mail: wenpingwei@ncu.edu.cn
基于传统热处理方式的蛋白质糖基化反应存在反应时间长、 易产生有害糖基化反应末期产物等缺点。 以卵类粘蛋白(OVM)-还原糖(1∶0.03, W/W)体系为对象, 研究新型高温热处理技术-过热蒸汽对OVM糖基化反应及蛋白质结构的影响。 结果表明: 短时间(1~3 min)的过热蒸汽(110和120 ℃)处理即可促使OVM发生糖基化反应, 其中不同糖的糖基化反应活性顺序为核糖(五碳糖)>葡萄糖(六碳糖)>乳糖(二糖), 糖基化反应后蛋白质的自由氨基含量由19.97 mg·mL-1分别最低降为2.93, 5.04和6.69 mg·mL-1。 不同条件处理下OVM糖基化产物的紫外光谱未见显著的波峰位移, 但最大吸收峰峰值发生一定的变化, 其中大部分为降低的, 说明OVM的球蛋白分子结构发生变化, 还原糖的修饰掩盖了OVM上的发色基团(苯丙氨酸和酪氨酸), 其中核糖糖基化反应下效果最为显著。 糖基化反应后, 荧光光谱峰强度显著降低, 其中核糖糖基化反应降低率最大, 其次为葡萄糖和乳糖, 表明蛋白质内部暴露的荧光基团去折叠导致荧光猝灭。 此外, 还原糖作为猝灭剂渗透入蛋白质框架中, 与荧光基团反应, 抑制其荧光发射。 红外光谱分析发现经过热蒸汽处理后OVM糖基化产物3 300 cm-1处的峰变窄, 表明N—H的含量减少或者发生反应, 从而使N—H伸缩振动频率降低。 2 000~2 500和500 cm-1附近出现了较多杂峰, 表明蛋白质发生降解或者有糖基化反应中间产物生成。 MALDI TOF MS分析表明热蒸汽处理下, OVM-核糖体系、 OVM-葡萄糖体系各有约6个糖基化反应位点, OVM-乳糖体系有约2个糖基化反应位点。 糖基化反应后有OVM二聚体、 三聚体和多聚体形成, 其中核糖和葡萄糖与OVM反应产生的聚合物最为显著, 乳糖与OVM反应产生的聚合物较少。 该研究可为短时微糖糖基化反应及过热蒸汽在食品加工中的应用提供一定的技术和理论指导。
Protein glycation reaction based on traditional heating methods has disadvantages, such as long reaction time consumption and easy to produce harmful advanced glycation end products. In this study, the ovomucoid (OVM)-reducing sugar (1∶0.03, W/W) system served as the research object, effects of superheated steam, a new high-temperature treatment technology, on the OVM glycation and protein structure were studied. The results showed that the glycation of OVM was induced by a short time (1~3 min) of superheated steam treatment (110 and 120 ℃), and the sequence of glycation reaction activity of different sugars was ribose (pentose) >glucose (hexose) >lactose (disaccharide). After glycation, the free amino content of protein decreased from 19.97 mg·mL-1 to the minimum of 2.93, 5.04 and 6.69 mg·mL-1, respectively. The ultraviolet spectra of OVM glycation products under different processing conditions showed no significant changes in wave displacement. However, the maximum absorption had some changes, with most of them were reduced, indicating OVM globulin molecular structure was altered, and the chromophore groups (phenylalanine and tyrosine) of OVM were masked by the reducing sugars. The effect was most significant under ribose glycation. After glycation, the fluorescence intensities were significantly decreased, in which the ribose glycation decreased the most, followed by glucose and lactose, indicating that the fluorescence quenching occurred, which resulted from the folding of exposed fluorophore in protein. In addition, reducing sugar as a quenching agent penetrated the protein framework and reacted with fluorophore, inhibiting the fluorescence emission. Fourier transform infrared spectroscopy showed that, after superheated steam treatment, the protein peak at 3 300 cm-1 became narrow, indicating that the content of N—H decreased or a reaction occurred, thus reducing the stretching vibration frequency of N—H. Some fingerprint peaks in the vicinity of 2 000~2 500 and 500 cm-1appeared, indicating that the protein degradation or glycation middle product formation occurred. MALDI TOF MS analysis showed that there were about 6 glycation reaction sites in each the OVM-ribose system and OVM-glucose system, and about 2 glycation reaction sites in the OVM-lactose system. Moreover, after glycation, OVM dimer, trimer and multimer were formed. Ribose and glucose produced the most significant polymers with OVM, while lactose produced fewer polymers with OVM. This study can provide technical and theoretical guidance for the glycation reaction featured by trace amounts of sugar participation, short time consumption, and application of superheated steam in food processing.
水在特定压力(100 ℃, 101.325 kPa)下受热, 达到沸点后形成饱和蒸汽, 对饱和蒸汽继续加热, 使其达到沸点以上温度, 饱和蒸汽会转化为过热蒸汽。 加工过程中, 过热蒸汽先冷凝于物料表面, 传递大量热量到物料, 使其温度迅速升高到水分蒸发点, 发生水分蒸发, 蒸发的水分可被过热蒸汽吸收, 物料中的水分或挥发性成分会随着过热蒸汽排出[1]。 此外, 废气中残留热能也可以在其他操作单元中进行再利用[2]。
过热蒸汽独特的加工方式赋予其特殊的应用。 Satou等[3]将过热蒸汽用于糙米、 燕麦和马铃薯等的灭酶, 研究发现125~130 ℃过热蒸汽处理糙米0.25~2 min可以使糙米中的酶失活, 且不影响淀粉品质, 显著改善其储存稳定性; Head等[4]采用过热蒸汽技术替代窑干处理燕麦粒, 其品质与商业加工在货架期、 颜色、 冷糊粘度、 游离脂肪酸含量和感官属性上没有显著差异, 但是过热蒸汽处理燕麦释放出的己醛含量更低, 具有更安全的加工特性。 可见过热蒸汽对酶类等分子的变性具有一定的促进作用, 且作用时间段, 不会产生其他的有害物质。
卵类粘蛋白(OVM)是鸡蛋蛋白的重要组分, 对蛋清蛋白的营养和功能性质起着重要作用。 大量研究表明糖基化反应可以改善蛋白质的营养和功能性质, 然而传统的热处理方式糖基化存在处理时间长, 易产生有害糖基化反应末期产物(AGEs)等缺点[5]。
利用过热蒸汽穿透力强、 快速升温、 瞬间缺氧、 蒸发水分等优点[6], 将过热蒸汽作用于OVM-还原糖体系, 达到促进OVM糖基化修饰的目的。 为了更好地发挥过热蒸汽促进糖基化反应的优势, 同时减少还原糖用量, 本研究创新性地采用3%的糖添加量来达到微糖瞬时糖基化修饰的效果。 相较于传统热处理糖基化, 本方案的创新和优势如下: 一是以过热蒸汽作为热源提供热量, 可以快速渗透到蛋白质分子内部, 促进蛋白质分子内和分子表面的糖基化反应; 二是高温状态下的缺氧可以限制蛋白质糖基化产物的进一步氧化产生高级产物; 三是水分瞬间蒸发可以促进反应向糖基化修饰的方向发展; 四是加入与蛋白质含量相差非常大的还原糖, 使还原糖和蛋白质充分混合, 减少还原糖之间的相互作用, 降低焦糖化反应。
OVM、 D-葡萄糖、 D-核糖、 D-乳糖均购自Sigma化学试剂公司; 其他试剂均为国产分析纯。
U-2910型紫外可见分光光度计, 日本Hitachi公司; F7000荧光光谱仪, 日本Hitachi公司; MALDI-TOF质谱仪, 美国AB Science公司; 傅里叶红外光谱仪, 美国Thermo Nicolet公司。
1.2.1 样品制备
分别称取三份3 g OVM原料, 每份原料中添加质量比为3%的D-核糖、 D-葡萄糖和D-乳糖, 分别溶于100 mL超纯水。 每组蛋白-糖混合溶液分别分装至7个离心管中, 在-80 ℃冰箱中预冻24 h后用真空冷冻干燥机冻干。 冻干后混合物的含水量为2.00%±0.05%。 冻干后的OVM-还原糖(OVM+R, 卵类粘蛋白-核糖; OVM+G, 卵类粘蛋白-葡萄糖; OVM+L, 卵类粘蛋白-乳糖)混合物样品分别于过热蒸汽处理室内中进行热处理。 处理温度为110和120 ℃。 处理时间为1, 2和3 min。 所处理的样品密封后置于-20 ℃冰箱中备用。
1.2.2 自由氨基含量测定
邻苯二甲醛(OPA)法被用来检测OVM样品中自由氨基含量的变化, 从而评估过热蒸汽处理后OVM的糖基化反应程度。 测定前需要对OPA溶液进行现配, 其方法如下: 准确称取4 mg OPA粉末于小烧杯中, 加入1 mL甲醇搅拌溶解, 依次加入2-巯基乙醇(100 μL)、 四硼酸钠溶液(0.1 mol·L-1, 25 mL)、 十二烷基硫酸钠(SDS)溶液(2.5 mL, 20%(W/V)), 充分搅拌至混合均匀, 然后转移到容量瓶定容至50 mL。 将OVM样品溶液与OPA于37 ℃反应2 min, 在340 nm处测量吸光度。 以亮氨酸溶液作为标准品绘制标准曲线, 计算蛋白质中的自由氨基含量。 每个样品设置3个平行。
1.2.3 紫外光谱分析
用PBS缓冲液将OVM样品稀释至1 mg·mL-1, 采用紫外光谱仪(日立)对OVM样品进行紫外和可见光谱扫描, 扫描范围为200~500 nm。 每个样品扫描三次。
1.2.4 内源荧光光谱分析
用PBS缓冲液将OVM样品稀释至0.2 mg·mL-1, 采用荧光光谱仪(日立F7000)进行OVM样品的内源/同步/三维荧光光谱扫描[7]。 内源荧光测定参数如下: 激发波长290 nm, 扫描范围300~400 nm, 激发和发射狭缝宽度分别为5 nm, 扫描速度240 nm·min-1, 电压400 V。
1.2.5 傅里叶变换红外光谱分析
称取3 mg不同过热蒸汽处理的OVM糖基化样品, 加入少量KBr粉末(蛋白、 KBr质量比为1∶ 50), 在日光灯的照射下研磨均匀, 经过液压压片后, 采用傅里叶红外光谱仪进行扫描, 每个样品的红外光谱为连续扫描32次的平均图谱[8]。
1.2.6 基质辅助激光解吸/电离飞行时间质谱(MALDI TOF MS)分析
糖基化反应后OVM的分子量变化采用MALDI-TOF MS(4800 Plus MALDI-TOF/TOF Analyzer, AB Science, 美国)的方法分析[9]。 OVM样品以1∶ 100的比例溶解于蒸馏水中。 将芥子酸(5 mg·mL-1)溶于含有50%乙腈和0.1%TFA的溶液中制备基质溶液, OVM溶液与基质溶液以1∶ 1的比例混合, 室温下干燥, 然后将混合物(2.0 μL)滴到MALDI目标板上进行检测。
蛋白质的糖基化修饰一般是基于美拉德反应的化学修饰, 即蛋白质中的自由氨基(位于赖氨酸、 精氨酸的侧链和蛋白质N-末端氨基)与还原糖(如核糖、 葡萄糖、 半乳糖等)的羰基发生共价结合, 使糖分子以共价键的形式连接到蛋白质的主链或者侧链[10]。
糖基化修饰会影响蛋白质侧链基团的化学活性, 改变蛋白质的分子结构、 静电荷和疏水性等, 进而对其乳化、 起泡、 凝胶等功能特性以及消化性、 致敏性等营养特性造成影响。 糖基化反应的主要残基为蛋白质的自由氨基, 蛋白质的自由氨基含量可以作为糖基化反应程度的指标[11, 12]。
研究了过热蒸汽处理过程中, 不同还原糖类型对OVM糖基化程度的影响, 结果如表1所示。 由于还原糖的结构和类型对蛋白质的糖基化修饰具有较大的影响, 选择五碳糖、 六碳糖和二糖(即核糖、 葡萄糖和乳糖)进行比较研究。 结果表明, 三种还原糖在过热蒸汽处理后均会促使OVM发生糖基化修饰, 参照样品中自由氨基含量为19.97 mg·mL-1, 经过核糖、 葡萄糖和乳糖修饰之后, 其自由氨基含量分别最低降为2.93, 5.04和6.69 mg·mL-1。 可以得出如下结论: 在过热蒸汽的微糖瞬时加热过程中OVM的糖基化修饰快慢程度为核糖>葡萄糖>乳糖, 与采用普通的低温糖基化、 高温加热糖基化得出的结论一致[13]。
| 表1 不同条件过热蒸汽处理下OVM糖基化产物的自由氨基含量 Table 1 Free amino contents of the glycated OVM treated by superheated steamat different conditions |
从过热蒸汽的处理温度上来看, 采用110和120 ℃处理是实现OVM糖基化修饰的最佳温度。 温度过高会导致OVM和还原糖的混合物瞬间发生反应形成聚合物, 不适用于蛋白质的糖基化修饰改性。 研究了110和120 ℃过热蒸汽处理1、 2和3 min后, OVM的自由氨基含量的变化。 随着处理时间的延长, 不同条件下不同样品的自由氨基均逐渐减少, 如OVM+R和OVM+G混合物在110 ℃下处理不同时间, 自由氨基含量均发生降低。 在处理1 min时, OVM的自由氨基含量相比空白对照样品发生了显著降低, 处理2 min后, 自由氨基的含量降低率减少。 然而当处理时间为3 min时, 自由氨基含量基本不发生变化。 有趣的是, 当温度升高到120 ℃时, OVM的自由氨基含量随着处理时间的延长均发生了显著的降低。 这可能与水分丢失和还原糖的替换有关系。 Allison研究认为在蛋白质失水过程中, 还原糖可以快速代替蛋白质中的水分子所在的空间位置, 并且与蛋白质上的自由氨基发生糖基化修饰[14]。
蛋白质上的亲水区域是还原糖发生反应的主要位置, 并且通过还原糖的位置替换, 可以保证蛋白质的构象结构不发生损坏。 当温度低时, 无法使蛋白质中的深层次水分瞬间带走, 不能实现进一步的糖基化修饰, 而较高温度可以带走蛋白质中的深层次结合水, 并使还原糖代替其空间位置, 实现蛋白质的糖基化修饰。
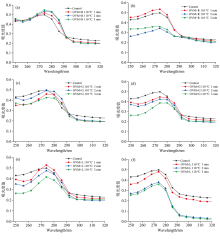
蛋白质的色氨酸、 酪氨酸和苯丙氨酸等的侧链基团和肽键对一定波长范围的紫外光具有一定的吸收, 使得蛋白质在280 nm处有最大吸收峰[15]。 通过分析发色团的吸收峰和强度变化, 紫外光谱可用于揭示蛋白质的构象变化[16]。 OVM中含有苯丙氨酸和酪氨酸, 不含色氨酸, 紫外光谱主要分析苯丙氨酸和酪氨酸残基及微环境变化。
如图1(a—f)分别所示, 经过不同温度和时间处理得到的OVM糖基化产物的紫外扫描光谱的峰形变化不大, 且未见显著的波峰位移, 但是最大吸收峰强度具有一定的变化, 这说明OVM分子的球蛋白结构发生改变。 与天然对照OVM相比, OVM-还原糖混合物经过热蒸汽处理后, 紫外吸收峰大部分强度降低, 可能是由于还原糖的修饰掩盖了OVM上的发色基团, 其中OVM+R在120 ℃处理2和3 min的样品的紫外吸收峰强度降低最显著, 说明该条件下苯丙氨酸和酪氨酸被还原糖掩盖的量较多; 有趣的是, 当OVM+R在120 ℃下处理1 min后, 其产物的紫外吸收峰值相比天然OVM有些提高, 可能是由于瞬间120 ℃高温将蛋白质中结合的水分子蒸发, OVM分子发生适当展开, 同时被核糖修饰的位点还不够多, 使其吸收峰增强。
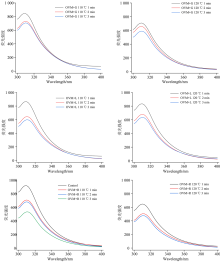
内源荧光光谱一般被用来揭示蛋白质荧光团附近的构象变化和分子微环境变化[17]。 OVM分子中有10个苯丙氨酸残基以及6个酪氨酸残基, 其中5个苯丙氨酸主要位于OVM的信号序列上, 另外5个苯丙氨酸主要位于蛋白质序 列上; 6个酪氨酸残基均位于OVM蛋白质序列上, 其内源荧光光谱主要表征苯丙氨酸附近的构象变化及其周边的微环境变化。
如图2所示, 与天然对照OVM相比, OVM+还原糖经过热蒸汽处理后, 内源荧光峰值显著降低, 其中OVM+R在120 ℃下处理3 min时, 其内源荧光降低率最大, 其次为OVM+G, OVM+L。 根据变化规律可以看出, 该变化趋势与还原糖的糖基化反应程度具有显著相关性。 一方面, 蛋白内部暴露的荧光团去折叠导致荧光猝灭。 另一方面, 还原糖作为猝灭剂渗透入蛋白质框架中, 与荧光团反应, 抑制其荧光发射[18]。
红外光谱能灵敏地反映出肽链结构的变化, 蛋白质的红外图谱有几组特征吸收谱带: 酰胺Ⅰ 、 酰胺Ⅱ 和酰胺Ⅲ , 其波长分别对应1 700~1 600, 1 530~1 550和1 260~1 300 cm-1范围[19]。 研究了过热蒸汽处理过程中, 不同还原糖类型对OVM糖基化产物红外图谱的影响, 进一步表征其官能团结构的变化规律。
由图3可知, 经过热蒸汽处理后的OVM-还原糖混合物的红外光谱图均发生了较大的变化。 酰胺A在红外光谱中的吸收峰出现在3 300 cm-1附近, 为N—H的伸缩振动所产生。 与对照OVM样品相比, 经过热蒸汽处理后的OVM-还原糖糖基化产物在3 300 cm-1处均出现一个非常尖细的单峰, 说明该酰胺种类为仲胺, 且由于受到糖基化修饰的影响, 该峰变得更窄。 这可能是由于N—H的含量减少或者发生反应, 从而使N—H伸缩振动频率降低。
OVM+R, OVM+G和OVM+L三个样品在110和120 ℃条件下处理不同时间后, 其产物的红外光谱图也发生不同的变化, 分别如图3(a, b, c)所示, OVM+R在120 ℃下处理2和3 min后, 红外光谱在2 000~2 500 cm-1附近出现了很多杂峰, 且在指纹图谱部分500 cm-1处也出现了较多杂峰, 分析认为高温反应较长时间导致蛋白质发生降解或者糖基化反应中间产物形成红外光谱峰。
 | 图3(a) 不同温度、 时间过热蒸汽郸理下卵类粘蛋白-核糖(OVM+R)糖基化产物的红外光谱Fig.3(a) Infrared spectroscopy of OVM+R glycation products treated by superheated steam at different processing temperature and time |
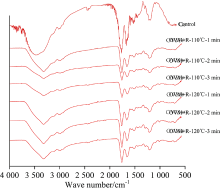 | 图3(b) 不同温度、 时间过热蒸汽处理下卵类粘蛋白-葡萄糖(OVM+G)糖基化产物的红外光谱Fig.3(b) Infrared spectroscopy of OVM+G glycation products treated by superheated steam at different processing temperature and time |
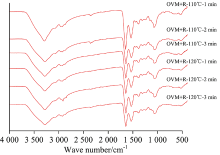 | 图3(c) 不同温度、 时间过热蒸汽处理下卵类粘蛋白-乳糖(OVM+L)糖基化产物的红外光谱Fig.3(c) Infrared spectroscopy of OVM+L glycation products treated by superheated steam at different processing temperature and time |
另外, OVM+G, OVM+L经过过热蒸汽处理后, 2 356 cm-1附近的峰逐渐减小并消失。
蛋白质通过氨基残基-羧基共价结合实现与糖的相互作用, 即为基于美拉德反应的糖基化修饰, 该修饰通过蛋白质上赖氨酸、 精氨酸的侧链氨基或者N末端氨基连接一个或两个还原糖分子而达到糖基化修饰的目的, 会使蛋白质分子量显著增大。 同时, 由于美拉德反应极易通过糖类之间的相互作用而使蛋白质形成共聚物, 如二聚体、 三聚体或聚合物等, 因此若分析过热蒸汽处理下蛋白质和不同还原糖之间反应的差异, 需进行分子量或聚合物的深入研究。
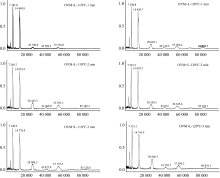
为了更准确地分析OVM在不同过热蒸汽处理条件下的分子量变化情况, 采用MALDI TOF MS技术研究其分子量和聚集状态变化, 结果如图4所示。 图4(a)为OVM+R在110和120 ℃过热蒸汽处理1, 2和3 min后产物的MALDI TOF MS图谱, 可以看出, 单聚体的分子量已经增加到29 149~29 446 Da之间, 基本处于29 kDa以上, 与天然分子量28 554 Da相比增加882 Da。 每个核糖修饰会使蛋白质的分子量增加144 Da, 该结果说明在单个OVM分子上存在6.1个糖基化修饰位点; 经过热蒸汽处理后的所有样品均出现了二聚体、 三聚体的质谱峰, 说明产生了较多的聚合物; 并且, 120 ℃处理与110 ℃相比, 样品聚合物的峰值更大, 尤其是三聚体的峰值相对更大, 可见温度越高越容易使OVM+R形成高聚物。
 | 图4(a) 不同温度、 时间过热蒸汽处理下卵类粘蛋白-核糖(OVM+R)糖基化产物的MALDI TOF MS图谱Fig.4(a) MALDI TOF MS of OVM+R glycation products treated by superheated steam at different processing temperature and time |
图4(b)为OVM+G在110和120 ℃过热蒸汽处理1, 2和3 min后产物的MALDI TOF MS图谱, 可以看出, OVM+G糖基化产物中单分子的质荷比主要以二价和三价形式存在, 分子量最大增加到29 565 Da, 与天然分子量28 554 Da相比增加1 056 Da, 每个葡萄糖修饰会使蛋白质的分子量增加162 Da, 说明在单个OVM分子上存在6个左右的糖基化修饰位点; 并且经过过热蒸汽处理的所有样品均出现了二聚体、 三聚体的质谱峰, 说明产生了较多的聚合物; 但是二聚体三聚体的质谱峰强度相差不大, 说明该条件下OVM和葡萄糖之间的共聚程度是有限的。
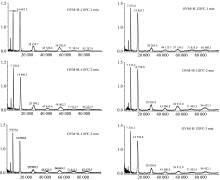 | 图4(b) 不同温度、 时间过热蒸汽处理下卵类粘蛋白-葡萄糖(OVM+G)糖基化产物的MALDI TOF MS图谱Fig.4(b) MALDI TOF MS of OVM+G glycation products treated by superheated steam at different processing temperature and time |
图4(c)为OVM+L在110和120 ℃过热蒸汽处理1, 2和3 min后产物的MALDI TOF MS图谱, 可以看出, OVM+L糖基化产物中单分子的质荷比也主要以二价和三价形式存在, 分子量最大增加到28 908 Da, 与天然分子量28 554 Da相比增加656 Da, 每个乳糖修饰会使蛋白质的分子量增加324 Da, 说明在单个OVM分子上存在约2个糖基化修饰位点; 有趣的是, 经过过热蒸汽处理的所有样品出现的聚合体形式比较少, 其中OVM+L在110 ℃条件下加热1 min时, 质谱图上仅仅出现一个小的二聚体质谱峰, 无三聚体质谱峰, 说明在该条件下不会生成较多的聚合体。 另外, 很多研究发现, 热处理可以诱导OVM的氧化或聚集, 增加分子量以及形成二聚体、 三聚体或聚合物, 通过该质谱峰也证明经过110 ℃的短时热处理基本不会导致蛋白质发生聚合, 也证实核糖和葡萄糖与OVM产生的聚合体是因为糖基化反应而促发的共价结合[20]。
采用不同温度(110和120 ℃)、 时间(1, 2和3 min)过热蒸汽对OVM-还原糖混合体系进行处理, 通过化学测定和光谱学分析研究过热蒸汽对OVM糖基化反应的影响。 结果表明: 过热蒸汽可以促进OVM的微量糖糖基化反应, 不同糖的糖基化反应活性顺序为核糖(五碳糖)>葡萄糖(六碳糖)>乳糖(二糖)。 OVM-还原糖混合体系在过热蒸汽处理后球蛋白结构发生展开, 造成内部发色氨基酸残基的暴露。 过热蒸汽处理过程中, 由于瞬间120 ℃高温将蛋白质中结合的水分子蒸发, OVM分子发生适当展开, 同时被还原糖补上水分蒸发的空位, 达到修饰蛋白质的目的。 OVM-还原糖的微糖混合体系在反应后产物生成二聚体、 三聚体和聚合物等, 核糖和葡萄糖与OVM产生的聚合体是由于糖基化反应而促发的共价结合。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|