作者简介: 刘浩东, 1998年生, 山东建筑大学理学院硕士研究生 e-mail: lhd060516@163.com
拉曼光谱具有分辨率高、 分析速度快、 检测样品制备简单、 无损以及可在线测量等优点, 被广泛用于分析物质的成分与分子结构信息, 可以对多种有机物和无机物进行定性和定量的分析。 目前主要应用多以相对比较成熟的定性分析为主, 用于定量分析时, 一方面由于拉曼光谱的重现性较差, 会受到很多内部因素干扰; 另一方面, 拉曼光谱的分析理论相比于传统技术还不够完善, 分析结果的误差较大, 限制了其在定量分析中的应用。 在基于强度比值的定量分析中, 拉曼强度归一化理论的出现为拉曼光谱的应用提供了理论依据, 参考峰/内标峰及拟合方法的选择对测量准确性和稳定性有较大的影响。 采用激光拉曼系统研究了不同浓度乙醇溶液拉曼光谱特征峰(C—C—O对称伸缩, 874 cm-1)与其他参考峰/内标峰的相对强度关系, 分别提出了基于乙醇本征峰位比值法和基于CCl4特征峰位的内标法, 建立了线性回归分析模型, 经归一化处理后两种方法均可有效消除系统中的突变噪声及强荧光背景的影响。 通过联合假设检验等统计学方法对比了不同组内与组间的数据差异, 确定了两种方法中准确性和稳定性最好的参考峰/内标峰。 F检验与t检验表明, 用乙醇自身峰位比值法进行标定时, 以1 446 cm-1(CH3-不对称变形)处特征峰为参考峰建立的标准曲线能更为准确地反演乙醇的浓度; 用CCl4作为内标物时, 以446 cm-1处拉曼特征峰为内标峰时的标准曲线具有更高的稳定性和准确度。 30 d内进行二次复测量时无需进行标准曲线的再次测量与绘制, 避免了重复的定量分析实验以及后期数据处理过程对时间的消耗。 根据不同标定方法建立的线性回归模型能够为乙醇溶液浓度的定量分析提供实验依据, 通过该模型在乙醇溶液浓度检测系统中的应用, 可以较为精确地实时反演乙醇浓度, 从而实现对具有强荧光背景干扰的高浓度范围的乙醇溶液准确、 快速、 实时的定量分析。
Raman spectroscopy has the advantages of high resolution, fast analysis, simple sample preparation, nondestructive, online measurement, etc. It is widely used to analyze the composition and molecular structure information of a wide range of organic and inorganic substances for qualitative and quantitative analytical measurement. At present, it is mainly used for quantitative analysis. When used for quantitative analysis, the poor reproducibility and the imperfect analysis theory of Raman spectroscopy are two main factors that limit its application. In the quantitative analysis based on intensity ratios, the emergence of Raman intensity normalization theory has provided a theoretical basis for its application. The choice of the reference peak/internal standard peak and the fitting method have a great influence on the measurement accuracy and stability. In this paper, the relative intensities of the characteristic peaks (C—C—O symmetrical stretching, 874 cm-1) of the Raman spectra of ethanol and other reference/internal standard peaks with different ethanol concentrations were investigated using a laser Raman system. A peak ratio method based on ethanol intrinsic peak and an internal standard method based on the characteristic peak position of CCl4 were developed, and both methods can effectively eliminate the effects of mutation noise and strong fluorescence background in the system through normalization. The reference peak/internal standard peak with the best accuracy and stability of the two methods was determined by statistical methods such as joint hypothesis testing for data differences within and between different groups. The F-test and t-test showed that the standard curve established with the characteristic peak at 1 446 cm-1 (CH3-asymmetric deformation) as the reference peak could more accurately invert the concentration of ethanol when the calibration was performed by the self-peak ratio method, while the standard curve with the Raman characteristic peak at 446 cm-1 as the internal standard peak had higher stability and accuracy when CCl4 was used as the internal standard. The retest within 30 days eliminates the need to measure and plot the standard curve again. The linear regression model established according to the two calibration methods can provide an experimental basis for the quantitative analysis of ethanol solution concentration. The ethanol concentration can be inverted more accurately in real-time, through the application of the model in the ethanol solution concentration detection system, to achieve accurate, rapid and real-time quantitative analysis of ethanol solutions in the high concentration range with strong fluorescence background interference.
拉曼光谱由于能够提供实时的、 无损的样品指纹光谱, 且具有不受水的干扰、 样品制备简单等特点, 可以对多种有机物和无机物进行定性[1, 2]和定量[3, 4]的分析测量, 现已被广泛应用于工业生产以及科学研究中[5, 6]。 通常情况下, 拉曼信号的强弱与被测物质的浓度呈正向线性关系, 然而在实际检测场合中, 会受到背景电流噪声、 检测设备自身稳定性以及激发光与待检测样品相互作用位置等多种制约因素的影响, 导致拉曼光谱的重现性差[7]。 此外, 当改变激光器功率或者拉曼光谱仪积分时间等仪器参数以及检测样品所用到的容器时, 绘制的拟合标准曲线往往不具有通用性, 需要重新绘制, 这将增加更多的工作时间。
Wopenka与Pasteris等[8]提出的拉曼强度归一化理论, 为拉曼光谱法在基于强度比值的定量分析领域中的应用提供了理论依据, 使拉曼光谱分析的发展方向逐渐向定量化领域扩展。
拉曼散射的强度I与多种影响因素有关, 数学表达可以简化为
式(1)中: σ 为拉曼散射截面积; I0为入射光强度; N为被探测体积内的分子数; K为相关比例常数, K值与实验仪器以及拉曼散射的效率相关联。 通常情况下, 拉曼散射的强度随检测物质的浓度一般呈线性关系, 但拉曼散射强度还受到实验过程中其他测试条件的影响(例如激发光强度、 设备的相关光学配置和结构以及校准样品等), 因此不能与检测目标的浓度直接联系起来, 必须排除实验过程中测试条件对结果的影响, 基于相对强度的拉曼光谱归一化方法是消除该影响最有效的方法。 数学表达式为
式(2)中: 下标R表示实验过程中作为对照所建立的参考系, 在实际测量过程中需保证参考系内的拉曼光谱测量条件与被测样品完全相同。 被探测体积内的分子数可以用于拉曼定量分析, 数学定义为
式(3)中: σ R/σ 可以看作是一个常数, 作为对照的参考系在与被测样品处于完全相同的基准下, 相对拉曼强度I/IR就可直接与浓度相关联, 从而作为被测样品浓度定量分析的参照。
目前, 拉曼光谱的定量分析方法主要以相对强度为基准, 包括内标法[9, 10]和外标法[11]。 外标法要求样品和相应标定物的拉曼光谱需连续采集, 以便通过外标物对拉曼信号进行校正, 但采集过程的不同步性使得采集条件不可避免地会有差异。 而内标法所用的标定物存在于样品中, 样品和内标物的拉曼信号在同一条件下同时采集, 比外标法更适合于拉曼强度的校正。 因此, 内标法常用于减少光谱重现性对拉曼测量分析结果的影响, 已有相关报道采用该方法对溶液中待测物浓度进行定量分析[12, 13]。
采用激光拉曼系统研究了不同浓度的乙醇溶液拉曼光谱的特征峰(C— C— O对称伸缩, 874 cm-1)与其他参考峰/内标峰的相对强度关系, 分别提出基于乙醇本征峰位比值法和基于CCl4特征峰位的内标法, 从实验上验证了在高浓度乙醇溶液中分别采用以上两种方法对乙醇溶液进行定量分析的问题, 并建立了线性回归分析模型, 为高浓度范围的乙醇溶液较为精准的定量分析提供了有效方法。
选用RLE-RI02拉曼光谱检测系统(北京杏林睿光科技有限公司), 该检测系统由光谱仪(波段350~1 050 nm, 分辨率~1 nm, 积分时间0~10 s可调)、 电荷耦合元件CCD(采用2 048 Pixels, 在垂直方向的感光面上像素尺寸为14 μ m× 200 μ m)、 激光器[采用波长(785± 0.5) nm的半导体激光器, 线宽< 0.1 nm, 功率支持0~500 mW线性可调节]、 拉曼探头(瑞利散射截止深度OD6, 焦距为8 mm)、 样品检测池、 光纤等组成。
无水乙醇(AR, ≥ 99.7%)、 四氯化碳(AR, ≥ 99.5%)、 去离子水。 实验测试的溶液均由试剂与去离子水配置。
实验一: 乙醇峰位比值法拟合曲线的绘制, 配置乙醇水溶液, 溶液浓度以体积分数表示, 用去离子水将无水乙醇稀释至浓度分别为88%~99.7%(无水乙醇浓度取99.7%)的标准溶液, 浓度间隔为2%。 取各浓度样品溶液2 mL于比色皿中, 分别放入待检测样品池进行测定, 采集样品拉曼光谱并记录其光谱数据。 为降低仪器响应时间对光谱数据的影响, 测量时选择单步测量, 并在测量前扣除暗背景及背景噪声。 激光功率为500mW, 拉曼光谱仪扫描光谱波数范围125~3 350 cm-1, 拉曼信号相对强度范围以最高峰值为参考, 实验中取0~1 300, 积分时间2 s, 积分次数1次。 重复测量三次并取平均值。
实验二: 四氯化碳内标法拟合曲线的绘制, 配置乙醇水溶液, 溶液浓度以体积分数表示, 用去离子水将无水乙醇稀释至浓度分别为88%~99.7%(无水乙醇浓度取99.7%)的标准溶液, 浓度间隔为2%。 取各浓度样品溶液2 mL于比色皿中, 各样品溶液中分别加入0.3 mL四氯化碳, 此时溶液中乙醇体积分数发生改变, 充分混合后, 样品混合液中乙醇的浓度(体积分数)变为76.5%~86.7%, 将混合后的待测样品分别放入样品检测池进行测定, 采集样品拉曼光谱并记录其光谱数据。 为降低仪器响应时间对光谱数据的影响, 测量时选择单步测量, 并在测量前扣除暗背景及背景噪声。 激光功率为500 mW, 拉曼光谱仪扫描光谱波数范围125~3 350 cm-1, 拉曼信号相对强度范围以最高峰值为参考, 在该实验中取0~1 550, 积分时间2 s, 积分次数1次。 重复测量三次并取平均值。
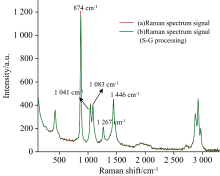
对无水乙醇溶液进行测试, 得到的拉曼光谱信号如图1中曲线(a)所示, 用Savitzky-Golay(S-G)滤波拟合法对曲线(a)进行2阶多项式平滑处理, 处理后的光谱图如图1中曲线(b)所示。 无水乙醇有多个拉曼特征峰, 由图1可以看出, 在874 cm-1附近有较高的绝对峰强, 由C— C— O的对称伸缩引起的, 其余峰位振动模式见表1。 选定874 cm-1处的拉曼信号作为乙醇定量分析的定量峰; 初步选择1 041、 1 083、 1 267和1 446 cm-1四个峰作为峰位比值法归一化的参考峰。
| 表1 乙醇分子振动模式及拉曼峰位移 Table 1 Vibrational modes and Raman peak shifts of ethanol molecules |
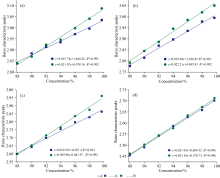
分别以四个参考峰作为基准, 对不同浓度的乙醇溶液进行测定。 将乙醇874 cm-1处拉曼特征峰强度与其他特征峰强度进行对比, 得到两个峰位的相对强度, 并对其进行归一化, 为直观显示拟合曲线, 对1 267 cm-1峰位数据作等比例缩小50%处理。 将归一化后的峰强作为纵坐标、 乙醇溶液的浓度为横坐标, 对以上所述不同浓度的数据进行线性拟合。 以上选取的四组参考峰所对应的拟合标准曲线如图2所示, 拉曼信号的相对强度与乙醇的浓度之间存在较为良好的线性关系, 标准曲线的拟合系数R2分别为0.991、 0.992、 0.991、 0.996, 说明四个拉曼特征峰均有望作为体系中乙醇定量检测的参考峰。
 | 图2 不同参考峰相对强度与乙醇浓度线性拟合曲线Fig.2 Linear fitting curves of relative intensities of different reference peaks with ethanol concentration |
分别以四个参考峰作为基准, 对比拟合标准曲线的斜率及方差等参数随时间的变化率, 即对其时间稳定性进行检验(t检验)。 t检验中, 30 d之后实验参数以及实验中主要参考的物理量均与第一次实验相同。 无水乙醇为易挥发溶液, 在实验中采用避光环境, 且第一次实验与30 d之后的实验环境温度保持一致, 同时对无水乙醇做严格密封处理, 经归一化处理后, 外界因素对实验结果的影响已降到可控条件下的最低水平。 距第一次实验测量30 d时, 再次重复进行实验, 分别采集对应不同浓度的乙醇溶液的拉曼光谱, 并采用上述1 041 cm-1等四个参考峰的测量结果重新绘制对应峰位的拟合标准曲线。 两条曲线的对比关系如图3所示。 对不同参考峰的各组数据做联合假设检验(F检验), 显著性水平(α )取0.05, F检验表明, 在α =0.05水平下, 图3(b)和(d)中两条拟合曲线的总体方差与检验方差并没有存在较为明显的差异。 t检验表明, 在α =0.05水平下, 图3(a)、 (b)、 (c)中两条拟合曲线的斜率均具有较为明显的差异。 即相隔30 d之后, 参考峰以 1 041、 1 083和1 267 cm-1处的拉曼信号为基准的拟合标准曲线斜率或方差比率发生了变化, 而参考峰以1 446 cm-1处拉曼信号为基准的拟合标准曲线基本没有显著性变化。 说明在实际应用中, 参考峰以1 446 cm-1处乙醇的拉曼特征峰为基准时具有相比其他本征峰位参考峰更好的时间稳定性, 在30 d内进行二次复测试也无需进行标准曲线的再次测量与绘制, 避免了重复定量分析实验与后期数据处理过程对时间的消耗。 因此, 在对乙醇溶液采用本征峰位比值法进行定量分析时, 可以选择1 446 cm-1处的拉曼信号作为参考峰。
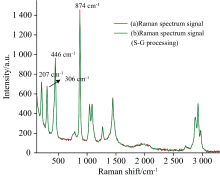
在无水乙醇中加入四氯化碳得到混合溶液, 对混合溶液进行测试, 得到的拉曼光谱信号如图4中曲线(a)所示, 用S-G滤波拟合法对曲线(a)进行2阶多项式平滑处理, 处理后的光谱图如图4中曲线(b)所示。 四氯化碳有多个拉曼特征峰, 由图4可以看出, 在446 cm-1处有较高的绝对峰强, 这是由A1非简并态振动引起的, 其余峰位振动模式见表2。 选定874 cm-1处的拉曼信号作为乙醇定量分析的定量峰; 进行内标峰的选择时需要满足以下特定条件: 内标峰和定量峰(874 cm-1)不能峰位距离太远, 谱峰主要区域不能大范围重叠, 各谱峰的最大峰强之间也不能差距过大, 以及谱峰不能失真、 形状要尖锐等。 CCl4特征峰位与乙醇特征峰位不重合, 且CCl4不影响乙醇主要谱峰的位置及强度, 故可以利用其拉曼特征峰作为乙醇定量分析内标峰。 因此初步选择四氯化碳特征峰位207、 306、 446 cm-1三个峰作为内标峰。
| 表2 四氯化碳分子振动模式及拉曼峰位移 Table 2 Vibration modes and Raman peak shifts of carbon tetrachloride molecules |
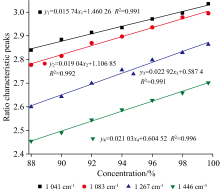
分别以三个内标峰作为参考, 对不同浓度的乙醇与0.3 mL四氯化碳混合溶液进行测定。 将乙醇874 cm-1处拉曼特征峰强度与其他特征峰强度进行对比, 得到两个峰的相对强度, 并对其进行归一化, 为直观显示拟合曲线, 对446 cm-1峰位数据作等比例放大20%处理。 将归一化后的峰强作为纵坐标、 混合溶液中乙醇的浓度作为横坐标, 对上述不同浓度的数据进行线性拟合。 以上选取的三组内标峰所对应的拟合标准曲线如图5所示, 拉曼信号的相对强度与混合溶液中乙醇的浓度之间存在较为良好的线性关系, 标准曲线的拟合系数R2分别为0.998、 0.998、 0.999, 与实验一中乙醇峰位比值法归一化相比线性度略有上升, 分析认为在对乙醇进行摄谱的过程中, 不同浓度的样品所对应的散射指数也不相同, 另外溶液中背景噪声、 仪器及光源功率稳定性以及样品自吸收等因素都会对拉曼光谱带来影响, 这一部分因素的影响可以通过在待测样品中加入适当的内标物来消除或抵消[14]。
 | 图5 不同内标峰相对强度与乙醇浓度线性拟合曲线Fig.5 Linear fitting curves of relative intensities of different internal standard peaks with ethanol concentration |
分别以三个内标峰作为参考, 对比拟合标准曲线的斜率及方差等参数随时间的变化率, 对其进行t检验。 CCl4同样为易挥发溶液, 在实验中采用避光环境, 保持两次实验环境温度一致, 同时对CCl4做严格密封处理, 最大限度降低外界因素对实验结果的影响。 距第一次实验测量30 d时, 再次重复进行实验, 分别采集对应不同浓度的乙醇溶液与CCl4混合溶液的拉曼光谱, 并采用上述207 cm-1等三个内标峰的测量结果重新绘制对应峰位的拟合标准曲线。 两条曲线的对比关系如图6所示。 对不同内标峰的各组数据做F检验, 显著性水平(α )取0.05, F检验表明, 在α =0.05水平下, 图6(a)和(b)中两条拟合曲线的总体方差与检验方差均存在较为明显的差异。 t检验表明, 在α =0.05水平下, 图6(a)、 (b)中两条拟合曲线的斜率均具有较为明显的差异。 即相隔30 d之后, 内标峰以207和306 cm-1处的拉曼信号为基准的拟合标准曲线斜率或方差比率发生了变化, 而内标峰以446 cm-1处拉曼信号为基准的拟合标准曲线基本没有显著性变化[如图6(c)所示], 从分子的振动模式考虑, 主要是因为该模式下4个Cl原子沿各自与C原子的连线在同轴方向同时做向内或向外的运动, 振动强度和稳定性更好。 说明在实际应用中, 内标峰以446 cm-1处CCl4的拉曼特征峰为基准时具有相比其他内标峰更好的时间稳定性, 且相比实验一峰位比值法1 446 cm-1处特征峰具有更高的拟合精确度与稳定性, 在30 d内进行二次复测时也无需进行标准曲线的再次测量与绘制, 避免了重复定量分析实验与后期数据处理过程对时间的消耗。 在对乙醇溶液采用基于CCl4内标法特征峰位进行定量分析时, 可以选择446 cm-1处的拉曼信号作为内标峰。
采用激光拉曼光谱系统, 分别使用乙醇峰位比值法和CCl4内标法对乙醇拉曼光谱特征峰(C— C— O对称伸缩, 874 cm-1)进行标定, 测定了不同浓度的乙醇溶液拉曼光谱, 采用乙醇本征峰位和CCl4特征峰得到定量峰与多个参考峰及内标峰的相对强度比值变化关系。 通过归一化方法进行数据处理, 分别建立了线性回归方程。 F检验与t检验表明, 使用乙醇峰位比值法进行标定时, 参考峰以1 446 cm-1(CH3-不对称变形)处拉曼信号为基准的拟合标准曲线具有相比其他本征峰位参考峰更好的时间稳定性, 同时在30 d内进行二次复测时也无需进行标准曲线的再次测量与绘制; 使用CCl4内标法进行标定时, 内标峰以CCl4拉曼特征峰(A1非简并态, 446 cm-1)为基准时的拟合标准曲线具有相比其他内标峰更好的时间稳定性及更高的准确度。 除了可对乙醇溶液进行定量测试外, 采用该系统和数据处理方法也可对其他类型的溶液(如乙酸、 甲醇、 葡萄糖发酵液等)进行高精度的简单快速实时检测, 具有一定的应用价值和意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|