作者简介: 齐国敏, 1965年生, 福州大学化学学院高级工程师 e-mail: 961043190@qq.com
微囊藻毒素-LR(MC-LR)具有强烈的肝毒性、 致癌性和发育毒性, 亟需严格监测。 为实现环境水体中微痕量MC-LR的快速特异灵敏的分析识别, 以金属有机框架化合物(MOF)为介导, 增强磁纳米粒子比表面积, 高效负载纳米金和适配体-cDNA分子杂交荧光探针, 研发新型的适配体功能化磁纳米荧光探针(Fe3O4@MIL-101-NH2@Au@aptamer), 实现了对MC-LR的适配体特异识别-激光诱导荧光(LIF)超高灵敏分析。 论文详细研究了适配体磁纳米探针荧光检测MC-LR的可行性、 MC-LR测定的优化条件及其方法性能。 结果表明: MOF修饰的磁纳米颗粒Fe3O4@MIL-101-NH2的Brunauer-Emmett-Teller(BET)比表面积达到114.02 m2·g-1, 比单一Fe3O4提高了近5倍, 适配体-cDNA杂交荧光探针在磁纳米颗粒表面的修饰率达98%以上, 适配体磁纳米探针对水体中痕量MC-LR具有很强的荧光响应。 在最优条件下(pH 7.5、 NaCl浓度500 mmol·L-1、 纳米金尺寸为20 nm, 测定时间为30 min), 适配体磁纳米探针与MC-LR结合释放出荧光互补链, 体系荧光强度与MC-LR含量成正比, 线性浓度范围为0.020~3.000 μg·L-1, 检出限(LOD)为0.006 μg·L-1, 灵敏度比文献报道的荧光分析法提高了1.6~22.3倍。 所建立的适配体磁纳米探针-LIF法对MC-LR的识别特异性高, 在100倍量的干扰物(微囊藻毒素MC-RR、 MC-YR、 大田软海绵酸OA) 共存情况下, 适配体磁纳米探针在混合体系中的荧光响应与在MC-LR单样中的响应强度偏差小于3.3%, 交叉反应性小; 日内、 日间和批间的测定标准偏差(RSD)为1.7%~8.8%, 相对误差RE为-4.3%~4.1%, 方法稳定性和重现性好。 该方法应用于闽江、 西湖水和内河水等样品分析, 水中MC-LR得到了良好的识别检出, 不同加标浓度的MC-LR(0.050, 0.100和1.000 μg·L-1)测定回收率为(90.1%±6.4%)~(104.2%±7.0%) ( n=3), 与LC-MS确证方法的测定结果[加标回收率(91.3%±7.0%)~(104.4%±2.0%), n=3]一致。 所建立的适配体磁纳米探针与LIF联用技术对水中痕量MC-LR具有高的特异识别和灵敏检出能力, 为环境水中痕量MC-LR的现场特异识别分析提供了一个新的技术。
MC-LR possessing strong hepatotoxicity, potential carcinogenicity, and biological toxicity could have an intensive influence on human health and the aquatic ecological environment and need to be monitored critically. For the specific and highly sensitive analysis performance, agold-magnetic composite nanoparticlemodified by aptamer-cDNAfluorescent hybridization probe (Fe3O4@MIL-101-NH2@Au@aptamer) was prepared and applied for sensing detection of MC-LR in water with laser-induced fluorescence (LIF). This work studied the feasibility, optimization of analysis conditions, specificity, stability of the method, and sample analysis application. As a result, a high Brunauer-Emmett-Teller (BET)specific surface area of 114.02 m2·g-1 was achieved in Fe3O4@MIL-101-NH2@AuNPs, which resulted in a high modification rate of up to 98.8% achieved for aptamer-cDNA fluorescenthybridization probe. With the excitation wavelength of 497 nm, the aptamer-cDNA fluorescent probe has a strong fluorescence response with the emission wavelength of 512 nm to the trace MC-LR. Under the optimal conditions (pH 7.5, NaCl concentration 500 mmol·L-1, nanogold size 20 nm, analytical time 30 min), a good linear relationship between MC-LR concentration and fluorescence intensity was achieved in a wide linear range (0.020~3.000 μg·L-1) with the limit of detection (LOD) as low as 0.006 μg·L-1, which was 1.6~22.3 folds better than that of the most fluorescence methods reported previously. The relative standard deviation (RSD) of intra-day, intra-day, and inter-batch was gained in 1.7%~8.8%, and the relative error (RE) of -4.3%~4.1%. High specific selectivity and low cross-reactivity for MC-LR (1.0 μg·L-1) were also achieved using theas-prepared fluorescent probe, even if the concentration of interfering toxins (MC-RR, MC-YR, OA) was 100 folds higher than that of MC-LR. The fluorescence responses of MC-LR in these mixtures werewell consistent with that of MC-LR in the standard solution. Applied to the analysis of samples from the Minjiang River, Lake Water, and the inland river, the identification of MC-LR in water samples was satisfactory. The recovery yields of MC-LR for three concentrations (0.050, 0.100 and 1.000 μg·L-1) rangedin (90.1%±6.4%)~(104.2%±7.0%) ( n=3). The results were consistent with those obtained by the LC-MS method [(91.3%±7.0%)~(104.4%±2.0%), n=3]. It might light a new technique for the specific and rapid monitoring technology for tracing MC-LR in the environmental water.
微囊藻毒素-LR(MC-LR)具有强烈的肝毒性、 致癌性和发育毒性[1, 2], 亟需严格监测。 水中MC-LR含量低, 且共存物质复杂, 通常采用色谱-质谱技术进行分离检测[3, 4, 5], 仪器结构复杂、 使用条件严格, 难以实现现场快速检测。 荧光光谱分析快速、 仪器简便, 研发高效的荧光分析技术, 对实现MC-LR现场准确识别具有重要意义。
目前, 基于抗原和抗体之间高特异性识别, 酶联免疫、 免疫传感荧光分析MC-LR得到了研究[6, 7]。 然而, 动物抗体普遍严重依赖小鼠等动物, 小分子抗体制备难度大、 周期长, 且环境耐受性较弱, 限制了其推广应用。 适配体(Aptamer)作为可替代生物抗体的一种新兴生物材料, 亲和力高、 条件耐受性好[8, 9, 10], 在环境污染物监测中得到了广泛的重视。 Wu等在纳米金上修饰适配体-cDNA杂交荧光探针, 基于适体结合MC-LR并释放荧光标记cDNA, 结合高速离心(10 000 r· min-1, 1 h)分离, 实现了MC-LR的荧光分析[11]。 杨新杰等基于DNA上银纳米簇原位生成, 制备了环状DNA-银纳米簇, 构建了一种无酶免标记检测MC-LR的荧光分析方法[12]。 为了简化操作, Tang等引入了磁纳米颗粒分离技术, 在磁纳米粒子表面包覆多巴胺/铜纳米簇(PDA/CuNPs), 提出了一种简便的适配体磁纳米传感技术, 实现了MC-LR的光谱检测[13]。 然而, 磁纳米粒子比表面积较小、 结合位点普遍较少, 对适配体负载容量有限, 导致对于痕量MC-LR作用后释放出的荧光探针浓度极低, 识别灵敏度受到了限制(μ g· L-1或亚μ g· L-1水平)。 为此, 创新开发高负载能力的适配体磁纳米传感界面, 发展高灵敏的MC-LR分析技术备受关注。
近来, 金属有机框架(MOF)纳米材料因其表面积高、 结构可调的性质得到了重视[14], 引入MOF修饰磁纳米粒子, 成为了探针负载和表面修饰的理想选择[15, 16, 17]。 激光诱导荧光(LIF)基于高能激光束瞬间激发分子产生荧光, 光谱信号强度比常规荧光高出2~4个数量级, 灵敏度极高。 迄今, 综合利用MOF功能化磁纳米粒子、 适配体和LIF三者优势, 开发基于MOF介导高效负载适配体的磁纳米探针及其LIF高灵敏检测MC-LR仍未见报道。 本工作通过金属有机框架MIL-101-NH2修饰Fe3O4磁珠, 大幅提升磁粒子比表面积, 高效负载纳米金和适配体-cDNA杂交探针, 形成Fe3O4@MIL-101-NH2@Au@aptamer磁纳米荧光探针, 联用LIF检测技术, 建立痕量MC-LR的超高灵敏分析体系。 实验详细考察了适配体磁纳米荧光探针与MC-LR分析可行性、 荧光分析条件、 特异性和稳定性, 开展了对环境水中MC-LR的分析检测, 为环境水体中痕量MC-LR快速、 特异、 高灵敏的荧光分析提供新的技术。
参照文献[2]进行适配体及其互补链杂交孵育, 适配体序列为5’ -ATACCACCTCATTATG CCCCATCTCCGC-3’ , 荧光互补链cDNA序列为5’ -FAM-ATGAGGTGTTTT-3, 将适配体及其荧光互补链等摩尔量混合, 并按比例V核酸适配体∶ V互补链∶ V缓冲液=1∶ 1∶ 8加入磷酸盐缓冲溶液(PBS, 10 mmol· L-1 磷酸盐, pH=7.5, 500 mmol· L-1 NaCl), 在55 ℃孵育2 h, 制得荧光探针。
称取100 mg羧基化Fe3O4分散于25 mL超纯水中, 超声0.5 h混匀; 加入0.8 g Cr(NO3)3· 9H2O, 搅拌5 min, 取2-氨基对苯二甲酸溶于NaOH溶液(4 mmol· L-1)中, 2-氨基对苯二甲酸浓度为2 mmol· L-1; 将该溶液缓慢滴入Fe3O4溶液中, 置于100 mL反应釜中150 ℃加热反应12 h, 得到绿色的Fe3O4@MIL-101-NH2, 所得产物甲醇浸泡72 h, 用水和乙醇交替清洗3次并在无水乙醇中保存。
称取Fe3O4@MIL-101-NH2粉末0.17 mg分散于1mL水中; 取100 μ L溶液通过磁分离, 去除上清液, 加入过量的AuNPs溶液反应过夜, 得到Fe3O4@MIL-101-NH2@Au; 去除上清液, 取30 μ L适配体-cDNA分子杂交荧光探针 (10 μ mol· L-1)加入其中, 震荡15 min, 基于金-硫键的作用得到Fe3O4@MIL-101-NH2@Au@aptamer探针; 在此基础上, 取100 μ L 2 mol· L-1的巯基己醇溶液加入上述探针反应体系, 振荡1 h, 进行磁纳米颗粒的巯基己醇封闭, 制备Fe3O4@MIL-101-NH2@Au@aptamer磁纳米荧光探针。
采集闽江、 西湖和内河水样, 用0.45 μ m尼龙水系膜过滤, 加入缓冲液调节溶液, 最终组成为10 mmol· L-1 PBS, pH 7.5, 500 mmol· L-1 NaCl。 称取0.17 mg适配体磁纳米探针加入0.5 mL离心管中, 加入40 μ L待测样品, 在室温下振荡15 min, 磁分离后取上清液, 在激发波长497 nm、 发射波长512 nm条件下, 室温下采用LIF进行分析检测。
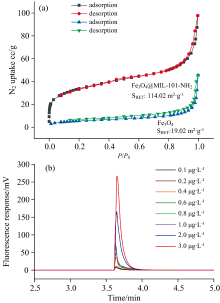
基于MOF-101-NH2对Fe3O4磁性纳米颗粒进行修饰, 提升Fe3O4的BET比表面积, 提高AuNPs的负载和适配体的修饰。 如图1(a)所示, 测得Fe3O4和修饰MIL-101-NH2后Fe3O4@MIL-101-NH2的比表面积BET分别为19.86和114.02 m2· g-1, 在Fe3O4表面修饰MIL-101-NH2, 磁纳米颗粒实现了比表面积的大幅提升, Fe3O4@MOF拥有更多的活性位点和吸附容量。
在此基础上, 通过键合纳米金和巯基核酸适配体, 所制备的适配体磁纳米探针对于不同浓度 (0.020~3.000 μ g· L-1) 的MC-LR具有特异识别和灵敏的荧光响应。 随着反应溶液中MC-LR浓度的增加, 适配体磁纳米探针与目标物的结合而释放的荧光互补链逐渐增加, 体系荧光强度响应增加[如图1(b)所示], 采用适配体磁纳米探针-LIF分析检测MC-LR具有可行性。
2.2.1 磁纳米颗粒用量的影响
实验将Fe3O4@MIL-101-NH2@Au磁纳米颗粒(简称磁珠)加入适配体分子杂交荧光探针溶液(40 μ L, 10 μ mol· L-1)中, 通过Au-S键固定分子杂交荧光探针后分离制得适配体磁纳米探针, 用于MC-LR测定。 如图2, 随着磁珠用量的增加, 磁珠结合的适配体分子杂交荧光探针增多, 形成Fe3O4@MIL-101-NH2@Au@aptamer探针的量增多, 与MC-LR目标物反应后体系荧光响应值增强; 当磁珠用量为0.17 mg时, 适配体分子杂交荧光探针在磁珠表面的修饰量和荧光响应值达到最大; 继续增大磁珠用量, 磁珠过量, 导致磁珠表面所修饰的探针表面密度下降, 荧光响应值降低。
2.2.2 纳米金尺寸的影响
如图3, 随着纳米金粒径的增加(17~21 nm), 适配体-cDNA分子杂交荧光探针在Fe3O4@MIL-101-NH2@Au磁纳米颗粒上的修饰率逐渐增大并达到最高98%; 当纳米金粒径进一步增大时, 纳米金比表面积降低, 适配体分子杂交荧光探针修饰率逐渐下降。 当纳米金粒径为21 nm时, 所制备的Fe3O4@MIL-101-NH2@Au@aptamer对MC-LR具有最优的荧光响应。
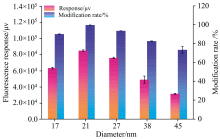 | 图3 纳米金尺寸对于核酸适配体修饰率和荧光信号的影响Fig.3 Effect of the size of gold nanoparticle on modification rate of aptamer and fluorescence response |
2.2.3 修饰时间和识别反应时间的影响
图4表明, 当适配体分子杂交探针在Fe3O4@MIL-101-NH2@Au上修饰反应的时间为5 min时, 适配体分子杂交探针修饰率为86.0%; 随着巯基适配体分子杂交探针与Fe3O4@MIL-101-NH2@Au作用时间增加到15 min及以上时, 适配体分子杂交探针修饰率增加到98.8%以上, 探针结合效率高。
 | 图4 吸附时间对适配体修饰率和反应时间对荧光响应的影响Fig.4 Effects of adsorption time on modification rate of aptamer and reaction time on fluorescence response |
同时, 探究了适配体磁纳米探针与MC-LR反应的时间。 当适配体分子杂交探针与MC-LR结合后双链杂交结构解开, 荧光互补链被释放出来而增强上清液荧光强度。 如图4, 随着孵育反应时间的延长, 适配体磁纳米探针与MC-LR识别反应后的荧光强度逐渐增加, 在15 min时荧光响应达到最高; 随着识别反应的时间延长, 体系中部分游离的荧光互补链之间产生非特异性结合或聚集, 荧光强度降低。 实验中适配体磁纳米探针与MC-LR识别反应的时间为15 min。
2.2.4 pH和NaCl浓度的影响
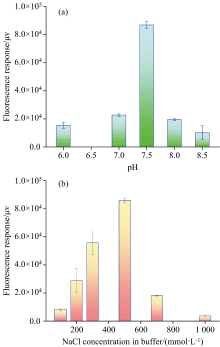
在不同pH条件下, 适配体纷子杂交探针对于MC-LR的荧光响应不同。 如图5(a), 当缓冲液pH在6.0~7.5时, 荧光响应逐渐升高; 当pH继续升高时, 荧光响应反而降低, 这主要是在pH 7.5~8.5时, 适配体与MC-LR亲和作用强, 荧光互补链易于释放, 荧光响应增加; 在pH 7.5~8.5时, 适配体亲和识别能力减弱, 与MC-LR反应后荧光响应降低。 图5(b)考察了盐浓度对适配体亲和识别作用的影响, 当NaCl浓度从100 mmol· L-1增加至500 mmol· L-1时, 反应体系的荧光响应值逐渐增加, 主要由于高离子浓度的条件下, 溶液中正电荷离子与适配体磷酸基团的负电荷中和, 降低了适配体上磷酸骨架的负电荷静电斥力, 有利于适配体的结构稳定和亲和识别; 当NaCl浓度为600~1 000 mmol· L-1, 溶液盐度高, 不利于适配体结构稳定, 高强度盐度会抑制适配体的反应活性, 体系荧光响应大幅度下降。 实验选择了pH 为7.5、 NaCl浓度为500 mmol· L-1条件进行研究。
2.3.1 特异性
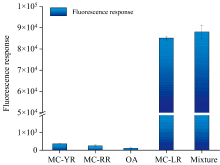
实验在其他干扰毒素(MC-RR、 MC-YR、 OA)存在下对MC-LR进行特异性识别分析。 如图6, 反应体系对MC-LR具有良好的荧光响应, 对于其他毒素荧光响应低; 在干扰物共存情况下, 当100倍量的干扰毒素(MC-RR、 MC-YR、 OA, 浓度100 μ g· L-1), MC-LR(1.0 μ g· L-1)对应产生的荧光强度比其他毒素高20~100倍; 且混合样品中(目标物和干扰物按1∶ 100比例混合), MC-LR的荧光响应与MC-LR标准溶液的响应基本一致, 表明适配体磁纳米荧光探针对于MC-LR识别特异性高, 方法具有良好的选择性。
2.3.2 稳定性和重现性
为了考察适配体磁纳米探针荧光分析的重现性, 分析了日内、 日间和批间测定相对标准偏差(RSD)。 如表1所示, 对于不同浓度的MC-LR样品, 所建立方法的日内RSD为1.7%~5.3%(n=3), 相对误差(RE)为-2.0%~0.3%, 日间RSD为3.9%~8.8%(n=3), RE为-3.0%~4.1%, 批间SSD为4.9%~8.7%(n=3), RE为-4.3%~0.4%, MC-LR分析具有较好的稳定性和重现性。
| 表1 Fe3O4@MIL-101-NH2@Au-aptamer对MC-LR分析的稳定性和重现性 Table 1 Stability and reproducibility for MC-LR detection using Fe3O4@MIL-101-NH2@Au-aptamer |
在最佳条件下, MC-LR浓度与适配体磁纳米探针荧光强度之间有良好的线性关系, 线性范围为0.020~3.000 μ g· L-1, 线性回归方程为y=90 458x-2 713.9, 决定系数R2=0.996, 最低检测限LOD(3σ /k)为0.006 μ g· L-1。 同时, 考察了不同水样的基质效应。 如表2, 对于加标浓度分别为0.050、 0.100和1.000 μ g· L-1时, 不同水样中的基质效应(n=3)分别为(96.1%± 4.0%)~(98.2%± 0.5%)、 (95.3%± 5.0%)~(98.6%± 2.9%)、 (94.3%± 2.3%)~(99.1%± 3.5%), 所构建的Fe3O4@MIL-101-NH2@Au-aptamer荧光传感基质效应良好, 水体基质没有对测定产生显著的影响。
| 表2 实际水样中MC-LR测定的基质效应 Table 2 Matrix effect of MC-LR in water samples |
应用于样品分析, 对三种水样(福州闽江、 西湖水和内河水样)进行测定。 如表3, 本方法对空白以及加标样品都有良好的检出。 综合考虑基质效应, 湖水、 河水和闽江水样中MC-LR的回收率计算值为(93.9%± 2.9%)~(104.2%± 7.0%), (90.1%± 6.4%)~(98.1%± 4.1%)和(96.2%± 0.5%)~(102.4%± 2.9%), RSD为1.4%~5.6%, 该方法具有良好的准确性和精密度; 与LC-MS确证方法分析结果比较, 两者检测结果一致, 基于Fe3O4@MIL-101-NH2@Au-aptamer的激光诱导荧光检测对MC-LR分析结果良好。 与文献报道的适配体荧光测定MC-LR的方法比较(LOD为0.010~0.137 μ g· L-1)[18, 19, 20, 21], 本工作所建立的方法分析全程时间较快(30 min)、 检出限更低, 灵敏度高1.6~22.3倍(表4)。
| 表3 不同水样中MC-LR的适配体磁纳米荧光探针-LIF检测分析 Table 3 Analysis of MC-LR in water by Fe3O4@MIL-101-NH2@Au-aptemer fluorescence probe |
| 表4 MC-LR特异识别的适配体荧光分析方法性能比较 Table 4 Performance comparison of MC-LR analysis based on fluorescent aptasensor |
针对磁性颗粒比表面积不高, 纳米金在磁纳米粒子上修饰密度不高而导致适配体修饰密度低等问题, 本文构建了MOF功能化磁性纳米颗粒Fe3O4@MIL-101-NH2, 负载AuNPs并吸附适配体荧光探针, 制备了适配体荧光探针高度负载修饰Fe3O4@MIL-101-NH2@Au@aptamer新型纳米探针, 实现了对MC-LR的激光诱导荧光超灵敏分析。 研究表明, 适配体在磁珠上修饰率高达98.8%, 对MC-LR具有高特异选择性和良好的重现性。 所建立的Fe3O4@MIL-101-NH2@Au-aptamer荧光传感探针在30 min内可完成对水体中痕量MC-LR的分析, 检出限为0.006 μ g· L-1, 优于大部分文献中所报道的荧光分析法检出限; 应用于环境水样中MC-LR的检测, MC-LR回收率为(90.1%± 6.4%)~(104.2%± 7.0%) (n=3), 与LC-MS的回收率(91.3%± 7.0%)~(104.4%± 2.0%)(n=3)结果一致, 实现了水中痕量MC-LR的准确识别和超灵敏检出, 为环境水体中MC-LR藻毒素快速灵敏监测提供了新的技术。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|