作者简介: 白雪冰, 1991年生, 西北农林科技大学葡萄酒学院讲师 e-mail: bxb@nwafu.edu.cn
研究旨在明确“赤霞珠( Cabernet Sauvignon, Vitis Vinifera L.)”葡萄健康叶片和缺磷胁迫不同时期下的光谱信号特征变化, 构建基于光谱技术的“赤霞珠”葡萄叶片缺磷胁迫快速无损诊断模型, 为葡萄园病害防治与管理提供理论参考和技术支持。 以酿酒葡萄“赤霞珠”葡萄叶片为研究对象, 分别采集了正常、 缺磷胁迫初期和末期葡萄叶的VIS/NIR反射率信息。 对比Savitzky-Golay卷积平滑(S-G Smoothing)、 移动平均平滑(MAS)、 标准正态变换(SNV)和多元散射校正(MSC)4种预处理及组合方法对于去除葡萄叶光谱信号中随机噪声的能力, 确定最佳预处理方法。 采用连续投影法(SPA)筛选与“赤霞珠”葡萄叶缺磷胁迫相关的光谱特征变量, 分别构建基于线性核函数(Linear)、 多项式核函数(Poly)、 径向基核函数(RBF)和二层神经网络核函数(Sigmoid)的支持向量机(SVM)模型, 以灵敏度(SEN)和准确率(CCR)为依据评估模型诊断性能, 形成基于VIS/NIR光谱的“赤霞珠”葡萄叶片缺磷胁迫快速无损诊断方法。 S-G Smoothing预处理后的光谱信号的信噪比为110.58, 以其为校正集构建的缺磷胁迫诊断模型最佳, 因此确定其为最佳的预处理方法。 采用主成分分析(PCA)计算样本光谱贡献率, 以95%置信空间为依据检测数据集中的异常样本, 最终发现并剔除了22的离群点。 通过SPA筛选出402.6、 404.6、 409、 411.5、 539.4、 691.9、 729.9、 838.7、 1 011.9、 1 017.5和1 020.5 nm等11个反映“赤霞珠”葡萄叶缺磷胁迫的光谱特征波段, 作为缺磷胁迫快速无损诊断模型的输入变量。 通过对比分析上述4种核函数SVM的诊断结果, 以Linear为核函数构建的“赤霞珠”葡萄叶缺磷胁迫诊断模型能力最佳, 对正常叶片诊断的SEN为81.08%, CCR为100%; 对缺磷胁迫早期叶片诊断的SEN为100%, CCR为84.78%; 对缺磷胁迫末期叶片诊断的SEN为100%, CCR为100%。 该研究建立了基于VIS/NIR光谱的“赤霞珠”葡萄叶片缺磷胁迫快速无损诊断方法, 能够满足葡萄园病害防治与智能化管理的生产需求, 为酿酒葡萄智慧农业发展提供了技术参考。
The study aimed to clarify the VIS/NIR spectral characteristics of Cabernet Sauvignon leaves with phosphorus deficiency, then to construct a rapid and nondestructive diagnosis model, which is expected to help the vineyard management and disease control. Firstly, the grape leaves in healthy, early and later stress by phosphate deficiency were analyzed by VIS/NIR micro fiber spectrometer. In order to remove noise interference, four preprocessing methods, including Savitzky-Golay convolution smoothing (S-G Smoothing), moving average smoothing (MAS), standard normal variate (SNV) and multiple scattering corrections (MSC), were used to optimize spectral signals. Then, the successive projections algorithm (SPA) was used to select the feature wavebands of leaf phosphate deficiency. Finally, the support vector machine models were constructed based on four different kernel functions, including linear kernel function (Linear), polynomial kernel function (Poly), radial basis function (RBF) and Sigmoid tanh function (Sigmoid), to diagnose the phosphate deficiency of leaves. The sensitivity (SEN) and accuracy (CCR) were cited to assess the availability and effectiveness of those models. Experimental results proved that S-G Smoothing was the best preprocessing method because of the better signal-to-noise ratio of spectrum processed by it and the good availability of the model based on it. Principal component analysis (PCA) was used to find outliers with a confidence interval of 95%. 22 samples were identified with outliers and removed. Eleven wavebands (402.6, 404.6, 409.0, 411.5, 539.4, 691.9, 729.9, 838.7, 1 011.9, 1 017.5 and 1 020.5 nm) were selected by SPA to consider as reflecting the information of phosphate deficiency and be the input variables of the diagnosis model. After the contrast of four models with different kernel functions, it can be known that the SVM model with Linear showed better sensitivity and accuracy than others. Its SEN was 81.08%, and CCR was 100% for healthy leaves, its SEN was 100%, and CCR was 84.78% for early-stage diseased leaves, and its SEN and CCR were 100% for late-stage diseased leaves. In this study, A rapid and nondestructive diagnosis method was proposed based on VIS/NIR spectroscopy for phosphate deficiency of the Cabernet Sauvignon leaves, which is expected to improve the management and disease control of the vineyard and the intelligence of wine grape cultivation.
“ 赤霞珠(Cabernet Sauvignon, Vitis Vinifera L.)” 是我国种植面积最广的酿酒葡萄品种, 广泛分布于新疆、 宁夏、 云南、 山西和河北等地[1]。 磷是“ 赤霞珠” 生长发育的必需营养元素之一, 参与了生物膜与核酸的合成、 新陈代谢、 酶的活性调节等重要生物过程。 根据产量不同, 每公顷成年葡萄树每年消耗的磷元素为5~15 kg[2]。 缺磷会抑制“ 赤霞珠” 的花粉受精作用[3], 增加胚退化的风险[4], 减低葡萄树的抗逆性。 缺磷病的诊断一直以来都是葡萄病害防治的重点, 传统分析方法(如磷钒钼黄比色法[5])的破坏性极强, 实时性差, 进而导致错过低磷治理的最佳时效期; 即时检测法[6]的成本高且伴随转基因植物环境释放问题, 并不符合可持续发展的理念。 开发葡萄叶片缺磷胁迫的低成本、 实时、 无损检测方法, 对“ 赤霞珠” 叶片缺磷病的防治, 提高葡萄园经济效益具有重要意义。 可见光/近红外(VIS/NIR)光谱分析技术具有原位无损、 高通量快速、 实时在线等特点[7], 可通过电子跃迁记录葡萄叶片中的磷含量信息, 基于化学计量学方法可精准诊断葡萄叶片缺磷胁迫情况。 葡萄叶重金属元素的光谱映射波段已有广泛研究。 Mirzaei等[8]和Roviello等[9]采用全波段原位光谱(350~2 500 nm)分析“ Askari” 和“ Vivarais” 葡萄叶片的重金属含量, 研究发现Cu的特征波段为2 431、 809、 489和616 nm; Zn的特征波段为2 032、 883、 665、 564、 688和437 nm; Pb的特征波段为1 865、 728、 692、 683和356 nm; Cr的特征波段为863、 2 044、 415、 652、 713和1 036 nm; Cd的特征波段为1 373、 631、 744和438 nm, 构建了葡萄叶重金属含量实时监测系统, 实现对葡萄园重金属胁迫的风险把控。 光谱分析技术在葡萄叶病虫害的快速诊断中的应用较为成熟。 Pithan等[10]以“ 赤霞珠” 葡萄叶为研究对象, 通过对比叶片患霜霉病前后的光谱反射率确定了8个特征波段(443、 496、 516、 573、 695、 1 420、 1 900和2 435 nm), 分析发现这些波段主要分布于叶绿素和水分的响应区间, 进一步推断霜霉病会降低葡萄叶的叶绿素和水分代谢。 Junges等[11]分析了“ 梅洛” 葡萄卷叶病(GLRaV)在VIS/NIR光谱波长范围的响应关系, 探明绿峰(520~550 nm)、 叶绿素吸收峰(650~670 nm)、 红边(700~720 nm)和近红外初始波段(800~900 nm)为GLRaV的有效表征区间, 建立了GLRaV的实时诊断方法。 Yang等[12]以葡萄叶的VIS/NIR光谱信息为输入量, 基于轻量级人工神经网络ShuffleNet V2开发了葡萄叶炭疽病、 霜霉病、 扇叶病、 叶蝉和螨虫等多种病虫害的实时诊断系统, 增强葡萄园病虫害防止的科学与实时性。 目前, 葡萄叶缺素症的光谱实时诊断研究也成为重点研究之一。 Rustioni等[13]基于葡萄叶片缺铁会叶绿素含量降低的生理特点, 通过分析341~1 025 nm范围内的450个反射信息确立了以叶绿素特征(495~678 nm)为主要依据的叶片缺铁诊断模型, 该方法适用于多个品种的葡萄叶片分析。 Rustioni等[14]使用Jaz系统光谱仪采集了多品种葡萄叶片在341~1 025 nm范围内的反射率信息, 分别绘制了葡萄叶片缺氮和钾的光谱指纹图谱, 为葡萄园微量元素营养管理提供依据。 Cuq等[15]通过“ 长相思” 葡萄叶908~1 676 nm的光谱信息追溯含碳、 氢、 氮、 硫等官能团的物质含量变化, 进而检测葡萄叶的氮素利用率及氮素营养状况, 为氮肥施用提供决策信息。 在Cuq等[16]进一步的研究中, 基于908~1 676 nm的光谱反射率构建了葡萄叶钾、 钙和镁等多种元素的原子质量预测模型, 用于检测葡萄的营养健康监测和缺素症防治。 上述研究结论佐证了采用光谱分析技术实时诊断葡萄叶重金属、 病虫害和缺素胁迫具有一定的可行性, 但有关葡萄叶缺磷胁迫的光谱快速无损诊断研究甚少, 尚未实现对低磷症状的准确识别。 本研究以酿酒葡萄“ 赤霞珠” 叶片为研究对象, 分别采集了正常、 缺磷胁迫初期和末期葡萄叶的VIS/NIR反射率信息, 通过化学计量学方法筛选磷素的光谱表征波段, 构建“ 赤霞珠” 叶片缺磷胁迫的快速无损诊断方法, 为葡萄园病害防治与管理提供理论参考和技术依据。
试验于2021年7月至8月在西北农林科技大学曹新庄试验农场(108.07° E, 34.28° N)进行, 平均海拔530 m, 试验期间平均气温为21~29 ℃, 平均降雨量123.73 mm。 选取东西向四行“ 赤霞珠” 品种酿酒葡萄为研究对象, 每行40株(株距1 m), 通过实验诱发西侧植株受缺磷胁迫。
实验分别采用数码相机(EOS 800D, 佳能(中国)有限公司, 中国)和200~1 100 nm微型光纤光谱仪[ATP3030, 奥谱天成(厦门)光电有限公司, 中国]实时采集“ 赤霞珠” 葡萄叶片460片。 参考张敏等[17]研究方法, 通过阈值分割算法将样本划分为健康叶片、 缺磷胁迫初期、 末期, 缺磷像素g(x, y)计算公式如式(1)
式(1)中, f(x, y)为葡萄叶片图像的灰度值, T为缺磷像素点的判别阈值。 若缺磷像素点占总像素点的0~20%, 则判定为缺磷胁迫初期; 若缺磷像素点大于20%, 则判定为缺磷胁迫末期。 最终获取了健康叶片120个、 缺磷胁迫早期叶片140个、 缺磷胁迫晚期叶片200个。 “ 赤霞珠” 葡萄叶片缺磷胁迫的诊断模型依托于数学平台(Matlab R2021b, The MathWorks公司, 美国)进行开发与测试。
由于环境杂光干扰和叶面散射现象, 田间实时采集的葡萄叶光谱信号包含部分随机噪声和散射噪声, 导致信号出现基线抖动或漂移等干扰。 Savitzky-Golay卷积平滑(S-G Smoothing)和移动平均平滑(MAS)等方法可有效提高光谱信号的平滑, 去除随机噪声; 标准正态变换(SNV)和多元散射校正(MSC)等方法可校正光谱曲线的位置, 去除散射噪声。 本研究采用上述4种方法及组合方法处理葡萄叶健康时和缺磷胁迫下的光谱信号, 降低信号噪声对“ 赤霞珠” 葡萄叶缺磷胁迫诊断的干扰。
在葡萄叶光谱信号的田间采集过程中, 人为操作误差会使数据集中个别样本严重偏离真实值, 出现离群点。 本研究采用主成分分析(PCA)计算样本的特征向量, 分析样本方差衍变的矢量方向及幅度, 获取样本在主成分载荷图中的聚类, 落在样本聚类置信空间之外的样本被判定为离群点。
葡萄叶光谱信号中不仅反映了磷素的相关信息, 也包含了叶绿素、 水分、 其他营养元素等生物信息。 因此, 筛选与缺磷胁迫存在响应关系的特征波段, 可有效降低模型的时间复杂度和空间复杂度。 本研究采用连续投影法(SPA)筛选葡萄叶光谱信号中缺磷胁迫的特征波段, 具体方法如下:
设样本量为N, 光谱信号包含M个变量, 由此构成样本集的光谱矩阵XN× M。 xj(XN× M第j个列向量)为初始向量, K为需要提取的变量数。 分别xj计算对剩余列向量xk(M-1)的投影
提取最大投影向量的光谱波段k(m)
最终筛选出葡萄叶缺磷胁迫的特征波段为{k(m); m=1, …, M}。
特征波段的响应位置和程度会受到蓝(红)移和增色(减色)效应的影响, 从而与葡萄叶缺磷胁迫症状的对应关系呈较强的非线性。 支持向量机(SVM)可以通过高维映射分析葡萄叶缺磷胁迫与其光谱特征间的非线性映射关系, 进而构建准确稳定的诊断模型。 由于SVM的引用核函数会影响其在高维空间的内积运算方式以及对非线性关系的解析方向, 本研究分别构建了SVM在4种不同核函数驱动下的葡萄叶缺磷胁迫诊断模型, 核函数k(x, z)具体形式如下:
① 线性核函数(Linear)
式(4)中, x为特征波段向量, z为映射的特征向量, c为常数项。
② 多项式核函数(Poly)
式(5)中, a为向量系数。
③ 径向基核函数(RBF)
式(6)中, σ 为方差。
④ 二层神经网络核函数(Sigmoid)
式(7)中, b为向量系数。
为了科学客观地评估模型的性能, 确定最佳的“ 赤霞珠” 叶片缺磷胁迫诊断方法, 本研究采用信噪比(SNR)筛选最佳的光谱预处理算法, 通过灵敏度(SEN)和准确率(CCR)判别SVM模型诊断葡萄叶缺磷胁迫的有效性。
① SNR可反映光谱信号中的噪声比例, SNR越大, 说明光谱信号中的噪声越少, SNR的计算公式如式(8)
式(8)中, n为样本个数, j表示第j个样本; m为光谱信号长度, i表示光谱信号中的第i个波段变量; f表示原始光谱信号, f'表示预处理后的光谱信号。
② SEN和CCR可判别诊断模型的有效性, 计算公式如式(9)
式(9)中, TP为被正确分类的正例, FN为本来是正例, 错分为负例, FP为本来是负例, 被错分为正例。
由于卤素灯光源在200~400 nm范围不产生能量对扣, 导致光谱信号在此波段范围存在严重波动, 因此本研究选取400~1 030 nm范围的“ 赤霞珠” 葡萄叶光谱信号为建模研究的自变量。 图1(a, b, c)所示为“ 赤霞珠” 葡萄叶缺磷胁迫早期、 末期典型症状及其光谱信号。 400~700 nm范围内正常叶片和缺磷胁迫叶片的光谱信号重合率较高。 正常叶片在550 nm处有明显的反射峰, 此为叶绿素的绿色强反射峰区; 而在600~700 nm范围内反射率较低, 在670 nm左右出现的反射谷有“ 红谷” 之称。 缺磷胁迫的叶片在550 nm处没有强反射峰, 但在640 nm处出现明显的反射峰, 这一波段是红光的“ 强活性带” , 与叶片在缺磷胁迫下产生红褐色病斑的症状相符。 700~750 nm波段范围称为“ 植被反射率红边” , 反映了水分、 营养、 叶片面积等特征; 当叶片存在营养不良或病虫害时, 红边区域会趋近短波方向, 这与图1(c)所示的情况一致。 750~1 030 nm范围内正常叶片和缺磷胁迫叶片的光谱信号差异性较大, 反映了叶片细胞间隙、 层数及含水率等信息。 叶片在缺磷胁迫下含水率减少, 细胞干瘪引起间隙增大, 反射率升高, 与图1(c)所示结果一致。
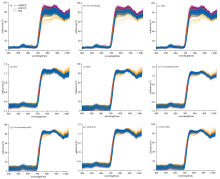
对比S-G Smoothing、 MAS、 SNV和MSC等4种方法及其组合方法抑制“ 赤霞珠” 葡萄叶光谱信号中基线抖动和散射噪声等干扰的有效性, 结果如图2所示。 图2(a)为原始光谱信号, 曲线分散范围较宽, 呈明显的毛刺状。 经过S-G Smoothing[图2(b)]和MAS[图2(c)]平滑预处理后光谱信号的SNR分别为110.58和101.74, 曲线趋于平滑, 分散范围不变; 经过SNV[图2(c)]和MSC[图2(d)]散射校正预处理后光谱信号的SNR分别为40.01和77.00, 曲线的分散范围被明显压缩, 毛刺状更加严重, 缺磷胁迫叶片在550 nm处的反射峰被强化, 正常叶片与缺磷胁迫叶片在750~1 030 nm范围的反射强度差异被弱化。 经过平滑与散射校正的融合算法[图2(f)— (i)]预处理后光谱信号的SNR分别为37.53、 82.97、 42.76和77.17, 曲线平滑且分散范围窄, 反射率变化与散射校正的结果相近。 上述研究发现, 基于S-G Smoothing预处理后光谱信号的SNR最高, 以其为校正集构建的缺磷胁迫诊断模型性能较其他预处理结果最佳, 因此确定S-G Smoothing为最佳的预处理方法。
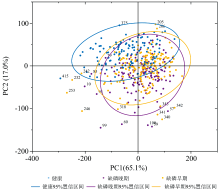
通过PCA计算样本光谱信号的各主成分, 并以95%置信空间为依据判别离群点, 结果如图3所示。 PCA计算表明, 第一主成分(PC1)对光谱信号的表征率为65.1%, 第二主成分(PC2)对光谱信号的表征率为17.0%, 前两个主成分的合计表征率高达82.1%, 有效整合了“ 赤霞珠” 葡萄叶片光谱信号的重要信息。 基于PC1和PC2的载荷矩阵分别绘制正常、 缺磷胁迫初期、 末期“ 赤霞珠” 叶片样本的95%置信空间。 从图2看可知, 正常叶片中2个样本分布于95%置信空间外部, 缺磷胁迫初期和末期的叶片中分别有11个和9个样本分布于95%置信空间外部。 因此, 上述22个样本被判别为离群点, 不可用于构建“ 赤霞珠” 葡萄叶缺磷胁迫的诊断模型。
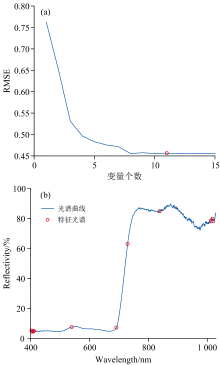
通过SPA筛选“ 赤霞珠” 葡萄叶缺磷胁迫在400~1 030 nm范围光谱信号的响应波段, 结果如图4(a, b)所示。 图4(a)为设定选取变量个数迭代增长下, 光谱特征对叶片缺磷胁迫表征的均方根误差(RMSE)。 当选取11个光谱特征变量时, 变量协同表征叶片缺磷胁迫表征的RMSE最小, 为0.47。 所筛选出的11个光谱特征变量为402.6、 404.6、 409、 411.5、 539.4、 691.9、 729.9、 838.7、 1 011.9、 1 017.5和1 020.5 nm。 其中539.4、 691.9和729.9 nm反映了叶片缺磷时叶绿素的应激变化; 1 011.9、 1 017.5和1 020.5 nm共同反映了磷素的含量变化, Li等[18]将其作为高光谱定量分析植物冠层磷素变化的重要波段。
采用浓度梯度法(CG)将剔除异常值后的438个叶片样本按照3∶ 1划分为328个校正集和110个验证集。 分别构建以Linear、 Poly、 RBF和Sigmoid为核函数的“ 赤霞珠” 葡萄叶片缺磷胁迫SVM诊断模型, 模型性能评估如表1所示。
| 表1 不同核函数下SVM的最佳模型参数及缺磷胁迫诊断结果 Table 1 Optimal model parameters of SVM under different kernel functions and diagnosis results of phosphorus deficiency stress |
取最佳的惩罚因子(C)、 阶数(d)、 系数(Gamma)时, 以Linear、 Poly和RBF为核函数构建的SVM模型训练准确率均达到100%, Linear、 Poly核函数的SVM模型验证准确率为97.83%, 优于RBF核函数SVM模型。 对110个预测集葡萄叶样本的缺磷胁迫诊断表明, Linear核函数的SVM模型将7个正常叶片误判为缺磷早期, 对正常叶片诊断的SEN为81.08%, CCR为100%; 对缺磷胁迫早期叶片诊断的SEN为100%, CCR为84.78%; 对缺磷胁迫末期叶片诊断的SEN为100%, CCR为100%。 Poly核函数的SVM模型将10个正常叶片误判为缺磷早期, 对正常叶片诊断的SEN为72.97%, CCR为100%; 对缺磷胁迫早期叶片诊断的SEN为100%, CCR为79.59%; 对缺磷胁迫末期叶片诊断的SEN为100%, CCR为100%。 RBF核函数的SVM模型对正常叶片诊断的SEN为64.86%, CCR为85.71%; 对缺磷胁迫早期叶片诊断的SEN为76.92%, CCR为52.63%; 对缺磷胁迫末期叶片诊断的SEN为58.82%, CCR为80%。 综上分析, 以Linear为核函数构建的SVM模型对“ 赤霞珠” 葡萄叶缺磷胁迫的诊断能力最佳。
采用便携式光栅光谱仪实时采集植物叶片的VIS/NIR光谱, 会受到田间自然光照的影响, 导致光谱信号中产生基线抖动等干扰噪声。 有研究分析了10种预处理的120种排列组合方法对玉米、 小麦等多种植物光谱信号的优化结果, 研究发现S-G Smoothing可以有效提高光谱的信噪比, 减少杂散光引起的随机噪声。 利用Ocean Optics USB2000+光纤光谱仪分析并构建黄瓜白粉病的无损诊断方法研究中指出, 田间实时获取的黄瓜叶片光谱信息需经过S-G smoothing预处理, 才能作为白粉病诊断模型的输入信号。 本研究获取的“ 赤霞珠” 葡萄叶片光谱信号也包含基线抖动噪声, 在对比多种预处理方法后发现, 基于S-G smoothing预处理构建的缺磷胁迫诊断模型性能最佳。
400~700 nm范围的光谱信号反映了植物叶片中叶绿素的主要信息, Li等[19]通过光和色素对辐射能的选择吸收实验, 研究发现叶绿素a、 b的吸收特征谷分布于450和670 nm附近。 Li等[20]的研究证明植物叶片对光的反射率和折射率较差, 会引起叶绿素a、 b的吸收谷之间形成“ 绿峰” , 该峰值可直接反映叶绿素的含量。 “ 赤霞珠” 葡萄叶片在受到缺磷胁迫时, 会引发叶绿素减少, 叶片出现红褐色块斑症状。 其光谱信号表现形式为610~700 nm范围的反射率升高, “ 绿峰” 不明显。 这是由于红橙光波为叶绿素吸收的“ 强活性带” , 叶绿素的减少必然会导致该波段光的反射率升高[21]。
提取葡萄叶片缺磷胁迫的特征波段作为输入变量, 可有效降低缺磷胁迫模型的时间复杂度和空间复杂度, 提高关键信息的权重。 SPA基于矢量空间共线性最小化法则对变量进行向前选择, 有研究对比分析了SPA和其他3种特征提取方法, 基于SPA提取结果构建的葡萄叶氮素检测模型性能最佳; Cuq等[15]采用SPA提取了葡萄叶钾素相关的12个光谱特征变量, 开发了葡萄园冠层钾素在线检测系统。 本研究以RMSE为标准, 采用SPA提取了“ 赤霞珠” 葡萄叶缺磷胁迫的11个特征变量, 对葡萄叶缺磷胁迫的早期、 末期都表征较好。 不同核函数赋予了SVM不同程度的非线性分析能力, Linear保留了SVM较强的线性关系分析能力; Poly适合于正交归一化后的数据; RBF增强了SVM分析非线性关系的能力, 但受核参数影响较大; Sigmoid可以加强SVM自学习的能力。 在“ 赤霞珠” 葡萄叶缺磷胁迫的诊断模型构建中, 以Linear为核函数的SVM性能最佳, 这表明葡萄叶缺磷胁迫与光谱信号之间存在直接的线性关系。 Herná ndez等[22]和Lu等[23]采用偏最小二乘线性回归模型分别探究葡萄叶霜霉病和白粉病与光谱信号之间的线性关系, 都取得了较好诊断结果, 论证了叶面病害与光谱信息存在线性关系具有普适性。
基于微型光纤光谱仪采集“ 赤霞珠” 葡萄叶缺磷胁迫不同时期的VIS/NIR光谱信号, 尝试开发基于光谱技术的葡萄叶片缺磷胁迫快速无损诊断方法, 具体结论如下:
(1)研究筛选出的11个与“ 赤霞珠” 葡萄叶缺磷胁迫相关的光谱特征变量, 其中539.4、 691.9和729.9 nm反映了叶片缺磷时叶绿素的应激变化; 1 011.9、 1 017.5和1 020.5 nm共同反映了磷素的含量变化。
(2)经过S-G Smoothing预处理, 以Linear为核函数构建的SVM模型对“ 赤霞珠” 葡萄叶缺磷胁迫诊断能力最佳, 对缺磷胁迫早期叶片诊断的SEN为100%, CCR为84.78%; 对缺磷胁迫末期叶片诊断的SEN为100%, CCR为100%, 为葡萄园病害防治与管理提供理论参考和技术依据。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|