作者简介: 张潇丹, 女, 1999年生, 河南科技大学食品与生物工程学院硕士研究生 e-mail: 3220447319@qq.com
乙醇脱氢酶(ADH)在酒精代谢过程中起着关键作用, 通过激活ADH活性可以促进人体对乙醇的吸收, 进而解酒保肝。 对ADH与表没食子儿茶素没食子酸酯(EGCG)的相互作用进行探究, 采用紫外可见光谱、 荧光光谱、 傅里叶变换红外光谱等多光谱法和分子对接法研究了ADH与EGCG的结合机理, 采用差示扫描量热仪测定ADH 和EGCG-ADH复合物的热变性温度, 进而分析二者的热稳定性变化, 并通过扫描电镜表征EGCG-ADH复合物的形貌和结构。 研究表明, EGCG激活了ADH的催化活性, 激活率为33.33%。 EGCG作用于ADH引起其微环境变化和二级结构变化, 形成了结合位点数接近于1的复合物, 范德华力和氢键对其稳定性起着重要作用; 相较于ADH, EGCG-ADH的二级结构中α-螺旋含量降低而β-折叠含量升高; 分子对接结果进一步证实了EGCG苯环羟基与周围氨基酸之间的氢键有利于保持配合物的稳定性, 而EGCG和ADH之间存在的范德华力和正烷基是ADH活性被激活的主要原因。 结果证明EGCG通过与ADH结合, 激活ADH的催化活性, 可为制备更加安全高效的解酒剂替代品提供理论指导。
Alcohol dehydrogenase (ADH) plays a key role in the pathway of alcohol metabolism. By activating ADH activity, the absorption of alcohol can be promoted to relieve alcoholism and protect the liver. This paper studied the interaction between ADH and epigallocatechin gallate (EGCG). The binding mechanism of ADH and EGCG was investigated by UV-Vis spectrum, fluorescence spectrum, Fourier infrared spectrum and molecular docking method. The thermal denaturation temperatures of ADH and EGCG-ADH complex were measured by differential scanning calorimeter, and then the thermal stability changes of the complex EGCG were analyzed. EGCG was characterized by scanning electron microscope. The results showed that EGCG activated the catalytic activity of ADH, and the activation rate was 33.33%. The effect of EGCG on ADH caused its microenvironment and secondary structure changes, forming a complex with anumber of binding sites close to 1, and van der waals force and hydrogen bond played an important role in its stability. Compared with ADH, the α-helix content in the secondary structure of the complex decreased, and the β-sheet content increased. In addition, the molecular docking results further confirmed that the hydrogen bond between the hydroxyl group of the EGCG benzene ring and the surrounding amino acids is beneficial to maintain the stability of the complex. In addition, the van der waals force and n-alkyl between EGCG and ADH are the main reasons for the activation of ADH activity. The above results proved that EGCG can activate the catalytic activity of ADH by combining with ADH, which can provide theoretical guidance for the preparation of safer and more efficient alternatives to hangovers.
过度饮酒会导致酒精中毒和酒精性疾病, 包括酒精性肝硬化、 肝纤维化、 肝癌等[1]。 近年来, 许多研究已证实加速消除血清中酒精是缓解酒精性肝损伤的有效策略[2]。 乙醇脱氢酶(alcohol dehydrogenase, ADH)作为一种酒精代谢酶, 能够加速酒精在体内的代谢, 减轻其对肝脏系统、 消化系统及神经系统的损害, 与某些肝脏疾病密切相关[3]。 对ADH进行研究并寻找维持其活性的有效途径是十分必要的。
近年来, 对于维持和激活ADH活性的研究已成为食品科学、 化学、 药学和临床医学领域的热点[4]。 孙小红等[5]将ADH作为靶点, 测定了荸荠提取物对其活性的影响, 结果显示荸荠提取物能够增强小鼠血液和肝脏中ADH活性, 进而改善小鼠急性酒精中毒; 余带兵等[6]采用磁性纳米颗粒固定化ADH, 结果表明固定化酶具有良好的耐高温、 耐碱性和操作稳定性; 通过酒精胃损伤模型小鼠试验, 得出中药材北虫草的水提物能够增强胃组织的ADH活性, 且呈现一定的浓度依赖性, 进而对酒精性胃损伤起到保护作用[7]。 此外, 较多学者还研究了类黄酮、 多酚、 多糖、 生物活性肽等活性物质对ADH的激活作用。 香菇多肽能够激活ADH并促进酒精代谢来减轻酒精毒性[8]; 采用超声-微波协同法提取出的佛手多糖对ADH具有很强的激活能力[9]。 尽管已经有大量的研究关注小分子物质对ADH活性的影响, 然而这些物质与ADH之间确切的相互作用机制及二者互作的结合方式尚未完全了解, 研究ADH和多酚等小分子之间的互作方式及二者结合机理是十分有必要的。 研究表明茶多酚可显著降低乙醇和乙醛浓度, 能够增强肝和胃中ADH的活性[10]。 表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)作为茶多酚的主要成分, 能够吸收紫外线, 促进皮肤细胞再生, 且具备抗菌消炎, 消除自由基等多种抗氧化作用[11], 目前为止, 还没有明确阐明EGCG与ADH之间相互作用机制的研究。
本研究旨在通过多光谱分析法和分子对接法探究EGCG与ADH的相互作用机制, 在分子水平上为蛋白酶与多酚的相互作用机制提供理论基础, 同时为提高ADH的活性, 使其成为一种很有前途的解酒产品提供新的思路。
乙醇脱氢酶(ADH)、 氧化型辅酶I(NAD+)和表没食子儿茶素没食子酸酯(EGCG)均购自上海麦克林生化科技有限公司; Tris-HCl缓冲液购自上海源叶生物科技有限公司; 实验室中所用其他试剂均为分析纯。
LGJ-10D真空冷冻干燥机, 上海旦鼎国际贸易有限公司; UV-2600紫外分光光度计, 日本日立公司; Cary eclpise荧光分光光度计, 美国Aglient Cary elipse公司; VERTEX70傅里叶红外光谱仪, 德国Bruker公司; DSC1型差示扫描量热仪, 瑞士Mettler-Toledo公司; 电子扫描显微镜(SEM), TM3030Plus型, 日本岛津公司; HH-2型数显恒温水浴锅, 常州朗越仪器制造有限公司。
1.3.1 紫外可见光谱法(UV-Vis)测定EGCG对ADH酶活的影响
在瓦勒-霍赫 (Valle& Hoch) 法[12]的基础上稍作修改来测定ADH活性。 在10 mL试管中依次加入Tris-HCl缓冲液(pH 8.0)、 乙醇溶液、 0.027 mol· L-1的氧化型辅酶I(NAD+)和一定浓度的EGCG溶液, 摇匀后放入25 ℃水浴锅中保温10 min。 将混合液倒入1 cm比色皿中, 立即加入0.1 mL 0.25 U· mL-1的ADH引发酶促反应, 以蒸馏水作空白调零, 在紫外分光光度计340 nm波长处读取吸光值, 并以15 s间隔为单位, 连续测定5 min, 作标准曲线图。 以蒸馏水代替EGCG作对照, 采用式(1)和式(2)计算 ADH 活性和EGCG对ADH的激活率。
式中, E为ADH的酶活力(U· mL-1), 其中E1是样品组酶活力, E0是空白组酶活力; Eω 为反应液的含酶量(mg· mL-1); A为每分钟340 nm波长吸光度的增大值; 1.6为反应体系的总体积(mL); 6.2为NADH的克分子吸光值系数; Q为ADH的激活率(%)。
1.3.2 三维荧光光谱法(EEM)测定EGCG与ADH的相互作用
配制2.0× 10-6 mol· L-1ADH溶液, 移取1.0 mL于离心管中, 加入100 μ L浓度为2× 10-5 mol· L-1的EGCG溶液, 在298 K条件下恒温水浴, 充分混匀后静置5 min。 用荧光分光光度计扫描ADH及EGCG与ADH作用的三维荧光光谱, 测定条件为: 激发波长(200~300 nm), 发射波长(300~500 nm), 狭缝(10 nm)。
1.3.3 荧光光谱法(FS)测定EGCG与ADH的相互作用
取1.0 mL浓度为2.0× 10-6 mol· L-1的ADH溶液于试管, 依次吸取2× 10-5 mol· L-1的EGCG溶液100 μ L加入, 在298 K条件下水浴5 min。 用荧光分光光度计对ADH和EGCG-ADH复合物的荧光进行扫描。 测定条件为: 激发波长(280 nm), 扫描范围(290~450 nm), 激发和发射狭缝均为10 nm。 此外, 将固定荧光发射与激发的波长差Δ λ 分别设置为15和60 nm, 对二者的同步荧光光谱图进行扫描。
1.3.4 傅里叶红外光谱法(FTIR)测定EGCG与ADH的相互作用
以1∶ 100的比例将ADH与EGCG-ADH复合物分别与干燥12 h的溴化钾粉末混匀研细, 压片后用傅里叶红外光谱仪扫描图谱。 测定条件为: 分辨率(4 cm-1), 扫描范围(4 000~400 cm-1)。 扫描结果用OMNIC和Peak Fit v4.12软件处理, 进行基线校正, 高斯卷积处理, 二阶导数拟合, 得到图谱的各特征峰峰面积, 并根据峰面积计算各二级结构的比率, 进而分析复合了EGCG后ADH在酰胺Ⅰ 带二级结构的变化。
1.3.5 差示扫描量热法(DSC)测定EGCG与ADH的相互作用
参考徐佳茜[13]的方法并加以改进, 用差示扫描量热仪测ADH粉末和EGCG-ADH复合物粉末的热变性温度, 测定温度范围为20~120 ℃, 升温速率10 ℃· min-1, 样品量2~3 mg, 氮气流速80 mL· min-1。
1.3.6 EGCG-ADH复合物的微观形貌观察
将一定浓度的ADH与EGCG溶液等比例复合, 经真空冷冻干燥制得ADH冻干粉和EGCG-ADH复合物冻干粉。 对两种粉末进行喷金后, 在加速电压5 kV, 工作距离5.9 mm条件下, 用电子扫描显微镜(TM3030Plus型, 日本岛津公司)观察样品, 采集放大600倍的图片。
1.3.7 分子对接
在AutoDockTools-1.5.6软件中进行分子对接。 乙醇脱氢酶(PDB ID: 1ADC)的晶体结构取自Protein Data Bank蛋白质数据库, EGCG的分子结构取自PubChem数据库。 采用Autodock对ADH与EGCG进行去水与加全氢等预处理。 利用Lamarckian genetic algorithm算法对接50次, 其余参数设置为默认值, 并根据二者的结合能大小对结果排序, 最后借助Discovery Studio 2019、 Pymol等软件进一步分析最低能量的构象。
1.3.8 数据处理
对每组试验均做3次平行试验, 利用Origin 9.0软件对光谱数据进行平滑处理及作图, 采用DPS 7.05软件进行显著性分析。
乙醇以NAD为辅酶, 通过ADH催化转化为乙醛。 在整个反应体系中, NADH在340 nm处具有最大吸收。 因此, 340 nm处吸光度变化, 可以表明ADH的酶促反应速率[14]。 如图1所示, 在340 nm处, EGCG的加入增加了ADH紫外吸收的强度, 分析认为EGCG与ADH的Trp和Tyr残基之间新生成了共轭体系, π — π 电子对能级跃迁。 ADH催化乙醇的反应速率曲线结合瓦勒-霍赫(Valle& Hoch) 法[12], 计算得出: EGCG对ADH的激活率为33.33%。
2.2.1 EGCG与ADH结合的三维荧光光谱分析
三维荧光光谱能够整合生物样品中荧光分子的特征信息, 获取更完整的蛋白质有效光谱信息, 同时还能反映出蛋白质的分子构象以及发光基团的微环境变化[15]。 为进一步研究EGCG与ADH结合后体系分子构象、 多肽骨架及残基微环境的变化, 测定了ADH与EGCG-ADH的三维荧光光谱。 结果如图2所示。 三维荧光光谱中主要有两种典型峰, 其中Peak 2的光谱特性主要表现为Trp和Tyr残基。 由图2结果可知, 加入6.67× 10-6 mol· L-1 EGCG后, Peak 1和Peak 2的荧光强度有所降低, 且最大发射波长发生了红移, 荧光强度降低表明EGCG与ADH发生了相互作用并产生荧光猝灭现象。 红移现象表明EGCG影响了ADH周围的微环境, 使其极性增强、 亲水性增大、 疏水性降低, 肽链结构发生变化。
2.2.2 EGCG与ADH结合的荧光光谱分析
荧光光谱学是研究配体与蛋白质相互作用的经典方法, 通过研究配体与酶之间的结合模式可以进一步探索酶促反应的激活机制[16]。 图3显示了ADH在不同EGCG浓度下的特征荧光光谱, 由于ADH的每个亚基中都含有芳香族氨基酸, 主要包括色氨酸残基(Trp)和酪氨酸残基(Tyr), 因此, ADH在340 nm处出现了固有荧光峰。 随着EGCG浓度的增加, ADH的荧光强度逐渐降低, 这表明EGCG对ADH产生猝灭作用, 且猝灭强度与其添加量具有依赖性。 EGCG的添加使ADH的发射波长出现了轻微的红移(2 nm), 这一现象表明EGCG与ADH之间存在相互作用, ADH蛋白主链疏松, 蛋白质内部的Trp和Tyr残基得以暴露, ADH芳香族氨基酸周围微环境改变, 促进了两者之间的疏水相互作用, 形成了氢键[17]。
2.2.3 荧光猝灭机理的判定
为了区分EGCG对ADH的猝灭类型- 采用Stern-Volmer等式(3)分析相应的荧光强度值[18]
式(3)中: F0、 F分别为加入猝灭剂前和加入后蛋白的荧光强度; Kq为双分子猝灭速率常数[L· (mol· s)-1]; τ 0为荧光体自身寿命, 蛋白的平均寿命约为10-8 s; Q为猝灭剂浓度, mol· L-1; KSV为动态猝灭常数, L· mol-1。
以F0/F为因变量, 对[Q]进行线性拟合, 结果如图4所示, 进而通过式(3)得出Kq和KSV, 分别为2.947× 1012 M-1· s-1, 2.947× 104 (L· mol-1)。 EGCG与ADH的Stern-Volmer曲线具有良好的线性关系, R2=0.990 6。 因为在温度298 K, EGCG-ADH配合物的Kq值为2.947× 1012 M-1· s-1, 远远大于最大动态猝灭常数(2.0× 1010 M-1· s-1)。 结果表明, EGCG对ADH的猝灭作用形式为静态猝灭。 Huang等[19]在对芦丁与醇脱氢酶结合特性的研究中发现芦丁与乙醇脱氢酶相互作用的荧光猝灭方式为静态猝灭并通过时间分辨荧光法得到验证, 与本研究结果相似。
2.2.4 结合常数和结合位点的计算
ADH和EGCG之间的相互作用的确切性质可以根据方程(4)计算出结合常数KA和结合位点n。
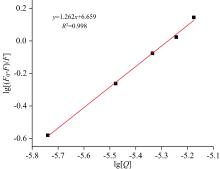
根据式(4)将相应实验数据拟合并绘制双对数图, 并计算出结合常数KA为4.558× 106, n为1.262。 由图5可知, EGCG与ADH的双对数曲线具有良好的线性关系, R2=0.997 7。 在298 K温度下, n的值接近于1, 由此可见, EGCG在ADH上存在一个单一的结合位点。 EGCG-ADH配合物的KA值为106 M-1数量级, 说明EGCG与ADH之间具有高度亲和力。 这种现象与庹浔等[20]在研究秋水仙碱与醇脱氢酶的相互作用机理, 得出二者形成的复合物结合位点数接近于1一致。
酶的生物学功能与其二级结构密切相关, 因此采用同步荧光、 三维荧光光谱和FTIR光谱等广泛应用的方法来探讨EGCG与ADH相互作用后的结构变化。 同步荧光光谱能够提供蛋白质中发色团的特征信息, 当Δ λ 为60和15 nm时, 分别获得色氨酸残基(Trp)和酪氨酸残基(Tyr)的信息。 结果表明, 添加EGCG后, ADH的Trp和Tyr荧光发生猝灭[图6(a, b)]。 这表明EGCG与ADH的结合导致ADH的荧光量子产率降低。 随着EGCG浓度的增加, Tyr残基的最大发射波长保持不变, 而Trp残基发生了轻微红移(3 nm)。 这些现象表明, EGCG诱导了ADH周围Trp残基的微环境极性变化, 与二者的三维荧光光谱分析结果一致。 黄国等[21]研究了EGCG对7S/11S蛋白结构的影响, 结果与本文相似。
FTIR光谱进一步对EGCG-ADH复合物进行研究, 并分析二者的相互作用以及添加EGCG后对ADH蛋白质二级结构的影响。 结果如图7所示。
由红外光谱分析得出酰胺Ⅰ 带蛋白质二级结构相对含量表1, 结果显示, β -折叠是ADH蛋白的主要二级结构, 添加EGCG之后, ADH的α -螺旋含量从4.47%下降到1.85%, β -折叠含量从77.71%上升到92.32%。 因为酚类的— OH可以提供氢参与氢键的形成, 氧原子可以作为氢键的受体, 所以加入酚类, α -螺旋含量降低而β -折叠含量增加。 说明EGCG与ADH的结合使ADH多肽链的延伸, 导致了某些区域的亲水性更强, 这种变化可能是影响ADH生理功能的重要因素[22]。
| 表1 ADH和EGCG-ADH复合物的酰胺Ⅰ 带蛋白质二级结构相对含量 Table 1 The relative content of secondary structure of protein in amide Ⅰ band of ADH and EGCG-ADH complex |
酶的热变性与其空间构象的变化密切相关, 比如链的伸展或者折叠, 都会导致酶学性质发生改变。 差示扫描量热仪分析复合EGCG后ADH的变性程度, 主要由变性温度(Ts)和热焓变(Δ H)来表示, 其中Ts是测定蛋白质热稳定性的一个重要指标, Δ H则主要分析疏水作用和蛋白质结构紧密性。 ADH在40~120 ℃范围的DSC曲线如图8所示。 ADH出峰温度为103.31 ℃, 在106.26 ℃有一个较大的放热峰, 热焓为58.59 J· g-1。 EGCG与ADH相互作用后, 其变性温度从106.26 ℃降至105.95 ℃, 说明EGCG对ADH的热稳定性影响并没有很大, 但积分值从-175.78 mJ降到-73.38 mJ, 热焓从-58.59 J· g-1减少至-24.46 J· g-1。 变性温度的下降表明EGCG的添加促进了ADH蛋白结构的展开, 适度地降低了蛋白质的热稳定性。 热焓降低表明由于酚的引入, 酚羟基与蛋白分子骨架及侧链上的基团之间形成氢键, 从而破坏或阻止了蛋白质分子内氢键的形成, 构象部分发生伸展。 另外, 由于酚本身存在一定的空间结构, 与蛋白质氨基酸的结合使蛋白质结构变得松散, 提高了多肽链的移动性和柔性。 与黄国等[23]对矢车菊素-3-葡萄糖苷与β -伴大豆球蛋白和大豆球蛋白的互作情况探究所得到的结果一致。
扫描电镜可以反映复合物的内部微观结构。 图9为ADH和EGCG-ADH复合物的内部微观结构图, 放大倍数为600倍。 通过观察可以得到ADH粉末[图9(a)]呈现纹理清晰的片状薄层结构。 而加入了EGCG的电镜扫描照片[图9(b)], 其表面为粗糙的珊瑚状结构, 说明EGCG成功与ADH复合, 明显改变了ADH的结构。
分子对接法能够对分子互作进行有效分析, 并提供更多有关EGCG与ADH之间相互作用的信息。 一般来说, 在ADH的催化氧化过程中, 辅酶NAD和底物醇的结合都会影响ADH的催化效率, 因此, 将锌离子、 底物和辅酶在ADH上的结合位点分别设置为对接中心进行分子模拟。 如图10所示, EGCG被ADH的氨基酸残基包围, 且与ADH的三个氨基酸残基结合, 即EGCG与Arg-133、 Glu-24、 Ile-23结合形成氢键, 这使得复合体更加稳定。 分子对接的结果显示, EGCG的苯环与ADH主要通过氢键和范德华力相互作用, 且为酶促反应实验中EGCG对ADH活性的激活作用提供了一个合理解释。
采用多种光谱学方法结合分子对接技术对ADH与EGCG的相互作用进行了研究。 结果表明: EGCG对ADH具有激活作用, 激活率为33.33%; 加入EGCG后, ADH的Trp和Tyr发生荧光猝灭, 蛋白质构象发生了变化, 疏水性降低, 且二者形成了基态稳定复合物, 其相互作用的荧光猝灭机制为静态猝灭; 与ADH相比, EGCG-ADH复合物的二级结构含量发生了变化, 其中α -螺旋含量降低, β -折叠含量升高。 通过热稳定性分析, 进一步表明二者的相互作用影响了蛋白质分子内氢键的形成, 构象部分发生伸展。 此外, 扫描电镜和分子对接仿真模型进一步证实了二者复合后的结构变化。 本研究对EGCG激活ADH的作用机制开展深入的研究, 进而为解酒剂替代品的制备提供理论指导。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|