作者简介: 郭净芳, 女, 1997年生, 河南科技大学食品与生物工程学院硕士研究生 e-mail: guojingfang_2020@163.com
猪血红蛋白(PHb)可以赋予和提升食品在制备、 加工和贮藏过程中的品质, 但因其黏度大、 性质不稳定、 且血腥味较重而不被人们所接受等因素, 限制了其在食品中的应用。 因此, 改性是提升其经济效益及生物可利用度的一种重要手段。 探究了儿茶素(Catechin)与糖基化猪血红蛋白(G-PHb)相互作用对复合物(CG-PHb)功能特性及结构变化的影响。 以PHb和G-PHb为对照, 研究CG-PHb的溶解度、 浊度、 乳化性能、 表面疏水性以及抗氧化性等功能特性, 采用紫外-可见光谱、 荧光光谱、 傅里叶变换红外光谱和扫描电镜, 分析CG-PHb的结构变化。 结果表明: 相较于PHb和G-PHb, CG-PHb的溶解度显著提高( p<0.05), 浊度显著降低( p<0.05); 乳化性以及乳化稳定性相较于对照组, 分别提高了38.36%、 21.31%和16.08%、 3.69%( p<0.05); 三者中CG-PHb的表面疏水性最大; 抗氧化性随着溶液浓度的升高不断增大, 溶液浓度为1.60 g·mL-1时, 抗氧化性最高达93.60%; CG-PHb的紫外吸收峰相较于对照组峰形变宽、 峰值增大且略微红移; 荧光峰强度大小为: CG-PHb>PHb>G-PHb, 且随着儿茶素的浓度增大, G-PHb的荧光猝灭效果呈现增强趋势, 并发生红移现象; CG-PHb的酰胺I带向低波数方向移动, 且二级结构含量中β-折叠含量显著增加( p<0.05), 其余结构含量减少( p<0.05); 此外, 电镜结果表明, 由于糖基基团的嵌入及与儿茶素之间的作用力, 使蛋白质的结构发生了变化, CG-PHb的表面孔洞结构增加, 有利于其功能特性的发挥。 该研究可以为蛋白质的改性研究提供新思路, 为复合物在食品加工过程中的性质变化提供理论基础及参考。
Porcine hemoglobin (PHb) can endow and improve food quality during preparation, processing and storage. However, it is limited to be used in food because of its high viscosity, unstable properties and heavy blood smell, which people do not accept. Therefore, modification is important to improve its economic benefits and bioavailability. This study investigated the effect of the interaction between catechin and glycosylated porcine hemoglobin (G-PHb) on the functional characteristics and structure of the complex of catechin and glycosylated porcine hemoglobin (CG-PHb). PHb and G-PHb were used as controls. The solubility, turbidity, emulsifying property, surface hydrophobicity and oxidation resistance of CG-PHb were studied.The structural changes of the CG-PHb were analyzed via UV-Vis, FS, FT-IR and SEM. The results show that the solubility of CG-PHB increased significantly ( p<0.05), and the turbidity decreased significantly ( p<0.05). The emulsifying activity and stability were increased by 38.36%, 21.31%, 16.08% and 3.69% respectively ( p<0.05), compared with the control group. CG-PHB has the largest surface hydrophobicity among the PHb, G-PHb and CG-PHB. When the concentration of the solution was increased to 1.60 g·mL-1, the oxidation resistance was enhanced to 93.60%. Compared with the PHb and G-PHb, the UV absorption peak of CG-PHb has a wider peak shape, a larger peak and a slight red shift. The fluorescence peak intensity is CG-PHb>PHb>G-PHb. The secondary structure of CG-PHb was changed. Its β-sheet content increased significantly ( p<0.05), but the content of α-helix, β-turn and irregular curl decreased ( p<0.05). In addition, the scanning electron microscope showed that the protein structure changed due to the embedding of glycosyl groups and the interaction between glycosyl groups and catechins. It leads to the increase of the surface pore structure of CG-PHB. It is conducive to the exertion of its functional characteristics. This study can provide new ideas for protein modification research and provide a theoretical basis and reference for the property changes of the compound during food processing.
猪血是畜产品屠宰加工处理过程中的主要副产物之一, 营养物质丰富。 猪血红蛋白(porcine hemoglobin, PHb)作为血液中的一种优质蛋白质组分, 具有优良的特性, 常被应用于食品工业、 生物化学以及医药等领域, 可以改善或赋予食品在制备、 处理及保藏环节过程中的品质[1]。 据报道, 血红蛋白可以用作乳化剂使用, 当添加到火腿、 灌肠等肉糜食品中时, 能够起到改善食品的质构、 外观及保质期等作用[2]。 但PHb因具有较重的血腥味, 较大的黏度, 且蛋白质的性质易受外界条件的影响而变得不稳定, 导致蛋白质发生变性, 从而影响蛋白质的功能特性, 致使其在食品中的加工和应用方面受到一定限制。
在食品工业中, 蛋白质的糖基化修饰由于其温和、 安全的特点成为一种有前景的蛋白质修饰方法[3]。 糖基化处理能够使蛋白质的一些物理或化学性质得到改善, 如对于外界条件变化的稳定性, 防止蛋白质变性或相互聚集。 刘骞等[4]的研究表明猪血浆蛋白肽经糖基化处理后, 其乳化活性、 溶解特性以及起泡性能等都有了较为显著的改善。 Zhan等[5]研究表明猪血红蛋白经壳聚糖糖基化处理后, 可以使猪血红蛋白结构稳定, 抗氧化和补铁作用增强。 由此可见, 糖基化处理是提高蛋白质稳定性及功能特性的一种手段。
氧化作用是蛋白质发生变性的一个重要因素, 不仅能使蛋白质的结构遭到破坏, 甚至还会影响和改变其功能特性, 从而致使产品的风味、 色泽以及质地等品质发生改变, 威胁人体健康。 多酚类物质能够有效清除自由基, 降低蛋白质氧化程度, 且因其为天然物质, 具有安全、 高效的特点而受到大量食品研究相关人员的关注[6]。 有研究表明, 蛋白质与多酚的复合是修饰蛋白质功能的有效途径, 蛋白质与多酚之间的相互作用可以改善蛋白质的功能特性[7]。 黄子林等[8]研究发现在碱性条件下核桃衣多酚与核桃蛋白、 小麦面筋蛋白和芝麻蛋白等相互作用, 能够有效提升蛋白质的溶解性和抗氧化性。 张春雪等[9]研究了白藜芦醇、 没食子酸以及儿茶素等多酚类物质与核桃蛋白之间的相互作用, 结果表明多酚类物质可显著改善核桃蛋白的起泡性能以及热稳定性等。
目前多以单一的糖基化改性或儿茶素与蛋白质复合的研究居多, 然而关于糖基化处理与儿茶素结合改性蛋白质的研究却少有报道。 本文选用葡萄糖对PHb进行糖基化修饰, 再与儿茶素复合制备复合物(catechin complex glycosylated porcine hemoglobin, CG-PHb), 探究CG-PHb特性及结构的变化, 以期为蛋白质改性的研究提供新思路, 为复合物在食品加工过程中的性质变化提供理论基础及参考。
PHb(BR), 含量(以N计): ≥ 15.0%, 购买自南京都莱生物技术有限公司; 葡萄糖(分析纯, AR), 天津市科密欧化学试剂有限公司生产; 儿茶素(纯度: ≥ 98.0%), 由合肥博美生物科技有限责任公司提供。
UV-2600型紫外可见分光光度计, 日本日立公司; Cary eclpise荧光分光光度计, 美国Aglient Cary elipse公司; VERTEX70型傅里叶红外光谱仪, 德国Bruker公司; EM-30Plus型电子扫描显微镜, 日本岛津公司。
1.3.1 糖基化猪血红蛋白(G-PHb)的制备
将PHb溶于适量蒸馏水中配制成3 mg· mL-1的蛋白质溶液, 按质量比1∶ 3的比例加入葡萄糖均匀混合, 调pH至8.0左右, 在70℃条件下水浴加热2 h, 取出后立即冰浴, 于4 ℃透析24 h, 冷冻干燥即为糖基化猪血红蛋白(glycosylated porcine hemoglobin, G-PHb)。
1.3.2 CG-PHb的制备
将0.05 g的儿茶素与G-PHb溶于去离子水中, 按比例1∶ 1混合, 并将混合物溶液在室温条件下放置于磁力搅拌器上以500 r· min-1的转速搅拌3 h, 然后于4℃透析24 h。 冷冻干燥48 h, 制得复合物微粒。
1.3.3 CG-PHb的功能特性测定
1.3.3.1 溶解度的测定
参照Nishimura等[10]的方法, 采用双缩脲法并稍作修改。 将PHb、 G-PHb和CG-PHb溶于去离子水中, 配制成1.5 mg· mL-1的溶液。 计算上清液中的蛋白质含量以及总蛋白质的含量, 其比值表示溶解度的大小。
1.3.3.2 浊度的测定
参照Sabow等[11]的方法并稍作修改, 对溶液浊度进行测定。 将PHb、 G-PHb和CG-PHb用pH 8.2的Tris-HCl缓冲液稀释到2.5 mg· mL-1, 用漩涡振荡器混合均匀2 min, 使其充分溶解, 30 min后于340 nm处比色, 测吸光度。
1.3.3.3 乳化性能的测定
根据Wang等[12]的方法略作修改。 分别取2.5 mg· mL-1的PHb、 G-PHb和CG-PHb溶液与大豆油(V/V为3∶ 1)均匀混合, 在10 000 r· min-1条件下均质2 min, 制得新鲜乳化液, 于500 nm处比色, 测定其乳化活性。
1.3.3.4 表面疏水性的测定
采用溴酚蓝法测定PHb、 G-PHb和CG-PHb的表面疏水性, 于595 nm波长处比色, 表面疏水性以溴酚蓝结合量来表示。
1.3.3.5 DPPH自由基清除能力的测定
分别移取200 μ L浓度为0.1、 0.2、 0.8、 1.2、 1.6 mg· mL-1的PHb、 G-PHb和CG-PHb与等体积的DPPH-乙醇(浓度为0.1 mmol· L-1)至酶标板(96孔)中, 黑暗条件下静置30 min, 于517 nm处比色。
式中: A0为200 μ L DPPH-乙醇+200 μ L水, 将A0中的200 μ L水替换为200 μ L样品测得A1; 将A1中的200 μ L DPPH-乙醇替换为200 μ L无水乙醇测得A2。
1.3.4 CG-PHb的结构测定
1.3.4.1 紫外-可见光谱
在250~600 nm范围内对0.5 mg· mL-1的PHb、 G-PHb以及制备的CG-PHb溶液进行紫外可见光谱扫描, 扫描间隔为5 nm。
1.3.4.2 荧光光谱
分别测定PHb、 G-PHb和CG-PHb在激发波长(280 nm), 激发和发射狭缝(10 nm), 扫描范围(300~400 nm)条件下的荧光光谱。
1.3.4.3 傅里叶变换红外光谱(FTIR)
将PHb、 G-PHb和CG-PHb分别与干燥后的溴化钾粉末按照1∶ 100(W/W)混匀研细后进行压片, 然后进行红外扫描分析。 用Peak Fit v4.12软件分析PHb、 G-PHb和CG-PHb酰胺I带处的蛋白质二级结构相对含量变化。
1.3.4.4 扫描电子显微镜(SEM)
分别取微量PHb、 G-PHb和CG-PHb置于样品台的导电胶上, 喷10 nm厚度的金。 通过扫描电子显微镜进行样品微观结构观察。
采用Origin 9.0软件对测得的数据进行处理及作图。 通过SPSS软件对数据进行分析, p< 0.05为差异显著。 每次试验均重复3次。
表1为PHb、 G-PHb和CG-PHb的功能特性测定结果。 由表1可以看出, CG-PHb相较于PHb溶解度升高了2.86%(p< 0.05), 但相较于G-PHb溶解度降低了3.75%(p< 0.05), 分析认为可能是G-PHb与儿茶素分子之间形成氢键, 疏水作用增大造成的。 粒子粒径的大小、 溶液颜色的深浅都能影响浊度的大小, 溶液中颗粒越大、 数量越多、 颜色越深, 浊度越大, 样品溶液浊度的大小为: CG-PHb< G-PHb< PHb。 蛋白质的乳化活性是衡量其形成水包油型乳状液能力大小的一个指标, 与蛋白质的结构及与水的亲和力有关[13]。 CG-PHb不论在乳化性还是乳化稳定性方面都明显高于PHb和G-PHb(p< 0.05), 这是因为糖链的加入使得蛋白质溶液黏性及在水油表面的吸附层厚度增加, 与儿茶素复合后, CG-PHb的空间结构遭到破坏, 大量疏水基团暴露出来, 使溶液与油结合的面积增大、 能力提高。 另外, 通过下文对PHb、 G-PHb和CG-PHb的二级结构相对含量分析, 可以得出CG-PHb的β -折叠含量显著增加, 潘成磊等[14]研究发现, 溶液乳化活性及稳定性的提高与猪肝水溶性蛋白中的β -折叠含量增加有关, 与本文的研究结果一致。
| 表1 不同处理方式PHb功能特性的变化 Table 1 PHb functional characteristics of different treatment methods |
表面疏水性可以反映出蛋白质分子的变性程度和暴露在极性溶液中的疏水性氨基酸数量, PHb、 G-PHb和CG-PHb的表面疏水性变化情况如图1所示。
由图1可知, 经过糖基化处理和糖基化后与儿茶素复合的PHb表面疏水性显著提高(p< 0.05), 其中CG-PHb的表面疏水性最高, 为156.69%, 相较于PHb和G-PHb的表面疏水性分别增大了77.83%和50.03%(p< 0.05)。 这表明CG-PHb经糖基化反应后, 蛋白质内部折叠的结构舒展开来, 致使隐藏的疏水基团暴露增多[15]。 当添加儿茶素时, 蛋白质氨基酸的侧链通过氢键等各种弱作用力与儿茶素的芳香环之间形成了相互作用, 蛋白质结构发生了改变, 一定程度上促进了蛋白质结构展开, 分子表面的疏水性残基暴露量升高, 从而使CG-PHb的表面疏水性增大[16]。
DPPH清除率可以衡量一种物质在体外抗氧化能力的大小。 PHb、 G-PHb以及制备的CG-PHb的DPPH自由基清除能力变化如图2所示。
DPPH自由基由于其具有较高的稳定性, 而广泛地用其清除能力作为衡量物质对不稳定H原子转移为自由基的抗氧化能力大小的指标。 517 nm处的吸光度变化可以用于评价物质的自由基清除率, DPPH自由基可以与环境中的抗氧化剂所提供的氢供体反应, 使其在517 nm处的吸光度变小[17]。 由图2可知, 经过糖基化处理和糖基化后与儿茶素复合的PHb的DPPH自由基清除能力明显提高(p< 0.05), 其抗氧化活性顺序为CG-PHb> PHb> G-PHb, 存在显著性差异(p< 0.05)。 随着浓度的增加, 三者的DPPH自由基清除能力都在不断增加, PHb、 G-PHb和CG-PHb的DPPH自由基清除率在溶液浓度为1.60 mg· mL-1时达到最高, 分别为69.41%、 46.55%和93.60%(p< 0.05)。 与PHb、 G-PHb相比, CG-PHb具有更高的DPPH清除率, 分析认为儿茶素中的多个酚羟基被氧化, 形成相应的O-醌类, 可以提供氢原子与DPPH自由基结合, 形成稳定DPPH-H分子以清除DPPH自由基[18]。
紫外-可见光谱可通过峰强度及峰位的变化来反映蛋白质的结构变化。
由图3可知, 蛋白质在280nm处紫外吸收高低顺序依次为: CG-PHb> PHb> G-PHb。 糖基化改性后, G-PHb在280 nm处的吸收峰明显降低, 且发生蓝移, 400 nm波长附近的吸收峰降低, 这表明蛋白质大分子中的疏水氨基酸残基所处的微环境被改变, 色氨酸、 酪氨酸等生色基团残基暴露出来, 造成G-PHb的紫外吸收减弱, 蛋白质内部展开的多肽链与葡萄糖之间形成共轭键, 致使其电子轨道能级升高, 所带的杂环π → π * 发生电子跃迁所需能量变大, 导致吸收带蓝移。 这与张玥等人的研究结果一致[19]。 与儿茶素复合后, CG-PHb的紫外吸收光谱峰值增大、 峰形变宽, 最大吸收峰波长从288.5 nm红移至292 nm, 说明CG-PHb的构象发生了改变。 分析认为由于G-PHb与儿茶素形成了复合物, 两者之间相互作用, 致使蛋白质结构更加舒展, 有助于蛋白质释放出分子内部的发色基团残基中的芳香杂环, 进而使其紫外吸收强度增加。 结合位点附近发色基团所处微环境发生变化, 由极性向非极性转变, 表面疏水性增大, 王启明等研究结果也证实了这一点[20]。
蛋白质中色氨酸等发色团结构与自身所处微环境的极性变化联系紧密, PHb、 G-PHb和CG-PHb的内部结构变化可通过考察其荧光强度的变化来研究。
由图4可知, PHb、 G-PHb以及CG-PHb的荧光峰对应的λ max分别为310.21、 316.65和343.14 nm, 发生红移现象, 且荧光强度大小为CG-PHb> PHb> G-PHb。 发射峰发生位移的原因可能是由于糖基化处理后与儿茶素复合, 从而使血红蛋白分子的空间构象产生改变。 相较于未经改性的PHb, G-PHb的荧光强度明显减弱, 这可能是由于葡萄糖吸附在PHb的表面, 糖链在色氨酸残基附近形成结合位点, 导致PHb中的色氨酸荧光被屏蔽而展现受阻。 Spotti等[21]的研究结果表明乳清蛋白与葡聚糖共价复合后, 其复合物中的发色基团残基也容易被周围区域的糖链所屏蔽, 这与本文研究结果相一致。 与儿茶素复合后, CG-PHb的荧光强度增大, 分析认为儿茶素的加入使得蛋白质的结构遭到破坏, 结构变得更加松散, 大量色氨酸暴露在溶剂中导致的。
 | 图4 不同处理方式的蛋白样品的荧光光谱分析Fig.4 Fluorescence spectrum analysis of protein samples with different treatment methods |
儿茶素在与G-PHb的结合过程中降低了蛋白质分子中发射荧光物质的量子产率, 使得其荧光强度降低, 产生荧光猝灭现象。 图5显示了不同质量浓度的儿茶素与G-PHb结合的荧光光谱图。 由图5可知, 随着儿茶素浓度的增加, G-PHb在318 nm波长处的荧光强度逐渐降低, 发生荧光猝灭, 且荧光猝灭效果呈现增强趋势, 并发生红移现象。 这表明儿茶素与G-PHb之间产生了相互作用, 可能是由于G-PHb与儿茶素之间发生荧光猝灭, 蛋白质分子结构舒展, 同时儿茶素的芳香环可与G-PHb的酪氨酸残基结合, 芳香族氨基酸残基微环境的疏水性降低, 致使G-PHb的内源荧光猝灭, 在这种相互作用的促进下形成了荧光强度较低的复合物, 具体的结合特点及结合形式等作用机理将在后续试验中进一步研究。
FTIR光谱通常用于表征化学键和官能团, 因此可以根据红外光谱图分析PHb、 G-PHb和CG-PHb的结构变化。
由图6可知, 经过不同处理后, 其酰胺Ⅰ 带(1 600~1 700 cm-1)发生较为明显的改变, 其变化主要归因于C=O拉伸振动, N— H的弯曲和C— H的拉伸振动, 酰胺Ⅰ 带吸收峰向低频方向移动, PHb、 G-PHb以及制备的CG-PHb在3 500~3 000 cm-1位置的峰强度差异较大。 这可能是蛋白质分子与葡萄糖共轭结合或是G-PHb与儿茶素相互作用, 分子间缔合形成氢键, 导致吸收强度增大, 进一步表明形成了复合物。
一般而言, α -螺旋和β -折叠都是依靠氢键维持, 通过不同的处理方法可能会改变蛋白质分子链中氢键的生成或断裂, 从而会改变α -螺旋和β -折叠的相对含量。 基于PHb的FTIR光谱, 在酰胺Ⅰ 带(1 600~1 700 cm-1)区域分析改性对蛋白质的二级结构影响, 样品红外光谱拟合的二级结构含量如表2所示。
| 表2 不同处理方式下PHb酰胺Ⅰ 带二级结构相对含量 Table 2 PHb amide Ⅰ band secondary structure relative content under different treatment |
由表2可知, CG-PHb的二级结构发生明显变化, 其中β -折叠含量显著增加, β -折叠的形成多与分子间氢键的作用相关。 相比于PHb和G-PHb, 分别增加了37.97%和35.48%(p< 0.05), 分析认为儿茶素酚羟基与蛋白质肽羰基之间形成了氢键, 说明儿茶素与G-PHb的结合方式主要是分子间的氢键作用力。 无规卷曲等其他结构含量显著减少(p< 0.05), 说明蛋白质结构的随机性减弱, 复合物的结构更加稳定。 Li等[22]研究结果表明, 花青素与水稻蛋白相互作用改变了其二级结构, 致使其β -折叠的含量增加, 这与本研究结果一致。
蛋白质的微观结构在一定程度上反映了其所持有的功能性质, 对PHb、 G-PHb和制备的CG-PHb进行扫描电镜分析, 结果见图7(a, b, c)。
 | 图7 不同处理方式下PHb的SEM图(× 500倍) (a): PHb; (b): G-PHb; (c): CG-PHbFig.7 SEM of PHb under different treatment methods (× 500) (a): PHb; (b): G-PHb; (c): CG-PHb |
由图7可知, 冷冻干燥后的PHb表面呈光滑均匀的片状结构, 添加葡萄糖进行糖基化反应后, 明显改变了其表面的微观结构, 接枝物的分子间发生大量的结合聚集现象, G-PHb呈枝状, 结构疏松、 有序, 分布均匀, 无明显的刚性结构, 与宋永令等[23]的研究结果一致。 糖基化后的PHb与儿茶素结合后, 蛋白质表面孔洞结构增加, 蛋白质空隙增大, 进而有利于糖链嵌入其中, 有利于其功能特性的发挥, 与前文的研究结果一致。
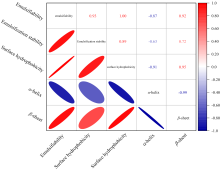
PHb、 G-PHb和CG-PHb的功能特性与其自身内部的结构变化紧密相关。 由图8可知, PHb、 G-PHb和CG-PHb的乳化性及表面疏水性与α -螺旋结构的相对含量呈负相关, 与β -折叠结构的相关含量呈正相关, 相关系数分别为-0.87、 -0.91和0.92、 0.95, 说明样品中β -折叠结构含量越多, 样品溶液的乳化性及表面疏水性越强。 且乳化性与表面疏水性之间也存在较为明显的、 相关系数为1的正相关关系, 说明样品溶液的乳化性随表面疏水性的增强而增大。
对PHb、 G-PHb以及CG-PHb的功能特性及结构进行了测定。 研究发现, 糖基化处理及与儿茶素复合后制备的CG-PHb在溶解度、 浊度和乳化性能等方面均呈现显著的优势(p< 0.05), 表面疏水性相较于PHb和G-PHb分别增大了77.83%和50.03%(p< 0.05), 抗氧化性随着溶液浓度的升高不断增大, 溶液浓度为1.60 g· mL-1时, 抗氧化性最高达93.60%; 蛋白质的二级结构发生了明显的变化, 其中β -折叠相对含量显著增加, 而α -螺旋、 无规卷曲和β -转角相对含量减少(p< 0.05), 蛋白质表面孔洞结构增加, 有利于糖链的嵌入而使其功能特性更好地发挥。 因此, 糖基化及与儿茶素复合处理可以有效改善PHb的功能特性, 使其更好地应用于食品工业中。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|