作者简介: 郭贺媛熙, 女, 1997年生, 广西科技大学生物与化学工程学院硕士研究生 e-mail: 1448567030@qq.com
氯霉素(CAP)是一种人工合成的抗生素, 通过与细菌的核糖体进行结合而抑制蛋白质合成达到抑菌目的。 长期摄入残留CAP动源性食品会导致人体发生贫血及白血病, 也会使机体产生耐药性严重危害人类健康, 许多国家规定不得在畜产品中检出CAP, 因此, 设计一种更快速简便且高特异性的CAP检测方法具有重要意义。 以CAP的巯基化适配体(SH-Apt)修饰银纳米棒阵列芯片(芯片)作SERS基底、 以DNA杂交指示剂亚甲基蓝(MB)作为拉曼信号分子, 利用CAP、 CAP适配体互补链(cDNA)与CAP适配体(Apt)竞争结合的关系, 构建了一种新型的高特异性CAP-SERS适配体传感器。 利用扫描电子显微镜(SEM)、 X射线衍射(XRD)及EDS能谱仪对芯片及CAP-SERS适配体传感器进行表征, 结果表明芯片表面均匀分布大量银元素且证明CAP-SERS适配体传感器成功制备。 在室温条件下对CAP标准样进行检测, 传感器相关性能的考察结果表明, 在0.001~10 ng·mL-1范围之间, CAP浓度的对数值(log c)与1 624 cm-1处的SERS信号强度( ISERS)存在良好的线性关系: ISERS=-971log c+1 983( R2=0.991)。 拉曼增强因子 EF=1.01×107, 检测限为0.2 pg·mL-1( S/N=3), 进一步表明该基底具有良好的拉曼增强效果。 应用该传感器分别检测CAP片剂、 人血清及猪血清中的CAP, 并进行加标试验, 结果令人满意, 回收率在91.2%~120.5%之间, RSD( n=3)在0.97%~8.1%之间, 证明该传感器有良好的准确性。 该传感器具有制作简单、 灵敏度高、 选择性强、 重现性和稳定性好以及检测速度快等优点, 可望应用于实际样品中CAP的快速定量检测, 为检测CAP提供了一种新思路。
Chloramphenicol (CAP) is a synthetic antibiotic that inhibits protein synthesis by binding to the ribosomes of bacteria to achieve the purpose of antibacterial. Long-term intake of residual CAP animal-derived food can lead to anemia and leukemia in the human body and can also cause the body to develop drug resistance, which will seriously endanger human health. Many countries have regulations prohibiting the detection of CAP in livestock products. Therefore, designing a more rapid, simple and highly specific CAP detection method is of great significance. In this paper, the thiolated aptamer of CAP (SH-Apt) was used to modify the silver nanorod array chip(chip)as the SERS substrate, and the DNA hybridization indicator methylene blue (MB) as the Raman reporter, A novel high-specificity CAP-SERS aptamer sensor was constructed by utilizing the competitive binding relationship between CAP, CAP aptamer complementary strand (cDNA) and CAP aptamer (Apt). The chip and CAP-SERS aptamer sensor were characterized by scanning electron microscopy (SEM), X-ray diffraction (XRD) and EDS spectroscopy. The results showed that a large amount of silver elements were uniformly distributed on the surface of the chip and the CAP-SERS aptamer sensor was successfully prepared. Detection of CAP standards at room temperature, the results of the sensor-related performance analysis suggest that, with an increase of CAP concentration (0.001~10 ng·mL-1) caused the decreased SERS signal at 1 624 cm-1( ISERS) intensity ( ISERS=-971log c+1 983). A good negative correlation ( R2=0.991) was achieved, and the limit of detection (LOD) was as low as 0.2 pg·mL-1 ( S/N=3), the Raman enhancement factor EF=1.01×107. Further indicating that the substrate has good Raman enhancement. The sensor is used to detect individual CAP tablets and CAP in human and pig sera, spik experiments were performed, and the results were satisfactory. The recovery and relative standard deviations(RSD) were 91.2%~120.5% and 0.97%~8.1%, which proved that the sensor had good accuracy. The sensor is intended to be used for the rapid quantitative detection of CAP in real samples because of its simple manufacture, high sensitivity, strong selectivity, good reproducibility, good stability, and fast detection speed. It provides a new idea for detecting CAP.
氯霉素(chloramphenicol, CAP)属于抑菌性抗生素, 长期微量摄入CAP, 会使肠道正常菌群失调, 还会引起多种疾病, 对人体健康造成危害[1]。 因此, 许多国家禁止或严格监管使用CAP[2], 欧盟规定动物源食品中CAP不得检出[3]。 因此, 对CAP残留的检测至关重要。 目前, 有关CAP的检测方法主要有红外吸收光谱法、 色谱法、 质谱法等[4, 5, 6, 7], 这些方法虽然具有较好的准确性, 但仍然存在一些不足。 因此, 发展快速、 灵敏、 准确的CAP检测方法具有重要的实际意义。
近年来, SERS检测技术因具有高灵敏度[8, 9]、 抗水干扰、 无损、 响应快、 指纹识别和样品消耗量少等优势[10, 11, 12, 13], 在药物分析、 生物医学检验等领域的应用受到关注[14, 15, 16, 17]。 核酸适配体作为DNA或RNA单链片段, 具有靶分子范围广、 特异性高、 可化学合成、 易于修饰等特点, 在分析化学、 生物传感器、 医学诊断等方面得到广泛应用。
DNA杂交指示剂亚甲基蓝(MB)属于吩噻嗪类染料[18, 19, 20], 通常以嵌插键合或沟槽键合方式与双链DNA定量结合[21, 22, 23], 据此可构建电化学或荧光生物传感器[24, 25, 26]。 MB具有拉曼活性, 可作为拉曼信号分子[27], 因此, 以MB作为拉曼信号分子, 结合SERS检测技术, 可发展SERS-生物传感器, 但到目前为止, 尚未见有相关的报道。
本工作尝试利用以SH-Apt修饰芯片作SERS基底、 以MB为DNA杂交指示剂和拉曼信号分子, 基于CAP、 cDNA与Apt的竞争关系, 构建一种新型的CAP-SERS适配体生物传感器, 以SEM、 EDS、 XRD和SERS等对芯片、 SERS基底及适配体传感器分别进行表征, 并考察传感器的相关性能, 结果发现该新型的CAP-SERS适配体传感器具有制备简单、 检测快速、 灵敏、 特异性强等优点, 可望应用于CAP的快速、 灵敏检测。
共聚焦拉曼光谱仪(XploRAPLUS Raman Microscope, HORIBA, Japan), X射线衍射(XRD, Bruker D8A A25 X, Germany), 冷场发射扫描电镜显微镜(SEM, S4800, Japan), EDS能谱仪(50max, 英国牛津仪器)。
银纳米棒阵列芯片(尺寸: 50 mm× 50 mm, 由广西三环高科拉曼芯片技术有限公司生产, 通过银原子蒸汽在洁净的玻璃片上沉积形成银纳米棒阵列结构)。
巯基化的氯霉素适配体(SH-Apt)(GAT GGT GGC TGA GCG GCT GGC ACC CTG TTG AGT GAC TTCA-SH C6)、 cDNA(CTA CCA CCG ACTCGC)(生工生物工程(中国上海)股份有限公司), 氯霉素(CAP)标准品(源叶生物), 氯霉素(CAP)片剂(成都锦华药业有限责任公司), 阿奇霉素(AZM)(上海安谱实验科技股份有限公司), 土霉素(OTC)、 克林霉素(CLI)、 左氧氟沙星(LEVO)(均购于阿拉丁试剂), MB(≥ 98.5%, 成都市科隆化学品有限公司), 人体血清、 猪血清(上海晶杭生物), 除非特别说明, 实验室所用试剂均为分析纯。
1.2.1 CAP传感器的制备
在芯片上滴加1.5 μ L SH-Apt溶液后, 再滴加1.5 μ L cDNA 溶液, 室温下孵育6 h。 此时SH-Apt与cDNA杂交形成双链DNA(dsDNA), 并通过Ag— S键修饰在Ag基芯片上; 然后再滴加3 μ L 1× 10-5 mol· L-1的MB, 自然晾干后, 用PBS缓冲液洗涤3次去除游离的MB, 得到CAP的SERS适配体传感器。
1.2.2 MB溶液的浓度和用量的优化
取3 μ L系列浓度(5× 10-5、 1× 10-5、 5× 10-6、 1× 10-6、 5× 10-7 mol· L-1)的MB溶液分别滴加到SERS适配体传感器的芯片上, 自然晾干后用PBS缓冲液洗涤三次, 采集其拉曼光谱。 取一系列体积1× 10-5 mol· L-1的MB溶液(1、 2、 3、 4和5 μ L), 分别滴加到SERS适配体传感器的芯片上, 自然晾干后用PBS缓冲液洗涤三次去除游离的MB, 再分别滴加3 μ L 1 ng· mL-1 的CAP标准液, 室温下孵育3 h, 用PBS缓冲液充分洗涤, 自然晾干后, 采集其拉曼光谱。
1.2.3 检测方法及步骤
在CAP-SERS适配体传感器的芯片上滴加3 μ L的待测CAP样液, 室温下反应3 h, 用PBS缓冲液充分洗涤后自然晾干, 采集其拉曼光谱。 仪器参数: Grating 600 gr· mm-1, 波长638 nm, 功率37.5 mW, 积分时间10 s, Filter: 1%。 检测步骤如图1所示。
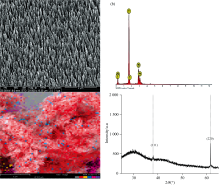
用SEM、 EDS、 XRD对芯片进行表征, 结果如图2所示。 由芯片的SEM图2(a)可知, 芯片呈纳米棒阵列结构。 由芯片的EDS图2(b)可知, 纳米棒的主要组成元素为银。 元素分布如图2(c)所示, 红色表示银元素, 可看出芯片上分布大量的银元素, 且分布比较均匀。 由XRD图2(d)可知, 衍射峰出现在38.2° 和64.5° 处, 分别对应Ag的(111)和(220)晶面[28]。
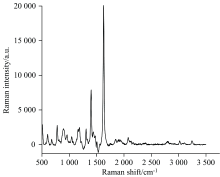
取3 μ L 1× 10-5 mol· L-1 MB滴于芯片上, 其拉曼光谱检测结果如图3所示。 由图3可知, MB特征峰在1 624 cm-1处[29], 峰强为17 820。 将3 μ L的1 mol· L-1的MB滴于玻璃片上。 采用式(1)计算增强因子(EF)[30]
$EF=\frac{\ \ \ \ \ \ {{I}_{\text{SERS}}}\ \ \ \ }{\ \ \ \ {{I}_{\text{bare}}}\ \ \ \ }\times \frac{{{c}_{\text{bare}}}}{\ \ \ \ \ {{c}_{\text{SERS}}}\ \ \ \ }$(1)
式(1)中, ISERS为基底材料上MB拉曼强度, Ibare为裸玻片上MB拉曼强度, cSERS为基底材料上MB浓度, cbare为裸玻片上MB浓度。 cSERS=1.0× 10-7 mol· L-1, ISERS=587; cbare=1.0 mol· L-1, Ibare=577。 计算得EF=1.01× 107, 检测限为0.2 pg· mL-1(S/N=3)。
2.3.1 传感器的EDS表征
为考察SERS传感器是否制备成功, 进行EDS表征, 图4(a)为芯片的EDS能谱图; 图中Si元素来自于芯片基底-玻璃片, Ag元素来自银纳米棒, 还有少量的C元素, 可能源于芯片基底的部分杂质。 图4(b)为芯片修饰双链后的EDS能谱图, 与图4(a)相比, 图4(b)中出现了N、 P、 O等元素, 并O元素峰高明显增大, 这些元素源于DNA中的脱氧核糖核、 碱基及磷酸基, 证明杂交后的dsDNA成功的修饰到了芯片上。
 | 图4 传感器的EDS表征 (a): 芯片的EDS; (b): 芯片修饰DNA双链后的EDSFig.4 Sensor performance characterization (a): EDS of the chip; (b): EDS of the chip modified with the DNA double strand |
2.3.2 传感器的SERS表征
按1.2.3节中的检测方法, 检测滴加1.0 ng· mL-1的CAP溶液前后的SERS强度变化, 结果如图5所示。 由图5(a)和(b)对比可知, 滴加CAP溶液后拉曼峰的强度明显下降, 可见传感器对CAP响应灵敏, 进一步证明传感器的制备成功。
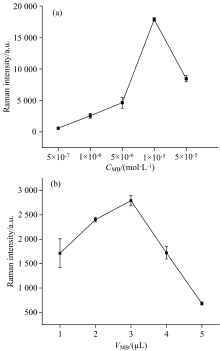
对MB的浓度和体积进行优化, 结果如图6所示。 图6(a)为MB浓度对拉曼峰的影响, 由图6(a)可知, 当MB浓度为1× 10-5 mol· L-1时, 1 624 cm-1处的拉曼峰最高; 图6(b)为MB溶液用量对拉曼峰的影响, 由图6(b)可知, 当加入3 μ L MB溶液时, 拉曼峰最高。 这是因为小分子与dsDNA作用主要有嵌插键合、 沟槽键合和静电键合3种方式, 嵌插键合、 沟槽键合发生在DNA双螺旋的内部, 静电键合则发生在DNA沟槽的外部[31]。 MB浓度较高时易形成多聚体[32], 不利于MB分子以嵌插方式堆积到DNA的沟槽内。 因此, MB溶液浓度大于 1× 10-5 mol· mL-1、 用量超过3 μ L时, 拉曼峰开始降低。 综上, 确定MB溶液浓度为1× 10-5 mol· mL-1、 用量为3 μ L。
按1.2.3节的检测方法对不同浓度(0.001、 0.01、 0.1、 1和10 ng· mL-1)的CAP标准溶液进行检测, 结果如图7所示。 由图7可知, 在0.001~10 ng· mL-1范围内, CAP浓度的对数值logc与峰强ISERS呈现良好的线性关系, 线性拟合方程为: ISERS=-971logc+1 983(R2=0.991)。 由图7中插图可知, 随着CAP浓度的增大, 1 624 cm-1处的峰强ISERS逐渐减小。
重复性试验。 检测0.1 ng· mL-1CAP标准液, 采集同一点拉曼信号15次, 汇总后的拉曼光谱图如图8(a)所示, 其相对标准偏差RSD为7.9%。 对1.0 ng· mL-1 CAP标准液平行测定9次, 结果如图8(b)所示, 其相对标准偏差RSD为6.31%。 由图8俩个实验结果可知, 经过多次激光照射, 拉曼峰强稍微有所下降, 但仍表现出较好的重复性。
均一性试验。 检测0.01 ng· mL-1CAP标准溶液, 采集同一个芯片上9个不同点的拉曼信号, 结果如图9所示, 其RSD为8.02%, 表明该法具有较好的均一性。
选择性试验。 用传感器分别检测3 μ L 1 ng· mL-1土霉素(OTC)、 阿奇霉素(AZM)、 克林霉素(CLI)、 左氧氟沙星(LVFX)、 CAP及PBS缓冲液(空白KB), 1 624 cm-1处的拉曼峰值如图10所示。 由图10可知, 除CAP外, 其他抗生素均表现出与空白样相似结果, 只有CAP的拉曼峰值明显下降, 表明该法具有较好的选择性。
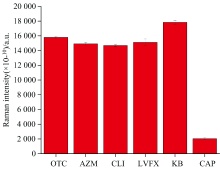 | 图10 CAP传感器测定不同物质的拉曼峰强对比Fig.10 Comparison of Raman peak intensities for different substances measured by CAP sensors |
传感器的稳定性考察。 将制备好的传感器存放1、 5、 10、 20、 30 d, 分别对1 ng· mL-1 CAP标准溶液进行检测, 结果如图11所示。 由图11可知, 随着存放天数的增加, 在20 d之前, 拉曼信号强度未见明显降低; 存放30 d时, 拉曼信号明显下降, 表明传感器至少在20 d内稳定性良好。
 | 图11 CAP传感器不同储存时间的拉曼峰强对比Fig.11 Comparison of Raman peak intensities of CAP sensors with different storage times |
实际样品的检测及加标试验:
样品1, CAP片剂: 取一片CAP片剂(0.25 g· 片-1)超声30 min使CAP片剂充分溶解于PBS缓冲液中, 取3 μ L CAP片剂溶解液, 用传感器检测其CAP含量。 对CAP片剂溶解液进行加标回收试验, 由表1可知, 回收率在99.3%~109.1%之间, 相对标准偏差RSD(n=3)在0.97%~2.1%之间。
| 表1 CAP在三种实际样品中的加标实验结果(n=3) Table 1 Results of CAP spiking experiments in three real samples (n=3) |
根据CAP片剂溶解液中测得的CAP浓度0.000 76 ng· mL-1, 可知CAP片剂中CAP的含量约为0.25 g· 片-1。
样品2, 人血清样: 以1.0 mL人血清与1.0 mL PBS均匀混合后, 用传感器检测其中CAP含量, 平行检测了3次, 测得人血清样中CAP含量为0。 将1.0 mL人血清分别与1.0 mL(0.1、 1和2 ng· mL-1)CAP标准液混合后, 用传感器检测其CAP含量并进行加标回收试验, 由表1可知, 回收率在99.8%~109%之间, 相对标准偏差RSD(n=3)在1.6%~4.6%之间。
样品3, 猪血清样: 处理方法同样品2, 测得猪血清样中CAP含量为0; 对猪血清样进行加标回收试验, 由表1可知, 回收率在91.2%~120%之间, 相对标准偏差RSD(n=3)在2.2%~8.1%之间。
对3种实际样品中CAP的检测及加标试验结果表明, 传感器具有较好的可靠性, 有望应用于实际样品中CAP的检测。
以SH-Apt修饰芯片作SERS基底、 以MB为拉曼信号分子, 利用CAP、 cDNA与Apt的竞争关系, 成功的构建了一种新型的CAP-SERS适配体传感器。 该传感器具有制作简单、 灵敏度高、 选择性强、 重现性和稳定性好及检测速度快等优点, 应用于3种实际样品中CAP的检测, 并进行加标试验, 结果令人满意, 可望应用于实际样品中CAP的定量检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|