作者简介: 杨 群, 1996年生, 西南大学资源环境学院硕士研究生 e-mail: yangqunldu@163.com
柑橘是我国第一大类水果, 氮素对于柑橘的生长发育至关重要, 实时、 无损地监测柑橘氮素营养状况, 对于氮素养分精准管理具有重要意义。 植株体内的氮素可以分为营养性氮素、 结构性氮素和功能性氮素, 不同形态氮素各组分在柑橘叶片中的含量对叶片生理生化反应有一定的指示作用, 其中, 功能性氮含量是指示柑橘氮营养状况的重要指标。 以“春见”橘橙为试验材料, 分别于果实膨大期和转色期, 利用可见-近红外光谱仪测定不同施氮处理的柑橘叶片反射光谱, 并用化学分析方法测定其叶片功能性氮含量。 分析了柑橘果实膨大期和转色期叶片原始光谱和一阶微分光谱与叶片功能性氮含量的相关关系, 筛选出敏感波段, 利用全波段和敏感波段, 结合光谱植被指数法、 光谱化学计量法和机器学习方法, 构建了柑橘果实膨大期和转色期叶片功能性氮含量的无损监测模型, 并对比分析多种光谱变换和光谱预处理方法对于模型精度的影响。 结果表明, 在柑橘果实膨大期, 对全波段原始光谱进行标准正态化变换预处理, 结合反向传播神经网络构建的柑橘叶片功能性氮含量无损监测模型精度较高, 其建模集决定系数
Citrus is the largest kind of fruit in China. Nitrogen is very important for the growth and development of citrus. Real-time and non-destructive monitoring of the nitrogen status of citrus is of great significance for accurate management of nitrogen nutrients. Nitrogen in plants can be divided into assimilable nitrogen, structural nitrogen and functional nitrogen. The content of each component of different forms of nitrogen in citrus leaves has a certain indicative effect on the physiological and biochemical reactions of leaves. Among them, the content of functional nitrogen is an important indicator of nitrogen nutrition status in citrus. “Chunjian” orange was used as the experimental material in this study. The reflectance spectra of citrus leaves under different nitrogen treatments were measured by the visible-near infrared spectrometer at the fruit swelling period and fruit coloring period, and the functional nitrogen content in leaves was determined by chemical analysis. The correlation between the original spectrum, first-order differential spectrum and the functional nitrogen content of leaves at the fruit swelling and fruit coloring periods of citrus was analyzed, and the sensitive bands were selected. The non-destructive monitoring model of the functional nitrogen content of leaves at the fruit swelling period and fruit coloring period of citrus was constructed by using the full-band and sensitive bands, combined with the spectral vegetation index method, spectral chemical measurement method and machine learning method, and the effects of various spectral variants and spectral preprocessing methods on the accuracy of the model were compared and analyzed. The results showed that the non-destructive monitoring model of functional nitrogen content in citrus leaves constructed by standard normal variate transformation pretreatment of the full-band original spectrum combined with the backpropagation neural network had high accuracy during thefruit swelling period. The calibration set determination coefficient
氮素(N)是柑橘生长发育所必需的大量营养元素, 在其新陈代谢、 生理生化和产量形成等方面有重要作用。 适时适量施氮能提高柑橘产量、 改善柑橘品质。 因此, 需要一套快捷准确的柑橘氮素营养诊断方法用于指导施氮。 植株体内的氮素可以分为营养性氮(assimilable nitrogen, AN)、 结构性氮(structural nitrogen, SN)和功能性氮(functional nitrogen, FN)三大类[1], 三类形态氮素处于动态变化中, 各组分在叶片中的含量与分布对植物叶片生理生化反应有一定的指示作用。 前人对油菜的研究表明: 储存氮中的FN是油菜叶片扩张和维持光合作用的主要氮源[2]。 本研究前期结果表明, 相比于AN和SN, 柑橘叶片中FN含量最高(约为全氮含量的60%), 柑橘果实膨大期和果实转色期时的叶片FN含量与当年果实产量和品质的相关性最高。 因此, 监测柑橘果实膨大期和果实转色期的叶片FN含量, 理论上能更好地表征柑橘氮素营养状况并指导施肥。
随着现代农业的发展, 越来越多的新技术应用于作物氮素营养诊断。 可见-近红外光谱技术作为实时、 无损、 精确的作物营养监测技术已应用于植物叶片或冠层全氮含量的监测, 并取得了良好的结果[3, 4, 5]。 报道有运用萝岗橙叶片反射光谱和支持向量回归建立萝岗橙叶片氮含量的预测模型, 测试集R2为0.97[6]。 可见-近红外光谱通常由数千个光谱变量组成, 其中包含许多非信息量或共线变量。 全波段建模不仅会增加模型的复杂度和计算时间, 还会影响模型的预测能力[7], 故从全波段中选择特征波长以减小可见-近红外光谱数据的维数。 有研究采用相关系数法、 主成分分析等算法选取光谱的特征波长, 建立了基于支持向量机的柑橘叶片氮含量预测模型, 验证集R2高达0.95。 近年来, 可见-近红外光谱技术不断快速发展与完善, 利用可见-近红外光谱拟合作物生化组分含量也开始兴起[8]。
采集柑橘果实膨大期和果实转色期的叶片可见-近红外光谱; 分析了各生育期不同施氮处理下柑橘叶片光谱特征, 通过相关系数法筛选出与叶片功能性氮含量相关性较高的敏感波段; 运用3种双波段植被指数、 偏最小二乘回归和3种机器学习方法构建基于全波段和敏感波段的柑橘叶片功能性氮含量无损监测模型, 并分析了光谱变换和预处理对于构建的柑橘叶片功能性氮含量无损监测模型精度的影响, 以期实现对柑橘叶片功能性氮含量的实时无损监测。
试验地位于重庆市长寿区龙河镇八卦村, 供试柑橘品种为“ 春见” 橘橙[Citrus reticulate × (C.reticulata × C.sinenesis)], 设置4个不同施氮处理, 分别为N0(0 kg N· ha-1)、 N1(83.3 kg N· ha-1)、 N2(166.7 kg N· ha-1, 当地推荐施氮)和N3(333.3 kg N· ha-1, 农户习惯施氮量), 每个处理三组重复, 每组重复4棵树。 氮磷钾分别用尿素(46% N)、 过磷酸钙(12% P2O5)、 硫酸钾(51% K2O)提供。 肥料运筹: 分三次施用, 萌芽肥(3月下旬)、 果实膨大肥(7月下旬)和果实转色肥(10月下旬)。 其中, 萌芽肥施氮50%, 施磷20%, 施钾25%; 果实膨大肥施氮20%, 施磷20%, 施钾50%; 果实转色肥施氮30%, 施磷60%, 施钾25%。 施肥方式穴施, 肥料混匀后覆土。
分别于柑橘果实膨大期和果实转色期采集营养性春梢叶片, 利用美国ASDFieldSpec 4便携式地物光谱仪测定其反射光谱, 该仪器波段值为350~2 500 nm, 其中350~1 000 nm光谱采样间隔为1.4 nm, 光谱分辨率为3 nm; 1 000~2 500 nm光谱采样间隔为2 nm, 光谱分辨率为6.5~8.5 nm。 测定完光谱后, 将叶片迅速装入保鲜袋封口, 放入冰盒带回实验室。 将叶片用纯水洗净, 吸水纸吸干表面水分, 剪碎混匀, 保存于-80 ℃冰箱中备用。
营养性氮(AN)含量测定: 硝态氮使用苏州科铭生物技术有限公司生产的植物硝态氮测试盒测定, 其原理是: 在浓酸条件下, 硝酸根与水杨酸反应, 生成硝基水杨酸, 硝基水杨酸在碱性条件下(pH> 12)呈黄色, 在一定范围内, 其颜色深浅与含量成正比, 可在410 nm波长下测定吸光度, 通过以下公式计算硝态氮含量。
标准曲线: y=0.007 8x+0.007 3, R2=0.999 7
式中, V样总为加入提取液体积, 1 mL; W为样本质量, g。
铵态氮、 氨基酸和酰胺态氮的测定采用改良的茚三酮溶液比色法: α -氨基酸与水合茚三酮溶液一起加热, 经氧化脱氨变成相应的α -酮酸, 酮酸进一步脱羧变成醛, 水合茚三酮则被还原, 在弱酸环境中, 还原型茚三酮、 氨和另一分子水合茚三酮反应, 缩合生成蓝紫色物质。 根据蓝紫色的深浅, 在570 nm波长下测定吸光值。 本实验中在茚三酮试剂中添加乙二醇并补加正丁醇和丙醇, 可以克服茚三酮的不稳定性。 以亮氨酸的氮含量做标准曲线[9]。
结构性氮(SN)含量测定: 称量约0.4 g叶片在液氮下磨碎, 加1 mL磷酸钠缓冲液(Buffer)研磨, 并转移到离心管中, 重复2次。 通过在4 ℃下15 000 g离心15 min, 弃上清液。 将1 mL含3%SDS的磷酸盐缓冲液添加到沉淀中, 然后在90 ℃的水中加热5 min。 将混合物以4 500 g离心10 min。 重复3次, 弃上清液(图1)。 将沉淀用乙醇冲洗几遍, 定量滤纸过滤, 将沉淀和滤纸在50 ℃下烘干, 凯氏法定氮[2]。
全氮(TN)含量测定: 称取烘干磨碎后的叶片干样约0.3 g, 使用凯氏定氮法测定氮含量, 每份样品测定2次, 取其平均值。
功能性氮(FN)含量(g· kg-1)=TN含量(g· kg-1)-AN含量(g· kg-1)-SN含量(g· kg-1)。
建模样品的选择与划分: 利用K-fold方法将整个样本数据随机划分为建模集和验证集两部分, 建模集和验证集分别占总数据集的70%和30%。
光谱数据的预处理与变式: 运用移动平均平滑(窗口宽度为3)、 卷积平滑(平滑点数为3)、 基线校正、 归一化、 多元散射校正、 标准正态化变换等较为常用的几种光谱预处理方法对原始光谱进行预处理, 光谱变换为倒数对数、 一阶微分(导数间隙为5)和二阶微分(导数间隙为5)三种。 对比分析其对建模精度的影响。
敏感波段的筛选: 运用相关系数法和主成分分析法筛选敏感波段。
不同建模方法的选择: 运用植被指数法、 光谱化学计量法和机器学习法。 结合前人设计的减量精细采样法思路, 基于降维思想采用降采样法构建三类植被指数, 即在350~2 500 nm范围内每隔10个波段读取叶片可见-近红外光谱值(波段数据间隔为10 nm), 采用矩阵的形式, 两两组合所有可能波段构建光谱指数, 并与柑橘叶片FN含量进行直线拟合, 计算相应的决定系数R2, 并确定R2最大的波长。 光谱化学计量法选用偏最小二乘回归(partial least squares regression, PLSR)。 运用反向传播神经网络(back-propagation neural networks, BPNN)、 随机森林(random forest, RF)和支持向量机(support vector machine, SVM)三种机器学习方法, 分别探讨其建模精度。
模型评价参数: 决定系数(coefficient of determination, R2)和均方根误差(root mean squared error, RMSE)。 具体计算公式见式(1)和式(2)
${{R}^{2}}=1-\frac{\ \overset{n}{\mathop{\mathop{\sum }_{i=1}}}\ {{(FN{{\text{M}}_{i}}-FN{{\text{P}}_{i}}\ )\ } ^{2}}}{\overset{n}{\mathop{\mathop{\sum }_{i=1}}}\ {{(\text{FN}{{\text{M}}_{i}}-\overline{\text{FNM}}\ )\ } ^{2}}}$(1)
$\text{RMSE}=\sqrt{\frac{\overset{n}{\mathop{\mathop{\sum }_{i=1}}}\, {{(\text{FN}{{\text{M}}_{i}}-\text{FN}{{\text{P}}_{i}}\ )\ }^{2}}}{n}}$ (2)
式(1)和式(2)中, FNMi是第i个叶片FN含量的实测值; FNPi是模型对第i个叶片FN含量的估测值;
使用ViewSpec Pro Version 6.0处理柑橘叶片光谱数据及对光谱进行变换, 叶片不同形态氮含量数据采用Microsoft Office Excel 16和IBM SPSS Statistics 23进行分析处理, 光谱预处理和分析建模在The Unscrambler X 10.4和Python完成。
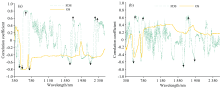
柑橘果实膨大期和转色期不同施氮处理叶片的反射光谱如图2所示。 不同施氮处理下, 柑橘果实膨大期和转色期的叶片反射光谱曲线相似, 在可见光350~700 nm波段区域内, 反射率随着施氮量的增加而降低, 而在近红外700~1 300 nm波段范围内, 反射率则随着施氮量的增加而增加。 在柑橘果实膨大期, 不同施氮处理叶片光谱反射率在550 nm处差异最大, N0、 N1、 N2和N3处理的反射率分别为0.169、 0.166、 0.154和0.128。 在可见光区域, 叶片光谱主要受叶片中色素的影响, 而在近红外区域, 叶片光谱主要受叶片内部组织结构的影响。
对柑橘果实膨大期和转色期叶片FN含量与叶片一阶微分光谱(FDS)和原始光谱(OS)反射率进行相关性分析, 其相关系数见图3。 在柑橘果实膨大期, 叶片FN含量与叶片一阶微分光谱和原始光谱的相关性均较高, 最大相关系数高于0.8; 而在果实转色期, 叶片FN含量与叶片一阶微分光谱最大相关系数低于0.8, 与原始光谱最大相关系数仅为0.5。 柑橘不同生育期叶片FN含量与叶片一阶微分光谱和原始光谱的相关性大小不同, 这与前人研究结果相似, 如报道有小麦抽穗期时的叶片碳氮比与冠层光谱反射率的相关性明显高于小麦拔节期时叶片碳氮比与冠层反射率的相关性。 不同施氮处理下, 梨树花后50 d(膨大Ⅰ 期)的叶片氮含量与叶片光谱反射率的相关性高于花后80 d(膨大Ⅱ 期)的叶片含氮量与叶片光谱反射率的相关性。 如图3中箭头所示, 筛选出与柑橘叶片FN含量相关系数绝对值大于0.6的波段作为敏感波段, 用于后续分析建模。 果实膨大期的敏感波段分别为450、 510、 530、 580、 620、 630、 680、 690、 740、 1 670、 1 740、 2 150、 2 280和2 320 nm; 果实转色期的敏感波段分别为520、 530、 580、 590、 750、 1 670、 1 680、 1 775、 1 795和1 930 nm。
分别将柑橘果实膨大期和转色期的叶片样本数据随机划分为建模集和验证集。 果实膨大期的样本总数为231, 其中建模集样本数为161, 验证集为70; 果实转色期样本总数为179, 建模集样本数为125, 验证集为54。 柑橘果实膨大期和转色期建模集和验证集具体统计数据分别如表1所示。
| 表1 柑橘果实膨大期和转色期建模集和验证集叶片样本功能性氮含量 Table 1 FN contents in citrus leaves used for modeling calibration and validation during fruit swelling period and fruit coloring period |
表2和表3分别为不同建模方法得到的柑橘果实膨大期和转色期叶片FN含量。 在果实膨大期和转色期, 利用双波段(比值、 差值和归一化)植被指数构建的柑橘叶片FN含量无损监测模型精度较低。 果实膨大期时建模集决定系数
| 表2 柑橘果实膨大期时基于全波段和敏感波段的不同建模方法结果 Table 2 Performances of different modeling methods based on whole original spectra and sensitive band during fruit swelling period |
| 表3 柑橘果实转色期时基于全波段和敏感波段的不同建模方法结果 Table 3 Results of different modeling methods based on whole original spectra and sensitive band during fruit coloring period |
应用偏最小二乘回归(PLSR)、 反向传播神经网络(BPNN)、 随机森林(RF)和支持向量机(SVM)构建柑橘果实膨大期和转色期叶片FN含量无损监测模型, 探讨原始光谱全波段和其敏感波段对于柑橘叶片FN含量无损监测模型精度的影响。 在果实膨大期(表2), 利用原始光谱全波段, 结合PLSR、 BPNN、 RF和SVM构建的柑橘叶片FN含量无损监测模型, 其建模集决定系数
分析光谱变换和光谱预处理对柑橘果实膨大期和转色期叶片FN含量无损监测模型精度的影响, 结果如表4所示。 在柑橘果实膨大期, 相比于原始光谱(OS), 对光谱进行倒数对数(RLS)、 一阶微分(FDS)和二阶微分(SDS)处理使各模型精度降低; 移动平均平滑(MAS)和卷积平滑(SGS)预处理对各模型精度几乎没有影响; 对全波段原始光谱进行归一化(Normalize)、 基线校正(Baseline)、 标准正态化变换(SNV)和多元散射校正(MSC)预处理对BPNN模型验证集决定系数(
| 表4 果实膨大期和转色期不同光谱处理的模型结果 Table 4 Model results of different spectral treatments during fruit swelling period and fruit coloring period |
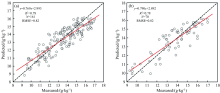 | 图4 果实膨大期SNV预处理后BPNN建模(a)及验证(b)结果Fig.4 Measured vs. predicted FN contents for calibration and validation by the BPNN model using SNV pretreatment during fruit swelling period |
 | 图5 果实膨大期敏感波段原始光谱RF建模(a)及验证(b)结果Fig.5 Measured vs. predicted FN contents for calibration (a) and validation (b) by the RF model based on original spectra during fruit swelling period |
在柑橘果实转色期, 相比于原始光谱(OS), 倒数对数变换光谱(RLS)、 一阶微分光谱(FDS)和二阶微分光谱(SDS)处理使
 | 图6 果实转色期SNV预处理后BPNN建模及验证结果Fig.6 Measured vs. predicted FN contents for calibration (a) and validation (b) by the BPNN model using SNV pretreatment during fruit coloring period |
在柑橘果实膨大期和转色期, 对叶片原始光谱进行SNV预处理, 可使结合BPNN构建的柑橘叶片FN含量无损监测模型预测精度提高。 这与前人在紫薯花青素含量上的研究结果相似, 利用SNV预处理全波段原始光谱, 在一定程度上提高了紫薯花青素含量定量预测模型的精度[12]。 综上所述, 果实膨大期时利用柑橘叶片敏感波段原始光谱或对全波段原始光谱进行SNV预处理构建的叶片FN含量无损监测模型具有较好的精度, 而果实转色期建议对叶片原始光谱进行SNV预处理构建的叶片FN含量的无损模型精度更好。 此外, 前人研究结果表明, 结合不同预处理方法能在一定程度上提高建模精度, 后期应当尝试利用正交设计探讨不同预处理方法相结合对于柑橘叶片功能性氮含量无损监测模型精度的影响[13]。
(1)不同施氮处理下, 柑橘叶片光谱反射率在350~700 nm可见光区域随着施氮量的增加而降低, 在700~1 350 nm近红外区域则随着施氮量的增加而升高。
(2)在柑橘果实膨大期对全波段原始光谱进行标准正态化变换(SNV)预处理, 结合反向传播神经网络(BPNN)构建的柑橘叶片功能性氮含量无损监测模型精度较高, 其建模集决定系数(
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|