作者简介: 何燕萍, 女, 1998年生, 华东师范大学精密光谱科学与技术国家重点实验室硕士研究生 e-mail: 18916915830@163.com
具有长波长荧光发射特性的碳点(CDs)材料由于其在生物领域的广阔应用而受到越来越多的关注。 长波长发射荧光碳点的合成主要基于高温高压的方法, 室温合成的方法和研究还比较少。 采用碱催化的方式, 将氢氧化钠溶液与果糖溶液混合后透析, 无需加热和其他额外的能量输入即可制备出一种蓝绿色发光可调的碳点, 并通过透射电子显微镜、 紫外-可见分光光度计、 稳态荧光光谱仪等光谱技术对合成碳点进行了表征。 进一步采用圆二色分光光度计和皮秒时间相关单光子计数等测量系统对碳点与牛血红蛋白(BHb)之间的相互作用进行了探究。 虽然已有较多应用碳点检测BHb的研究, 但这些研究更注重分析BHb检测的效果, 而对BHb猝灭碳点荧光的机理还缺少较为详细的系统性证明。 测量得到了二者在不同温度下相互作用的Stern-Volmer图像, 以及碳点在BHb加入前后的荧光寿命, 结果表明BHb对碳点荧光的猝灭是一个静态的过程。 并且在该过程中, BHb的α-螺旋含量下降了约3%, 证明了碳点会使蛋白的结构发生改变。 BHb与碳点混合后形成了复合物, 导致碳点的荧光下降。 通过分析干扰样品以及反应时间对检测BHb的影响, 证实了碳点检测BHb具有良好的选择性和稳定性。 另外, 碳点荧光强度下降, 下降比例与BHb浓度成线性关系, 因此可以设计基于碳点荧光猝灭的血红蛋白生物传感器, 用于微量BHb的特异性检测, 所检测的线性范围为0~5 μmol·L-1, 检测限为243 nmol·L-1( S/N=3)。 所合成的碳点还可以实现双波长激发检测, 实验证实在370和425 nm激发下, 碳点的荧光猝灭程度和BHb的浓度之间表现出良好的线性关系, 这为该荧光探针检测BHb提供了更多的应用价值。 由于该碳点的合成手段简便, 操作技术难度低且合成原料容易获得, 该荧光探针对BHb的微量检测在生命科学研究和刑侦领域都具有十分重要的意义。
Fluorescent carbon dots (CDs) with long wavelength emission have attracted increasing attention due to their promising application prospects in biological fields. CDs with long wavelength emission have been synthesized mainly with high temperature and high pressure, while their synthesis at room temperature is relatively rarely studied. In this paper, blue-green luminescent tunable CDs were prepared by alkaline catalysis, and only two steps were required. The fructose and sodium hydroxide solutions were mixed firstly, followed by dialyzing without any additional energy input or external heating. The synthesized CDs were studied by transmission electron microscopy, steady-state fluorescence, and UV-Vis absorption spectroscopy. Moreover, circular dichroic spectrophotometer and picosecond time-correlated single photon counting system was used to analyze the interaction mechanism between CDs and bovine hemoglobin (BHb). Although there have been some studies about the detection of BHb using carbon dots, previous studies mainly focus on the detection of BHb rather than the fluorescence quenching mechanism of carbon dots. Stern-Volmer imagesof the interaction and the influence of BHb on the fluorescence lifetime of CDs have been measured, implying the contribution of static fluorescence quenching. In this process, the content of the α-helical structure of BHb has decreasedby about 3%, demonstrating that the secondary structures of BHb were changed after interacting with CDs. With the addition of BHb, the complexes of BHb and CDs were formed so the fluorescence of CDs decreased. Moreover, the addition of interference samples in the experiment of BHb detection confirmed that the proposed CDs were highly selective, and the variation of reaction times further revealed that the CDs had high stability. It is noticed that, when mixed with BHb, the fluorescence intensity of CDs decreased gradually, and the proportion of decline was linearly related to the concentrations of BHb. Therefore, the biosensors based on CD fluorescence quenching could be established for the specific detection of trace BHb with a linear concentration range from 0 to 5 μmol·L-1 and a detection limit of 243 nmol·L-1 ( S/N=3). The CDs were also excited with different wavelengths at 370 and 425 nm, and the results proved that the fluorescence intensities of CDs had a good linear relationship with the concentrations of BHb for both excitation wavelengths, which might provide more application values for the detection of BHb. Due to its convenient synthesis, simple operation and easy availability, the proposed CD probe is of great significance in life sciences and criminal investigation.
一种新的碳基纳米材料, 荧光碳点(carbon dots, CDs)在这几年引起了大家的广泛关注。 由于其具有高稳定性、 良好的生物相容性、 可调谐的发光波长以及优异的电子特性等[1], 有望成为一种非常有前途的光学纳米探针。 目前已在光催化、 生物医学、 传感和细胞成像等多个领域得到应用[2]。
碳点的合成一般分为两大类。 一类方法主要是通过化学或物理手段将大块碳材料分解为更小的碳材料, 整个过程的核心是碳原子间化学键的断裂, 主要方法有电弧放电和激光烧蚀等。 另外一类方法主要是有机小分子通过热解或碳化最终形成碳点, 合成方法主要包括溶剂热处理法[3]、 常规热分解(碳化、 热解)、 微波辅助热解、 超声波处理以及电化学合成等方法。 这些传统的合成方法在合成过程中通常会涉及到有毒的化学试剂或有机溶剂, 在反应过程中还需要较高的能耗、 复杂的实验装置以及复杂的实验操作等。 从原料的选取、 时间成本以及所需能耗来看, 并不符合绿色化学的要求。 为了达到更低的经济以及环境成本, 开发一种“ 更绿色” 的方法来合成碳点是很有必要的。 本研究将果糖溶液与碱性溶液混合, 将它们在常温下放置一段相对较短的时间后透析即可获得碳点[4]。 与其他合成方法相比, 该合成办法不需要强酸催化剂、 外部加热以及额外的能量输入, 更为简单、 节能以及高效。
目前大多数报道的碳点的荧光发射波长较短[1, 5], 而短波长的光会破坏活细胞以及生物系统, 特别是对于在室温下合成的碳点, 更难达到长波长发射。 因此, 在室温下合成在长波长处发射的碳点具有重要意义, 可以为生物分子检测提供一个更有前景的平台。 而本研究合成的碳点在425 nm波长的光的激发下, 最大发射峰位于535 nm, 为用于生物分子检测的荧光探针研究提供了更多支持。
血红蛋白(hemoglobin, Hb)作为生物体内红细胞的重要组成部分, 主要功能是携带和运输氧气, 调节血液的pH值等[6], 在生命活动中具有十分重要的意义。 观测血红蛋白的含量是否稳定对于生命体的健康评估是十分必要的。 在红细胞中, 血红蛋白约占蛋白质总量的90%, 及时观测Hb含量是否在正常范围内, 可以有效预防白血病、 贫血症和癌症等许多疾病的产生。 若能定量检测生物体内的Hb含量, 将对生命科学研究和临床诊断提供重要的技术支持。 除此之外, 在刑侦领域, 若能对低浓度的血红蛋白进行高效检测, 将具有重要的应用价值。 牛血红蛋白(bovine hemoglobin, BHb)与Hb在结构以及光谱特性上具有极高的相似性。 由于BHb来源获取更为简单, 已被广泛用作HHb的模型物, 应用于各种光谱研究和机理分析[7]。
此前已经有文献报道了几种用于定量检测血红蛋白的分析方法, 例如荧光法[8]、 电化学法和比色法等, 其中基于碳点荧光猝灭的检测方法由于成本低、 检测速度快、 灵敏度高而备受关注, 然而此前的工作对其荧光猝灭的机理研究还不够充分[9]。 2014年Chang等将碳点应用于血红蛋白的检测中, 通过电化学方法以甘氨酸为前体合成了碳点, 但该文章的重点在于如何检测血红蛋白, 并没有过多地分析其猝灭的机制[10]。
本研究通过碱催化的方法合成了碳点, 并用该碳点实现了对微量牛血红蛋白的特异性检测。 该碳点在不同波长激发下, 对BHb的检测都有较好的线性响应, 合成方法也较为简单, 可以更加高效、 便捷地检测血红蛋白。 我们通过紫外可见分光光度计(UV-Vis)、 稳态荧光光谱仪、 透射电子显微镜(TEM)以及皮秒时间相关单光子计数系统(TCSPC)对合成碳点的性质进行了分析, 研究了BHb对碳点荧光的猝灭机制, 计算BHb猝灭碳点荧光的猝灭速率常数, 以及两者之间的结合常数和结合位点数, 并通过圆二色分光光度计(CD)分析BHb在该过程中结构的变化。
使用紫外-可见分光光度计(TU1901)来测量稳态吸收光谱, 探测范围为190~650 nm。 稳态荧光发射光谱通过稳态荧光光谱仪(FluoroMax-4)进行测量, 设置激发波长和发射波长的范围分别为340~425和360~830 nm。
时间分辨荧光光谱在实验室自行搭建的TCSPC系统上测量。 在该系统中, 使用英国Fianium公司的皮秒连续光纤激光器产生中心波长为425 nm, 重复频率为20 MHz的激发脉冲。 通过独立的时间相关单光子计数模块和单光子计数光电倍增管记录荧光。 将二氧化硅纳米颗粒水溶液作为样品对其瑞利散射进行检测, 得到仪器响应函数(IRF)约为200 ps。 有关该系统的更多详细信息, 可参见文献[11]。
碳点的透射电镜图由上海岛津实验器材有限公司的电子显微镜(JEOL2100F)获得。 BHb的CD光谱通过日本JASCO公司的圆二色分光光度计(J-1500)测量, 范围在190~260 nm之间, 测试过程中全程通氮气。
使用的果糖、 牛血红蛋白(分子量约为64 500)、 磷酸氢二钠和磷酸二氢钠二水合物均购买于阿拉丁公司, 氢氧化钠购买于国药集团。 将磷酸氢二钠和磷酸二氢钠二水合物以一定比例混合得到磷酸盐(PB)缓冲液(10 mmol· L-1, pH≈ 7.1), 若无额外提及, 溶剂均为上述缓冲液。
实验合成的碳点以果糖作为前体, 氢氧化钠作为催化剂。 分别将果糖和氢氧化钠溶于去离子水, 制成500 mmol· L-1的溶液作为母液, 将两者以一比一的比例混合, 最终溶液中果糖和氢氧化钠的浓度皆为250 mmol· L-1, 放置一段时间后进行透析即可得到碳点, 该过程仅需将两个溶液混合静置, 无需加热和其他能源输入。 将两个溶液以一比一的比例混合静置一周后, 用截留分子量为500D的透析袋进行透析, 透析24 h后, 将所得水溶性碳点溶液放入冻干机中真空干燥36 h以获得固体碳点粉末, 冻干产率约为4.99%。
分别称取BHb样品以及冻干后的碳点粉末溶于PB缓冲液中, 作为一级储备液, 浓度分别为10 mmol· L-1和0.184 g· mL-1, 并保存在低温(4 ℃)且避光的环境中。 实验时取1.5 mL碳点的一级储备液, 根据所需BHb浓度加入不同体积的BHb一级储备液与之混合, 最后加入适当体积的PB缓冲液使得最后溶液体积保持在3 mL。 若无特别提及, 本文溶液中碳点的浓度为0.092 g· mL-1, BHb的浓度为0~5 μ mol· L-1。
通过对碳点的电镜图像的测量以及对它粒径分布情况的统计(如图1), 结果显示得到的碳点为球状, 且分散性良好。 为了避免碳点聚集从而影响粒径大小的测量, 实验选取了碳点分布较为分散的区域, 测量碳点的粒径大小分布在5.5~11.5 nm之间, 平均粒径大小约为8.2 nm。
 | 图1 碳点的电镜图(a)及其粒径分布图(b)Fig.1 TEM image (a) and associated particle size distribution (b) of CDs. Scale bar is in white |
为了进一步分析碳点晶面间的距离, 我们采取了更高的分辨率, 测量的高分辨电镜图如图2所示, 测得碳点的晶面间距约为0.33 nm, 根据文献报道为石墨的(003)晶面[4]。
通过紫外可见吸收光谱以及稳态荧光光谱进一步表征了所合成碳点的光学特性, 如图3(a)所示, 碳点主要有两个吸收峰, 在270 nm左右的强吸收峰来源于C=C基团的π π * 跃迁[12], 在300~400 nm范围内, 有一个较宽的吸收峰, 来源于C=O基团的nπ * 跃迁。 固定荧光发射波长为460 nm, 我们测量了碳点的激发光谱, 并且测量了370 nm波长光激发下碳点的荧光发射光谱, 结果如图3(a)所示。 可以看到, 碳点在紫外区域有一个较强的吸收峰, 但用该波长激发碳点时, 荧光发射相对较弱。 这是由于sp2杂化中大量π 电子在该波长处有较强的吸收, 跃迁到激发态后通过无辐射弛豫过程回到基态, 从而导致荧光强度低的结果[13]。 碳点的荧光主要来源于共轭π 域的带隙跃迁或是与碳点表面复杂的缺陷有关。 实验测量了激发波长对于碳点荧光发射谱的影响, 如图3(b)所示, 表明了碳点具有激发依赖型发射的特点, 从碳点的荧光发射光谱可以看出, 其发射很宽且与激发波长相关, 当激发波长由370 nm增大至425 nm时, 荧光峰值位置也随之发生红移, 荧光峰值强度先增大后减小, 最大值对应的荧光峰值位置为460 nm(370 nm 激发), 且不同激发波长下的荧光发射光谱组成的轮廓与发射波长为460 nm的激发光谱的轮廓相似[14]。 碳点的这种可调谐荧光特性是由于碳点表面发射位点分布不均匀[15]以及不同尺寸的碳点具有不同的发光特性, 随着碳点粒径的增加, 荧光红移到较低的能量。 因此, 我们可以通过调节激发波长, 使得碳点荧光峰值在444和535 nm之间变化。
2.2.1 吸收和荧光
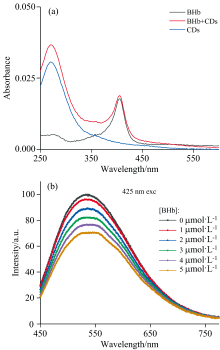
为了分析BHb对碳点光谱的影响, 我们将碳点与不同浓度的BHb混合, 测量混合溶液的荧光发射光谱以及吸收光谱。 在图4(a)中, 蓝色和黑色的曲线分别代表碳点和BHb的吸收光谱, 其中BHb的浓度为0.25 μ mol· L-1, 碳点的浓度是4.6 mg· mL-1, 红色曲线是两者混合后的吸收光谱(已考虑两溶液混合带来的浓度降低的影响), 发现混合后的吸收光谱约为两个样品单独存在时的吸收光谱之和。 图4(b)显示的是加入不同浓度的BHb后碳点的荧光发射光谱。 结果表明, BHb会猝灭碳点的荧光, 加入的BHb浓度越高, 碳点荧光下降的比例就越大。 图中荧光强度已经过归一化处理。
2.2.2 猝灭机制
根据猝灭机理的不同, 荧光猝灭被分为动态和静态两种形式。 静态猝灭的原理是, 部分荧光分子与猝灭剂结合, 形成的络合物不会发出荧光, 从而导致荧光分子的荧光强度减弱。 动态猝灭的原理是, 部分荧光分子处于激发态时, 与猝灭剂分子发生了碰撞或其他相互作用, 失活后直接回到基态, 从而使荧光强度降低。 常用Stern-Volmer方程来对荧光猝灭的数据进行分析, 见式(1)。
式(1)中, F0和F分别表示加入BHb前后碳点的荧光强度, kq为双分子猝灭速率常数, [Q]表示加入的BHb的浓度, τ 0为未加BHb时碳点的荧光寿命。 根据Stern-Volmer方程作出碳点的荧光强度下降比例随BHb浓度变化的关系曲线, 如图5(a)所示, 可以看到, 碳点的荧光下降程度F0/F和BHb浓度之间表现为很好的线性关系, 由Stern-Volmer方程计算可得在295 K下, kq的值约为5.72× 1013 L· mol-1· s-1, 比最大扩散速率常数(2× 1010 L· mol-1· s-1)大几个量级, 表明BHb对碳点荧光的猝灭是一个静态的过程[16]。 除此之外, 这两种猝灭形式还可以根据不同温度下的猝灭速率常数来进行判断。
 | 图5 在不同反应温度下碳点荧光随BHb浓度变化的Stern-Volmer图(a), (b)Fig.5 Stern-Volmer plots for the carbon dots/BHb at different temperatures (a), (b) |
在较高的温度下, 荧光分子和猝灭剂之间的碰撞比较剧烈。 因此随着温度的升高, 动态猝灭的猝灭速率常数也随之增大。 在静态猝灭的情况下, 高温不利于复合物形成, 因此随着温度的升高, 静态猝灭的猝灭速率常数也随之减小。 从图5(a)中观察发现, 温度越高, Stern-Volmer图线的斜率越低, 也就是猝灭速率常数越小, 因此该过程是静态猝灭过程, 求得猝灭速率常数如表1所示。 由式(2), 可进一步求得结合常数Ka和结合位点数n, 在三个温度下, 分别作出荧光变化量的对数形式随BHb浓度的对数的变化曲线, 经过线性拟合, 求得结合常数和结合位点数如表1所示。 在不同的温度下, 结合位点数都在1附近, 表明在碳点和BHb之间有一个结合位点。 在295 K下, 结合常数为2.94× 105 L· mol-1, 较高的结合常数表明碳点和BHb之间有一个比较强的结合。 随着温度升高, 结合常数以及结合位点数皆有一定程度的下降, 进一步证明了BHb对碳点荧光的猝灭是一个静态的过程。
| 表1 在不同温度下的猝灭常数和结合常数 Table 1 Quenching and binding parameters at different temperature |
为了获得更直接的证据证明两者之间发生了静态猝灭, 我们测量了碳点的荧光寿命在猝灭过程是否发生改变。 由图6(a)可知, 加入不同浓度的BHb, 碳点的荧光寿命基本保持不变, 经拟合, 碳点的荧光寿命约为1.7 ns, 激发和探测的波长分别为425和535 nm。
2.2.3 圆二色谱
我们进一步对BHb结构在该过程是否发生变化进行了研究, 分别测量了加入碳点前后BHb的圆二色谱, 结果如图6(b)所示。 在209和221 nm分别有两个负峰, 对应BHb的α -螺旋结构[17], 这是由于肽键(O=C-NH-)的nπ * 跃迁形成的。 据报道, 我们可以根据圆二色谱通过式(3)和式(4)计算得到蛋白的α -螺旋含量[18]
式(3)和式(4)中, c为蛋白的浓度, 实验选用的BHb的浓度为5 μ mol· L-1; n为蛋白质中氨基酸的数量, 根据文献报道为574[19]; l为光程, 为2 mm; MRE209 nm则代表209 nm处BHb的平均残基椭圆率。 计算后发现加入碳点后BHb的α -螺旋含量由43.1%下降至40.3%, 说明碳点的加入会改变蛋白的结构。
2.3.1 线性方程与检测限
我们检测了不同浓度BHb对于碳点荧光的影响, 发现加入BHb后碳点的荧光峰值下降, 由图7(a)可见, 碳点荧光变化F0/F在BHb浓度为0~5 μ mol· L-1时, 两者表现出很好的线性关系, 回归方程为y=0.091 28x+0.994 87, 相关系数r为0.998, 在线性方程中BHb浓度的单位为μ mol· L-1, 以三倍信噪比计算得到检测BHb的检测限为304 nmol· L-1, 相比其他检测BHb的方法[20], 该碳点检测BHb也具有比较低的检测限。 除此之外, 由于碳点具有可调谐荧光的特性, 当激发波长由425 nm减小为370 nm, 荧光峰也会发生一定的蓝移。 利用碳点的该特性, 我们用370 nm的光激发碳点, 观察BHb对碳点荧光的影响, 也呈现与425 nm的光激发相似的实验结果, 如图7(b), 线性回归方程为y=0.095 96x+0.987 51, 在线性方程中BHb浓度的单位为μ mol· L-1, 相关系数r为0.998, 检测限为243 nmol· L-1, 同样可以实现对微量血红蛋白的检测。 除此之外, 我们通过不同缓冲液的实验证实, 在Tris缓冲液中, 加入BHb后碳点的荧光特性与碳点在PB缓冲液中的实验结果结论相同, 表明不同的缓冲液体系对于荧光碳点检测BHb没有影响。
2.3.2 选择性与荧光稳定性
为了评估该碳点检测BHb的选择性, 我们选择了生物体血液中存在的7种常见的氨基酸或蛋白质, 包括牛血清白蛋白、 色氨酸、 酪氨酸、 丙氨酸、 半胱氨酸、 甘氨酸以及蛋氨酸, 分别与碳点混合, 测量在不同体系下, 碳点的荧光变化(425 nm激发), 样品的浓度均设置为20 μ mol· L-1。 实验结果表明只有在碳点/BHb体系中, 荧光有明显的变化, 证实了合成碳点对血红蛋白的高选择性, 结果如图8(a)所示。 加入BHb后, BHb与碳点发生相互作用, 形成复合物。 碳点荧光强度随时间变化如图8(b)所示, 表明用该碳点探针检测BHb, 碳点的荧光具有较好的稳定性。
采用化学方法以果糖和氢氧化钠为原料制备了水溶性发光碳点, 合成过程遵循绿色化学原则, 无需加热等高能耗过程, 需要的仪器设备简单, 具有较高的实用性。 合成的碳点可用于微量血红蛋白的特异性检测。 通过皮秒时间相关单光子计数系统以及荧光温控实验证明了血红蛋白对合成碳点荧光的猝灭是一个静态的过程, 两者之间发生结合, 形成了基态复合物, 并通过圆二色谱分析发现, 在该过程血红蛋白的二级结构发生了变化, 对其机理进行了详细的实验分析。 本研究展示了一种基于发光碳点荧光猝灭来检测血红蛋白的方法, 该方法具有高选择性, 高稳定性以及低成本的优势。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|