作者简介: 贾豪, 1997年生, 河南中医药大学药学院硕士研究生 e-mail: 1031051495@qq.com
经典名方一贯煎由生地黄、 北沙参、 麦冬、 当归、 枸杞子、 川楝子6味药组成, 具有滋养肝肾、 疏肝理气之效。 红外光谱技术具有快速无损的优点, 可完整的将不同批次一贯煎基准样品的信息表达。 运用傅里叶变换红外光谱仪采集样品的红外光谱, 对原始光谱进行预处理, 得到相对峰高, 对共有峰进行归属, 采用聚类分析(HCA)、 主成分分析(PCA)及正交偏最小二乘法-判别分析(OPLS-DA)对图谱数据进行评价。 结果表明15批一贯煎基准样品中868、 822和779 cm-1波段为糖骨架伸缩振动吸收峰, 多为枸杞所贡献, 815 cm-1波段处少数为麦冬所贡献; 生地黄单煎液在1 148 cm-1波段处、 沙参单煎液在1 158、 1 082和1 019 cm-1波段处、 当归单煎液在993 cm-1波段处均有对糖苷类成分的贡献; 川楝子单煎液1 746 cm-1波段处可溶性脂类糖苷成分吸收峰明显, 一贯煎复方中此处吸收峰并不明显, 可能为川楝子与其他五味药配伍煎煮过程中化学成分发生变化。 HCA结果显示, 当组间距离=10时, S1、 S2、 S15聚为一类, S9、 S11、 S12、 S13、 S14聚为一类, S3、 S4、 S5、 S6、 S7、 S8、 S10聚为一类, 表明不同批次一贯煎汤剂内部质量存在一定差异。 PCA分类结果与聚类分析结果基本一致, 并计算不同批次的主成分综合得分, 其中批次3一贯煎汤剂质量最佳, 批次1质量最次, 由载荷散点图分析得到1 104、 1 142、 1 412、 1 260和868 cm-1波段峰对主成分1的贡献率较大; 777、 2936、 923、 1 721、 818和637 cm-1波段峰对主成分2的贡献较大。 OPLS-DA结果与HCA和PCA结果一致, 以VIP>1为标准, 筛选出七个导致样品之间产生差异的波段, 分别为777、 637、 923、 2 936、 1 260、 1 412和1 630 cm-1, 该结果与PCA载荷图中寻找的重要性权重变量基本一致。 所建立的一贯煎红外指纹图谱方法简单、 准确度高, 可用于经典名方的快速鉴别分析, 为经典名方一贯煎的质量控制与评价提供参考。
The classic formula Yiguanjian consists of 6 herbs: Rehmannia glutinosa Libosch, Angelica sinensis (Oliv. ) Diels, Glehnia littoralis Fr. Schmindt ex Miq, Lyciumbarbarum L, Ophiopogon japonicus (L. f) Ker-Gawl, Melia toosendan Sieb. et Zucc are effective in nourishing the liver and kidneys and de-stressing the liver and Qi. Infrared spectroscopy has the advantage of being fast and non-destructive. Infrared spectroscopy provides complete information from different batches of Yiguanjian benchmark samples. The infrared spectra of the samples were collected using a Fourier transform infrared spectrometer. The raw spectra were pre-processed to obtain relative peak heights and to attribute shared peaks. The infrared spectral data were evaluated using HCA, PCA and OPLS-DA. The results showed that the sugar skeleton stretching vibration absorption peaks in the 868, 822 and 779 cm-1 bands of the 15 batches of Yiguanjian benchmark samples were mostly contributed by Lyciumbarbarum L and a few at the 815 cm-1 band were contributed by Ophiopogon japonicus(L. f) Ker-Gawl. The single decoction of Rehmannia glutinosa Libosch at 1 148 cm-1 band, the single decoction of Glehnia littoralis Fr. Schmindt ex Miq at 1 158, 1 082, 1 019 cm-1 band and the single decoction of Angelica sinensis (Oliv. ) Diels at 993 cm-1 band all contributed to the glycosidic composition. The absorption peak of soluble lipid glycosides in the 1 746 cm-1 band of the single decoction of Melia toosendan Sieb. et Zucc is obvious, but the absorption peak is not obvious in Yiguanjian benchmark samples. It may have changed chemically during decoction. The HCA results showed that S1, S2, S15 clustered into one group, S9, S11, S12, S13, S14 clustered into one group, S3, S4, S5, S6, S7, S8, S10 clustered into one group when the distance between groups=10. Indicating that there was some variation in the internal quality of different batches of consistent decoctions. It indicates some variation in the internal quality of the 15 batches of Yiguanjian benchmark samples. The PCA classification results were in general agreement with the HCA results, and the combined principal component scores were calculated for different batches, with batch No.3 Yiguanjian being the best quality decoction and batch No.1 being the worst. Analysis of the load scatter plots yielded 1 104, 1 142, 1 412, 1 260, and 868 cm-1 band peaks contributing more to principal component 1; 777, 2936, 923, 1 721, 818, and 637 cm-1 band peaks contributing more to principal component 2. OPLS-DA results are consistent with HCA and PCA results. Using VIP>1 as a criterion, seven bands that led to differences between samples were screened, 777, 637, 923, 2 936, 1 260, 1 412 and 1 630 cm-1, respectively, and the results were generally consistent with the importance weighting variables looked for in the PCA loading diagram. The established method of infrared fingerprinting of Yiguanjian is simple and accurate, which can be used for the rapid identification and analysis of the classical formulae and provide a reference for the quality control and evaluation of the classical formulae of Yiguanjian.
经典名方一贯煎是临床上首选的滋阴疏肝方剂, 被国家中医药管理局收录于《古代经典名方目录(第一批)》, 有医家称其为“ 涵养肝阴无上良方” [1]。 一贯煎出自清代《续名医类案》, 为名医魏之琇所创, 由生地黄、 北沙参、 麦冬、 当归、 枸杞子、 川楝子6味药组成, 具有滋养肝肾、 疏肝理气之效, 临床上广泛应用于慢性肝病、 胃病、 干燥综合征、 糖尿病、 干眼症、 耳鸣等证属肝肾阴虚, 肝郁气滞者[2]。
一贯煎水煎液临床疗效显著, 但关于其水煎液的质量分析研究少有报道。 红外光谱技术具有灵敏度高、 特征性强、 检测快速、 无损等特点[3], 既能反映药材内部所有复杂成分峰的叠加, 又能反映药材所含不同成分及其比例, 故可全面体现药材的质量[4]。 随着红外光谱技术的发展, 其分辨率及图谱识别能力均有了新的突破, 已成为中药快速鉴别及质量评价的一种有效手段[5]。 化学模式识别分析可以数字化地表达光谱信息[6], 从而可以更加客观地反映中药的质量信息, 达到全面控制中药质量的目的[7], 两者结合能更加客观地评价中药的质量。
本研究参照发布的经典名方开发技术指导原则, 收集不同产地药材饮片, 制备15批一贯煎基准样品冻干粉, 建立该基准样品和药材饮片的红外指纹图谱并对其进行化学模式识别方法分析, 为一贯煎基准样品冻干粉的质量标准的建立与完善提供实验依据, 为一贯煎制剂的研发与工业生产提供参考。
傅里叶变换红外分光光度计为Spectrum100型(美国Pekin Elmer公司); 红外分析软件为Spectrum for window3.02软件; 粉末压片机为FW-4A型(天津市拓普仪器有限公司); FW-100型高速万能粉碎机(北京科伟永兴仪器有限公司); 101-3AB型点热恒温鼓风干燥箱(北京中兴伟业仪器有限公司); ME204E/OL型万分之一天平(上海梅特勒-托利多仪器有限公司); 溴化钾(光谱纯, 天津市科密欧化学试剂有限公司); 无水乙醇(分析纯, 天津市致远化学试剂有限公司); 玛瑙研钵。
一贯煎中6味药材饮片均源自道地产地或主产区产地, 均经河南中医药大学陈随清教授鉴定, 详见表1。 均符合2020年版《中华人民共和国药典》(一部)相关项下规定。
| 表1 一贯煎饮片来源 Table 1 Sources of tablets |
采用随机数表法对一贯煎饮片进行随机配组, 结果见表2, 按照经典名方目录折算剂量, 生地黄11.19 g、 当归5.6 g、 北沙参5.6 g、 枸杞11.19 g、 麦冬5.6 g、 川楝子7.46 g, 在黑砂锅中煎煮。 一煎加8倍量水, 浸泡30 min, 电陶炉武火(1 400 W)煎煮5 min, 转文火(300 W)煎煮30 min; 二煎加水量为一煎的三分之二, 武火(1 400 W)煎煮5 min, 转文火(300 W)煎煮25 min。 合并两次煎煮液, 调整体积至200 mL, 汤剂含药量0.233 2 g· mL-1即得一贯煎水煎液; 精密移取10 mL上述水煎液于西林瓶中, 将其-20 ℃冷冻48 h, 置于真空冷冻干燥机中, 冻干温度-60 ℃, 真空度10(± 5)Pa, 干燥72 h, 即得一贯煎基准样品冻干粉。
| 表2 15批基准样品组方样品信息 Table 2 Sample information for the 15 batches of baseline sample formulations |
单味饮片粉碎后过九号筛, 备用。 按照2.1项下基准样品制备方法, 分别制备单生地黄、 单当归、 单枸杞、 单麦冬、 单北沙参、 单川楝子的冻干粉和缺生地黄、 缺当归、 缺枸杞、 缺麦冬、 缺北沙参、 缺川楝子的阴性冻干粉。
取样品2 mg与120 mg KBr置于玛瑙研钵研磨均匀, 取适量混合均匀的样品置于专用压片模具中, 用8 MPa的压力压制30 s, 压成均匀半透明的薄片, 取出, 置红外光谱仪中采集各样品红外光谱图。 光谱范围4 000~450 cm-1, 每张光谱扫描次数16次· s-1, 光谱分辨率为4 cm-1, 扫描速度0.2 cm· S-1, 扫描时扣除CO2和H2O, 室温20~25 ℃, 相对湿度25%~35%[5]。
各样品采集的红外原始光谱采用Spectrum for window3.02软件进行处理, 分别进行基线校正、 归一化处理并计算红外光谱相对峰高。 以红外指纹图谱的相对峰高为原始数据使用SPSS19.0、 SIMCA 14.1软件进行聚类分析、 主成分分析及正交偏最小二乘法-判别分析。
不同批次一贯煎汤剂基准样品按照2.3项下压制样品片并扫描其红外光谱。 从不同批次一贯煎基准样品红外光谱图可看出, 其红外光谱指纹图谱峰形、 峰位、 峰高基本相似, 不同批次基准样品中含有相同的化学成分, 所含的特征峰、 形状基本一致, 有个别特征峰的高度突出, 指纹区存在一定差异, 如图1所示。
如图2红外图谱中, 3 399 cm-1附近波峰强而宽的吸收峰为多糖、 糖苷类、 甾醇类化合物中羟基O—H键的伸缩振动峰; 2 936 cm-1处波峰为甲基、 亚甲基C—H不对称伸缩振动吸收峰, 结合1 412 cm-1附近的C—H弯曲振动峰, 一贯煎汤剂中含有较多的饱和烷基; 1 721 cm-1附近波峰是可溶性羧酸类化合物中羰基C=O伸缩振动峰; 1 630 cm-1处波峰为水的O—H弯曲振动、 蛋白氨基酸酰胺类N—H弯曲振动、 共轭羰基C=O的伸缩振动峰; 1 260 cm-1处的波峰主要是C—H弯曲振动, 1 142、 1 104和1 055 cm-1附近波峰是由多个峰重叠而成的宽强峰, 主要归属为糖类等物质C—(C)—O键的伸缩振动吸收峰; 923、 868、 818和777 cm-1附近处波峰为糖环骨架伸缩振动吸收峰。 一贯煎中吸收峰最强C—O键吸收在1 055 cm-1处主要为糖类, 1 900~1 720 cm-1主要为脂类和含有酯键的糖苷类即脂类糖苷、 1 700~1 500 cm-1主要为可溶性有机酸及氨基酸类、 1 200~777 cm-1主要为糖、 糖苷类[5]。
如图3所示, 川楝子饮片红外光谱2 854和1 746 cm-1波段处有明显强吸收峰, 单川楝子汤剂红外光谱2 854 cm-1波段处强峰消失, 1 746 cm-1波段处峰强减弱, 考虑是川楝子饮片经水煎煮后脂类成分减少(2 854和1 746 cm-1为脂类成分特征吸收峰[9]), 缺川楝子阴性对照传统汤剂红外光谱2 854和1 746 cm-1波段处强峰消失, 一贯煎传统汤剂基准样品红外光谱2 854和1 746 cm-1波段处也无明显强峰, 考虑是川楝子与其他五味药配伍煎煮过程中化学成分发生变化, 脂类糖苷类成分减少。
 | 图3 川楝子传统汤剂红外光谱阴性对比图谱Fig.3 Melia toosendan Sieb.et Zucc. traditional soup infrared spectrum negative comparison spectrum |
如图4所示, 当归饮片红外光谱1 760和993 cm-1波段处有明显吸收强峰, 单当归汤剂红外光谱1 760 cm-1波段处强峰消失, 993 cm-1波段处有明显强峰, 考虑是当归煎煮后脂类成分减少, 缺当归阴性对照传统汤剂红外光谱1 760和993 cm-1波段处强峰消失, 一贯煎传统汤剂基准样品红外光谱1 760和993 cm-1波段处也无明显强峰, 考虑是当归与其他五味药配伍煎煮过程中化学成分发生变化, 糖类成分减少。
 | 图4 当归传统汤剂红外光谱阴性对比图谱Fig.4 Infrared spectral negative comparison profile of Angelicae Sinensis Radix traditional tonics |
如图5所示, 枸杞饮片、 单枸杞汤剂基准样品、 一贯煎传统汤剂基准样品红外光谱868、 822、 779 cm-1波段处有明显强峰(糖骨架伸缩振动吸收峰), 缺枸杞阴性对照传统汤剂红外光谱868、 822、 779 cm-1处强峰消失, 表明枸杞中含有大量糖类成分, 且一贯煎汤剂中的糖类成分多为枸杞贡献。
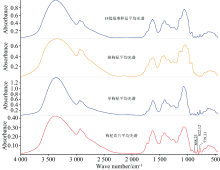 | 图5 枸杞传统汤剂红外光谱阴性对比图谱Fig.5 Infrared spectral negative comparison spectrum of Lyciumbarbarum L. traditional tonics |
如图6所示, 麦冬饮片和单麦冬汤剂基准样品红外光谱1 131、 930和815 cm-1波段处有明显强峰, 缺麦冬阴性对照传统汤剂红外光谱1 131、 930和815 cm-1处吸收峰变弱, 一贯煎传统汤剂基准样品红外光谱1 131和930 cm-1波段处有吸收峰稍有变强, 815 cm-1处吸收峰明显变强, 此处为糖环骨架伸缩振动吸收峰, 表明麦冬中含有大量糖苷类成分, 且一贯煎汤剂中的糖苷类成分部分为麦冬贡献。
 | 图6 麦冬传统汤剂红外光谱阴性对比图谱Fig.6 Infrared spectral negative comparative profile of Ophiopogonis Radix traditional tonics |
如图7所示, 北沙参饮片和单北沙参汤剂基准样品红外光谱1 158、 1 082和1 019 cm-1波段处有阶梯状吸收强峰(淀粉特征吸收峰1 200~950 cm-1), 缺北沙参阴性对照传统汤剂红外光谱1 158、 1 082和1 019 cm-1处吸收峰明显变弱, 一贯煎传统汤剂基准样品红外光谱1 158、 1 082和1 019 cm-1处有吸收峰稍有变强, 表明北沙参中含有大量糖类成分, 且一贯煎汤剂中的糖类成分部分为北沙参贡献。
 | 图7 北沙参传统汤剂红外光谱阴性对比图谱Fig.7 Glehniae Radix traditional soup infrared spectra negative comparative profile |
如图8所示, 生地黄和单生地黄汤剂基准样品红外光谱1 148 cm-1波断处有明显强峰, 缺生地黄阴性对照传统汤剂红外光谱1 148 cm-1处吸收峰变弱, 一贯煎传统汤剂基准样品红外光谱1 148 cm-1处吸收峰稍有变强, 表明生地黄中含有大量糖类成分, 且一贯煎汤剂中的糖类成分部分为生地黄贡献。
运用Spectrum for window3.02软件将采集的红外原始光谱图由透过率T%转换成吸光度A, 进行自动基线校正, 自动平滑处理。 选择3 500~3 200 cm-1波段范围内的最高峰的吸光度归一化处理[5], 计算14个特征峰的峰高, 结果见表3。 以15批一贯煎汤剂基准样品的14个特征峰的相对峰高为原始数据, 将数据输入SPSS19.0软件, 采用组间连接法, 以平方Euclidean距离为分类依据, 横坐标为组间距离, 纵坐标为样品编号, 对样品进行系统聚类分析[9], 结果见图9。 当组间距离=10时, S1、 S2、 S15聚为一类, S9、 S11、 S12、 S13、 S14聚为一类, S3、 S4、 S5、 S6、 S7、 S8、 S10聚为一类, 表明不同批次一贯煎汤剂内部质量存在一定差异。
| 表3 一贯煎汤剂红外指纹图谱共有峰相对峰高(n=6) Table 3 Relative peak heights of shared peaks in infrared fingerprinting of Yiguanjinan tonics (n=6) |
主成分分析是在尽可能保持原有数据信息的前提下, 通过降维处理达到简化指标的目的, 目前已被广泛用于数据统计分析[5]。 以15批一贯煎传统汤剂基准样品的14个共有峰相对峰高为原始数据, 运用SPSS19.0软件标准化处理进行主成分分析, 主成分特征值及方差贡献率见表4, 因前三个因子累计方差贡献率为87.207%> 85%[5], 充分代表了一贯煎传统汤剂基准样品14个共有峰的基本特征和主要信息, 故选取其中特征值大于1的前三个主成分(特征值分别为8.115、 2.437、 1.657)作为主成分1、 主成分2、 主成分3。 由图10可见前3个因子斜率陡峭, 后趋于平缓, 可将前3个因子作为主成分。
| 表4 主成分特征值与累积方差贡献率表 Table 4 Table of eigenvalues and cumulative variance contribution of principal components |
运用SIMCA 14.1软件绘制主成分得分图, 结果见图11, 15批一贯煎基准样品沿PCI轴明显区分开, S1、 S2、 S15聚为一类, S4、 S9、 S11、 S12、 S13、 S14聚为一类, S3、 S5、 S6、 S7、 S8、 S10聚为一类, 除S4以外, 该结果与聚类分析结果一致。 根据变量离原点的距离判定变量对主成分的权重影响, 离原点越远则表明该变量对主成分的影响权重越大[8, 10]。 由载荷散点图(图12)分析得到1 104、 1 142、 1 412、 1 260、 868 cm-1波段峰对主成分1的贡献率较大; 777、 2936、 923、 1 721、 818、 637 cm-1波段峰对主成分2的贡献较大。
 | 图11 一贯煎传统汤剂基准样品红外主成分散点图Fig.11 Infrared principal component scatter plot of Yiguanjian traditional soup benchmark sample |
 | 图12 一贯煎传统汤剂基准样品红外主成分载荷图Fig.12 Infrared principal component loadings of Yiguanjian traditional soup benchmark samples |
依据SPSS19.0软件计算3个主成分的得分, 以各主成分的方差贡献率为权重, 对主成分得分和对应的权重进行加权平均, 计算综合得分(Y综), 其中Y综=(57.964× PC1+17.410× PC2+11.832× PC3)/87.207(其中PC1、 PC2、 PC3分别代表主成分1、 2、 3的得分), 结果见表5。 其中综合得分情况可反映一贯煎汤剂的质量, 分数越高, 则质量越好[11]。 由表5可知, 批次3一贯煎汤剂质量最佳, 批次1一贯煎汤剂质量最次。 结合主成分得分排序表5、 主成分散点图11和聚类分析图9可知综合得分比较靠前的一贯煎汤剂S3、 S5、 S6、 S7、 S8、 S10为一类, S4、 S9、 S11、 S12、 S13、 S14为一类, 综合得分排序靠后的批次聚为一类(S1、 S2、 S15)。
| 表5 一贯煎汤剂红外主成分得分及排序表 Table 5 Infrared principal component scores and ranking table for Yiguanjian tonics |
将15批一贯煎传统汤剂基准样品红外图谱的14个共有峰相对峰高导入SIMCA 14.1, 对15批样品进行OPLS-DA分析, 在该模型下
 | 图14 一贯煎传统汤剂OPLS-DA模型的200次响应排序检验Fig.14 200 response ranking test for the OPLS-DA model for Yiguanjian traditional tonics |
为进一步筛选出导致15批传统汤剂基准样品产生差异的成分, 通过提取OPLS-DA模型中14个变量的重要值(variable importance in projection, VIP), 以VIP> 1[13]为标准, 筛选出777、 637、 923、 2 936、 1 260、 1 412和1 630 cm-1波段(图15)可能是导致样品之间产生差异的主要原因, 具有一定的标志性作用, 该结果与PCA载荷图中寻找的重要性权重变量基本一致。
本研究建立了15批一贯煎基准样品的红外指纹图谱, 标定了14个共有峰, 并结合单味饮片粉末、 单味饮片单煎液和缺味药阴性红外图谱, 发现868、 822和779 cm-1波段糖骨架伸缩振动吸收峰, 多为枸杞所贡献, 815 cm-1处少数为麦冬所贡献; 川楝子单煎液1 746 cm-1波段处可溶性脂类糖苷成分吸收峰明显, 但与其他五味药合并煎煮之后此处吸收峰被覆盖, 一贯煎复方中此处吸收峰并不明显; 生地黄单煎液在1 148 cm-1波段处、 沙参单煎液在1 158、 1 082和1 019 cm-1波段处、 当归单煎液在993 cm-1波段处均有对糖苷类成分的贡献, 表明复方与饮片有较好的关联性。
从HCA结果来看, 在不同批次的一贯煎基准样品中的化学成分含量存在一定的差异, S1、 S2、 S15聚为一类, S9、 S11、 S12、 S13、 S14聚为一类, S3、 S4、 S5、 S6、 S7、 S8、 S10聚为一类。 随后进行了无监督的PCA, 该分类结果与聚类分析一致, 也进一步验证了聚类分析的结果。 结合主成分得分排序表5、 主成分散点图11和聚类分析图9可知综合得分比较靠前的批次一贯煎汤剂S3、 S5、 S6、 S7、 S8、 S10为一类, S4、 S9、 S11、 S12、 S13、 S14为一类, 综合得分排序靠后的批次聚为一类(S1、 S2、 S15)。 在对一贯煎进行一致性评价的同时进行了差异性评价, 通过VIP法筛选出了对样品组分影响较大的波段, 筛选出777、 637、 923、 2 936、 1 260、 1 412和1 630 cm-1波段为差异主要贡献波段, 提示在今后该经典名方的生产过程中应重点关注糖苷类成分、 酸类成分的变化, 进而保证一贯煎的质量, 以便更好地对一贯煎传统汤剂进行质量控制。
采集15批一贯煎传统汤剂基准样品、 单味饮片粉末、 单煎液冻干粉及阴性冻干粉红外指纹图谱, 寻找各单味药在复方中的主要贡献成分类别, 综合得分排序结果与聚类分析、 主成分分析结果一致, 表明不同批次一贯煎传统汤剂内部质量存在一定差异, 最终筛选出 777、 637、 923、 2 936、 1 260、 1 412和1 630 cm-1波段为差异主要贡献波段。 本实验所建立的一贯煎传统汤剂基准样品红外指纹图谱方法简单、 准确度高, 可用于该经典名方的快速鉴别研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|









