作者简介: 马 纪, 女, 1981年生, 广西科技大学生物与化学工程学院博士研究生 e-mail: 2008xiushui@163.com
过氧化氢(H2O2)在食品工业、 环境监测分析、 燃料电池、 临床诊断等领域得到十分广泛的应用。 过氧化氢不仅是严重疾病的生物标志物, 也是重要的食品添加剂。 无论从食品安全还是人类健康考虑, 对过氧化氢构建简便、 快速、 灵敏的检测方法具有重要意义。 比色法因具有易操作、 成本低及检测结果可视化等优点被广泛关注。 比色法普遍使用的酶是辣根过氧化物酶(HRP)。 但天然酶存在易失活、 生产成本高及稳定性差等不足。 纳米酶克服了HRP易失活的缺点。 然而部分纳米酶合成复杂、 需要表征、 水溶性差及催化活性低等。 与HRP和纳米酶相比, 具有类过氧化物酶性质的铜离子(Ⅱ), 不仅具有灵敏度高的特点, 而且不需要复杂的合成、 易获得、 易储存、 不需修饰可直接使用、 操作简单及分析成本低廉等优势。 铜离子(Ⅱ)类酶能够通过催化过氧化氢生成羟基自由基, 氧化3,3’,5,5’-四甲基联苯胺(TMB)而产生氧化态TMB, 使溶液的颜色由无色逐渐转变为蓝色, 从而产生光信号, 这些光信号可以肉眼识别和通过紫外分光光度计检测。 基于上述原理构建过氧化氢的快速比色传感并应用于银耳样品的检测。 实验考察了体系中过氧化氢浓度、 pH值、 温度等因素对吸光度的影响。 选择缓冲溶液pH值为3.0, 温度40 ℃, TMB和铜离子(Ⅱ)浓度分别为6.0×10-4和8.0×10-3 mol·L-1, 反应时间为20 min。 在最优条件下, 过氧化氢浓度与体系的吸光度值呈良好的线性关系, 线性范围是0.08~40 μmol·L-1, 检测限为0.14 μmol·L-1。 该法可检测银耳中过氧化氢的浓度, 加标回收率在97.10%~107.08%之间, 相对标准偏差(RSD)小于5%。 该研究无需特殊检测设备条件下实现过氧化氢的简单、 快速、 成本低廉且灵敏的可视化检测, 有利于过氧化氢的定量检测在食品领域和临床上的快速推广。
Hydrogen peroxide (H2O2) is widely used in the food industry, environmental monitoring and analysis, fuel cell, clinical diagnosis and other fields. Hydrogen peroxide is not only a biomarker of severe diseases but also an important food additive. In terms of food safety and human health, it is of great significance to construct a simple, rapid and sensitive detection method. Colorimetric method is widely concerned because of its advantages such as easy operation, low cost and visualization of detection results. The enzyme commonly used in colorimetric method is horseradish peroxidase (HRP). However, natural enzymes are easy to deactivate, have high production costs and have poor stability. Nanoenzyme overcomes the disadvantage of HRP’s easy inactivation. However, some nanoenzymes are complex in synthesis, need to be characterized, and have poor water solubility and have low catalytic activity. Compared with HRP and nanoenzyme, copper ion (Ⅱ) with peroxidase-like properties has the characteristics of high sensitivity and does not need complex synthesis, is easy to obtain, easy to store, without modification can be directly used, simple operation and low analysis cost, etc. Copper ion (Ⅱ) can catalyze hydrogen peroxide to generate hydroxyl radicals and oxidize 3,3’,5,5’-tetramethyl benzidine (TMB) to produce the oxidation state TMB, which makes the color in the solution gradually change from colorless to blue, thus producing light signals that can be recognized by the naked eye and detected by ultraviolet spectrophotometer. Based on the above principles, a fast colorimetry sensor based on hydrogen peroxide was constructed and applied to detect tremella samples. The effects of hydrogen peroxide concentration, pH value, temperature and other factors on the absorbance were investigated. The pH value of the buffer solution was 3.0, the temperature was 40 ℃, the concentration of TMB and Cu(Ⅱ) was 6.0×10-4 and 4.0×10-3 mol·L-1, respectively, and the reaction time was 20 min. Under the optimal conditions, the concentration of hydrogen peroxide had a good linear relationship with the absorbance of the system, the linear range was 0.08~40 μmol·L-1, and the detection limit was 0.14 μmol·L-1. The recoveries of hydrogen peroxide in tremella were 97.10%~107.08%, and the relative standard deviation (RSD) was less than 5%. In this study, a simple, rapid, low-cost and sensitive visual detection of hydrogen peroxide was achieved without special detection equipment, which is conducive to the rapid promotion of quantitative detection of hydrogen peroxide in the food field and clinical practice.
过氧化氢(H2O2)是一种强氧化剂, 具有漂白、 防腐、 杀菌和消毒作用, 广泛应用于工业、 食品和医疗领域, 但其过量添加产生的副作用日益凸显。 过氧化氢进入人体可产生羟基自由基, 导致细胞凋亡、 加速人体衰老、 诱发心血管疾病和癌症等[1]。 美国食品和药物管理局(FDA)规定了H2O2的最大残留限量标准为15 μ mol· L-1 [2]。 因此, 开发一种简便、 快速、 灵敏度高、 成本低的过氧化氢检测方法刻不容缓。
目前, 有关过氧化氢的分析方法主要有色谱法[3]、 化学发光法[4]、 电化学法[5, 6]、 荧光光度法[7, 8]、 比色传感法[9, 10, 11]等。 其中, 比色传感法因具有操作简单、 检测速度快、 分析成本低及检测结果可视化等优点被广泛关注。 比色传感法主要是在酶的催化作用下, 利用过氧化氢氧化底物光学性质的变化为检测信号。 比色法通常使用的酶是辣根过氧化物酶(HRP), 由于天然酶存在易失活、 稳定性差及制备过程繁琐等限制了其广泛应用。 因此, 许多研究者探索人工模拟酶替代天然酶。 自Fe3O4纳米粒子首次被证实具有类HRP的催化活性以来[12], 纳米酶在科学技术和研究中迅速得到了发展。 越来越多不同形貌、 尺度的模拟酶相继出现[13, 14]。 然而, 部分纳米材料模拟酶存在合成复杂、 合成使用的有机溶剂易造成二次污染、 需要表征、 水溶性差、 稳定性不高及催化活性低等不足。 为了快速灵敏检测H2O2, 寻找高效的过氧化物模拟酶是一项迫切的任务。
与HRP和纳米过氧化物酶相比, 铜离子(Ⅱ )类过氧化物酶不仅具有灵敏度高的特点, 而且易获得、 不需要复杂的合成、 易储存、 不需修饰可直接使用、 操作简单及成本低廉等优点[15]。 因此, 我们开发一种基于铜离子(Ⅱ )类过氧化物酶的比色法检测过氧化氢的新方法。 利用铜离子(Ⅱ )类过氧化物酶的活性催化过氧化氢氧化TMB产生氧化态TMB, 使溶液颜色从无色转变为蓝色, 变蓝的程度与过氧化氢的浓度呈正比, 构建线性关系, 从而确定过氧化氢的含量。 在此基础上, 采用该方法高灵敏地检测了银耳中的过氧化氢含量。
Cary60紫外可见分光光度计, 美国安捷伦科技有限公司(取样间隔: 3 nm; 扫描速度: 快速; 波长范围: 500~750 nm)。 梅特勒AL104分析天平(110 g/0.1 mg电子天平), 梅特勒-托利多仪器(上海)有限公司。 30%过氧化氢(H2O2), 醋酸钠(NaAc), 冰乙酸(HAc), 醋酸铜, 天津威晨化学试剂科贸有限公司; 3, 3’ , 5, 5’ -四甲基联苯胺(TMB), 上海阿拉丁生化科技股份有限公司; 实验所用的水为去离子水。
1.2.1 基于铜离子模拟酶催化检测过氧化氢
在5 mL具塞试管中, 分别加入一定量的0.1 mol· L-1醋酸铜溶液、 一定量的5× 10-3 mol· L-1TMB溶液以及一定量不同浓度的过氧化氢, 用缓冲溶液(pH 3.0)定容至2.5 mL, 将试管置于40 ℃水浴锅中反应30 min。 采用紫外-分光光度计在500~750 nm范围内对溶液进行光谱测定。 记录652 nm波长下吸光度值A和相同条件下空白溶液的吸光度A0, 计算Δ A=A-A0。
1.2.2 银耳实际样品处理与测定
待测样品为银耳, 购买于当地超市。 将5.0 g银耳粉碎, 溶于5.0 mL HAc-NaAc缓冲溶液中, 超声震荡20 min, 经过离心和0.45 μ m孔径滤膜过滤, 除去不溶物, 向处理好的1.0 mL样品溶液中分别加入1.0× 10-5, 2.0× 10-5, 3.0× 10-5 mol· L-1的过氧化氢, 定容至2.5 mL, 得到处理后分别添加1.0× 10-5, 2.0× 10-5和3.0× 10-5 mol· L-1过氧化氢的待测样品溶液。
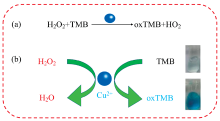
图1为铜离子(Ⅱ )比色法检测过氧化氢的原理图。 铜离子(Ⅱ )具有类过氧化物酶性质[图1(a)], 过氧化氢氧化TMB, 在铜离子(Ⅱ )的催化下溶液从无色变为蓝色[图1(b)]。 该反应系统可以肉眼可视化和紫外-可见分光光度计检测。 通过铜离子(Ⅱ )催化过氧化氢氧化TMB显色, 建立快速检测过氧化氢的比色传感器。
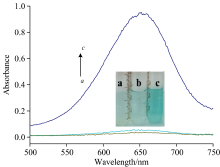
采用比色法对体系进行可行性实验。 如图2所示, H2O2能缓慢氧化TMB使溶液呈现很浅的蓝色, 在652 nm附近有一个弱的吸收峰(图2a); Cu 2+不能氧化TMB(图2b), 但当在TMB-H2O2体系加入Cu2+后, H2O2氧化TMB的速度明显加快, 使溶液呈现深蓝色, 在652 nm处的吸收峰强度显著增加(图2c), 说明铜离子(Ⅱ )具有类过氧化物酶活性, 能催化TMB-H2O2体系并能可视化检测过氧化氢。
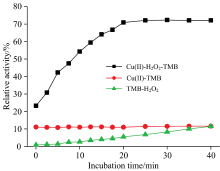
考察了缓冲溶液pH值对体系吸光度值的影响。 随着pH值的增大, 溶液在652 nm处的紫外吸光度值逐渐增大, 当pH 3.0时溶液在652 nm处的吸光度值Δ A最大, 之后溶液吸光度值逐渐降低。 因此, 反应体系最佳pH值为3.0。 考察了温度对体系吸光度值的影响, 结果表明, 40 ℃时体系在652 nm处的吸光度值最大, 从而确定最佳反应温度为40 ℃。 考察了铜离子(Ⅱ )浓度对体系吸光度值的影响。 当Cu2+浓度达到8.0× 10-3 mol· L-1时, 溶液在652 nm处的吸光度值Δ A达到最大, 从而确定检测试剂中铜离子的最佳浓度为8.0× 10-3 mol· L-1。 考察了TMB浓度对体系吸光度值的影响。 当TMB浓度为6.0× 10-4 mol· L-1时, 溶液在652 nm处的吸光度值最大, 之后溶液吸光度值趋于平缓。 因此, 确定检测试剂中TMB溶液的最佳浓度为6.0× 10-4 mol· L-1。 考察了反应时间对体系吸光度值的影响。 如图3所示, 20 min后溶液在652 nm处的吸光度值Δ A达到最大, 从而确定最佳反应时间为20 min。
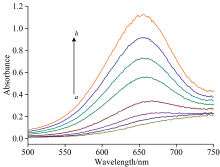
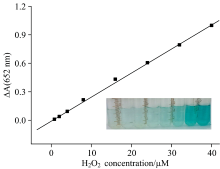
在最优条件下, 按1.2.1的实验方法分别测定不同浓度的过氧化氢标准溶液, 采集紫外光谱(图4), 以紫外光谱中652 nm处的紫外吸收强度变化值Δ A(A-A0)对过氧化氢的浓度建立定量分析的标准曲线(图5)。 根据图5拟合得到线性方程Δ A=0.026 8c-0.028 9, r2=0.998 0。 过氧化氢的浓度范围为0.08~40 μ mol· L-1, 检测限为0.14 μ mol· L-1。
对银耳中的过氧化氢进行检测分析。 向3支5 mL具塞刻度试管中, 分别加入0.1 mol· L-1醋酸铜溶液200 μ L和5.0× 10-3 mol· L-1 TMB溶液250 μ L, 用缓冲液定容至2.5 mL, 分别加入上述处理后的待测样品溶液250 μ L, 40 ℃水浴反应20 min。 采集紫外光谱, 读取652 nm处的紫外吸光强度值, 每个样品重复测样3次, 求平均值, 计算得到银耳中过氧化氢的含量为12.24 μ g· g-1(见表1)。 通过加标实验得到样品的加标回收率在97.10%~107.08%之间, 相对标准偏差(RSD)小于5%, 表明该检测方法准确度高, 选择性好。
| 表1 本方法检测银耳中过氧化氢的结果 Table 1 Result of H2O2 in tremella detected by this proposed method |
建立了一种铜离子(Ⅱ )类过氧化物酶活性催化过氧化氢氧化TMB显色, 利用紫外分光光度法检测过氧化氢的新方法。 在最佳的实验条件下, 过氧化氢的浓度在0.08~40 μ mol· L-1范围与体系的吸光度变化值Δ A呈现良好的线性关系, 检测限(3σ )为0.14 μ mol· L-1。 该法用于银耳样品中过氧化氢含量的测定, 结果令人满意。 所建立的食品中过氧化氢的检测方法具有简便、 快速、 灵敏、 成本低廉等优点, 在食品分析领域具有潜在的应用价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|