作者简介: 胡玉霞, 女, 1983年生, 安徽建筑大学电子与信息工程学院博士研究生 e-mail: yxhuhf@163.com
水源性病原菌污染会引发多种疾病, 严重危害人类健康和公共卫生安全。 水源性病原菌检测对人类医疗保健、 水安全保障和疾病诊断等具有重要的意义。 常规水源性病原菌检测技术, 如人工培养法、 分子生物法和免疫学法, 其测量结果准确、 有效, 但样品预处理繁琐且费时, 不利于病原菌实时在线检测。 光谱检测技术以非侵入式获取病原菌发射、 散射或吸收光谱特征, 能够确定病原菌性质、 结构和含量等信息。 由于该技术具有易于操作、 快速、 便携、 无损和便于实时监测等优点, 在环境监测、 生物分析中具有广泛的应用前景。 文章介绍了现有水源性病原菌检测技术及其优缺点, 指出开展病原菌快速、 高效检测的必要性; 讨论了光谱检测技术原理及数据分析方法, 重点综述了紫外可见光谱、 荧光光谱、 红外光谱、 拉曼光谱和太赫兹光谱在水源性病原菌检测的工作原理和研究进展; 最后总结了各技术的优缺点。 提出了光谱技术在病原菌检测的实际应用中面临的挑战及应对策略, 为进一步发展基于光谱技术的水源性病原菌的快速检测提供参考。
Waterborne pathogenic bacteria contamination can cause various diseases, seriously endangering human health and public health security. Waterborne pathogen detection is important to human health care, water safety and disease diagnosis. Conventional waterborne pathogen detection techniques, such as artificial culture, molecular biology and immunology, are accurate and effective, but sample pre-treatment is cumbersome and time-consuming, not conducive to real-time online detection of pathogenic bacteria. Spectral detection technology to non-invasive access to pathogenic bacteria emission, scattering or absorption spectral characteristics, able to determine the nature, structure and content of pathogenic bacteria and other information. Due to the advantages of easy operation, rapidity, portability, non-destructiveness and ease of real-time monitoring, this technique has many application prospects in environmental monitoring and bioanalysis. The article introduces the existing waterborne pathogen detection techniques and their advantages and disadvantages, points out the necessity of rapid and efficient detection of pathogenic bacteria; discusses the principles of spectroscopic detection techniques and data analysis methods, focusing on the working principles and research progress of UV/Vis spectroscopy, fluorescence spectroscopy, infrared spectroscopy, Raman spectroscopy and terahertz spectroscopy in the detection of waterborne pathogenic bacteria; finally summarizes the advantages and disadvantages of each technique. The challenges and strategies for the practical application of spectroscopic techniques in detecting pathogenic bacteria are presented to provide a reference for further development of rapid detection of waterborne pathogens based on spectroscopic techniques.
水源性病原菌可分为细菌、 病毒、 原生动物和蠕虫[1, 2]。 人们摄取受病原菌污染的自来水或饮用水, 会引发各种传染性疾病, 如肝炎、 流感、 SARS、 肺炎、 胃溃疡和肺部疾病等[3, 4]。 据报道, 水体大肠杆菌在美国每年造成约8 000万人患病和9 000人死亡[5]。 2008年, 瑞典小埃德市, 诺如病毒引起2 400人感染胃肠炎[6]。 2020年, 安徽寿县自来水受污染, 导致493人感染志贺氏菌, 陆续出现发热呕吐、 腹痛腹泻等症状。 另外, 水源性病原菌污染也会带来重大的经济损失。 据世界卫生组织(WHO)的数据统计, 澳大利亚悉尼的供水系统受到隐孢子虫污染, 疫情控制花费近4 500万美元[7]。 可见, 水体中病原菌不仅对人类健康和生命财产安全有影响, 而且对整个水生态系统构成严重威胁。 因此, 开展对水体病原菌快速灵敏的检测和识别方法的研究, 将有助于提前了解水污染程度、 及时采取措施保证水安全, 对维护人类健康和公共卫生安全具有重要意义。 常规的水体病原菌检测技术, 如人工培养法、 形态学鉴定和分子生物技术等具有测量准确、 有效等优点。 然而, 这些方法中大多数预处理复杂、 耗时长、 专人操作、 成本高, 并不能满足水体病原菌现场监测的需求。 因此, 需要开发快速准确、 无需复杂的检测步骤以及安全无污染的水体病原菌检测技术。
随着光学技术、 生物技术和分析化学技术的快速发展, 光谱检测技术成为水体病原微生物检测的研究热点之一。 特别是紫外可见光谱、 荧光光谱和拉曼光谱等, 具有响应时间快速和可移植性高等优点, 成为水源性病原菌检测的有效技术手段。 本文首先阐述了水体病原菌现有检测技术的发展现状, 然后重点综述了五种光谱检测技术在水体病原菌检测中的工作原理和研究进展, 最后指出各光谱技术在水体病原菌检测中的优缺点和未来发展趋势。
随着水质监测技术的普及, 人们开始意识到水源性病原微生物污染及其控制对人体健康保护和水安全保障极其重要。 国内外学者研究了多种水源性病原菌检测方法, 如传统培养法, 该方法主要包括滤膜法、 多管发酵法和平板计数法等。 滤膜技术是被美国环保署和世界卫生组织认可的检测饮用水生物污染物方法, 其原理将一定量的稀释菌液通过特殊无菌膜过滤器, 然后将带菌滤膜放置合适的培养基培养, 并计算待测细菌数量[8]。 多管发酵技术是一种检测水样中微生物活性的标准实验室方法。 根据美国环境保护署(Environmental Protection Agency, EPA)的标准EPA Method 9131, 利用多管发酵技术能够对总大肠菌群进行检测[9]。 多管发酵技术测定水样中的大肠杆菌, 其检出率为100%[10]。 平板计数法常用于测定细菌数量, 即把菌液接到平板中进行培养, 根据平板中生长出的菌落数量计算出水体中细菌浓度[11, 12]。
为了缩短水体病原菌检测时间, 该技术正在从传统的细胞培养转化到现代检测技术, 如分子生物学技术和免疫学技术等。 分子生物学技术包括聚合酶链反应(polymerase chain reaction, PCR)技术和原位荧光杂交(fluorescence in situ hybridization, FISH)技术。 PCR技术通过测定致病菌的特定核酸片段来鉴定病原体。 理论上, 利用PCR只需几个小时扩增DNA序列, 由于其较高检测灵敏度和高水平的扩增降低了增菌培养的依赖性。 尽管PCR方法检测成功率很高, 但仍存在一些局限性, 如对某些污染物敏感性低, 以及在水样中存在抑制剂时扩增效率降低[13]。 FISH技术是一种能够对微生物进行检测、 鉴定、 定位和计数的技术。 其原理是通过荧光标记的探针, 与细胞内特异性核酸序列结合, 通过共聚焦激光扫描显微镜对待测样品进行检测[14]。 由于FISH技术检测的精确性和可靠性依赖于探针的特异性和荧光团的选择, 因此在进行实验之前, 需要考虑探头设计和荧光团的选择等几个重要因素。
免疫学技术是利用抗原抗体的特异性反应检测微生物, 一般需要制备待检病原菌的特异抗体。 近年来, 被广泛用于微生物检测技术有酶联免疫吸附法[15]、 免疫磁分离(IMS)[16]和酶联荧光免疫分析技术[17]。 该技术具有快速、 特异性好和灵敏度高等优点, 但抗体易受环境中其他物质影响, 易出现假阳性。
表1总结了水体病原菌现有检测技术各自的优缺点。 可见, 传统人工培养法检测结果准确, 但操作繁琐、 周期长。 分子生物学方法和免疫学方法能够有效、 灵敏检测出病原菌, 并显著缩短检测时间, 但所需仪器复杂、 成本高且无法实现实时在线检测。 因此, 迫切需要研发快速简便、 成本低、 灵敏度高的现场检测方法。
| 表1 现有水体病原菌检测技术及其优缺点 Table 1 Current water pathogen detection technology and its advantages and disadvantages |
水资源不同于其他资源, 分布广泛且分散, 受病原菌污染的水体范围易于扩大, 降低了现有水体病原菌检测方法的敏感性, 同时易于引起大面积的人群感染疾病。 尽管现有检测技术仍是水体病原菌检测的主要方法, 但已有一些学者开始尝试研发更加快速、 准确和便于在线检测的方法, 实现对水环境中病原菌实时检测。 由于光与病原菌相互作用, 产生多种不同的效应: 吸收、 发射和散射等, 这些效应可以通过测量不同波长范围的光谱(紫外可见、 近红外、 中红外、 远红外、 拉曼、 太赫兹、 微波、 无线电波和核磁共振)来表征[18]。 光谱检测技术指利用光与待测病原菌产生的光谱来分析病原菌结构、 含量或性质的技术, 由于该技术能够无时间延迟地提供病原菌信息, 能够满足水体病原菌实时在线监测的需求。 目前, 用于水体病原菌检测的不同光谱技术的波长范围总结于图1, 可见, 病原菌检测波长范围主要集中在紫外到远红外波段, 该范围内所涉及光谱技术有紫外可见光谱、 红外光谱、 荧光光谱、 拉曼光谱和太赫兹光谱。
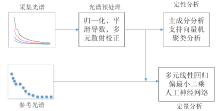
不同波长病原菌光谱(“ 指纹” 图谱), 通常含有病原菌的结构、 分子组成和含量等相关信息。 为了从光谱中获取病原菌的重要信息, 需要对光谱进行分析。 光谱数据分析流程如图2所示, 考虑到光谱里除含有病原菌自身特征信息外, 还包含样品背景、 杂散光以及其他噪声信息。 为了减少测量光谱中的冗余信息或噪声, 需要对采集的光谱数据进行预处理, 常用谱图预处理方法有均值中心化、 归一化、 平滑、 导数、 多元散射校正等[19]。 在数据预处理之后, 采用分类方法或回归技术提取被测物质的定性或定量信息。 定性分析指分析光谱特征或依据光谱进行分类, 如主成分分析[20]和支持向量机[21]等方法。 定量分析指需要依据参考光谱进行模型校准, 并给出与病原菌变量的相关性, 如多元线性回归、 主成分回归、 偏最小二乘算法和人工神经网络等[22, 23]。
紫外可见光谱是一种较敏感的分子光谱, 其选择波长范围为200~900 nm。 紫外可见光的吸收主要来自于微生物内某些分子官能团的作用, 当分子官能团受光照射时, 引起了内部电子能级跃迁, 从而获得单个分子的特征吸收光谱。 大多数液体或气体的紫外可见光测量依赖于朗伯比尔定律, 即样品的吸光度、 光程长度和样品内存在吸收分子浓度有关[24]。 因此根据吸收测量值, 可以确定待测物质的浓度。
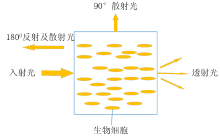
对于病原菌内蛋白质和其他大分子, 光被许多官能团吸收, 产生非特异性紫外可见光谱。 通过紫外光谱识别不同蛋白质难以实现, 但可以根据不同波长点的紫外吸光度值计算出总蛋白质含量[25]。 溶质的紫外吸收光谱分析通常假定为均匀溶液, 当溶液内存在固体颗粒时, 颗粒的吸收和散射作用主要体现在溶质吸收作用。 在微生物测量中, 这种现象用光密度值表示。 测量光密度值的不同模式如图3所示, 基于透射和浊度测量模式, 透射率是由恒定路径长度上的光吸收值来确定的, 而浊度是根据90° 散射或180° 处散射值来计算的。
目前, 通过光密度值对水溶液中病原菌浓度进行测定, 是快速、 常用的水体菌液浓度检测方法。 如Loske等[26]利用光密度值确定大肠杆菌菌液的浓度。 董自艳[27]采用紫外可见光谱计算出铜绿假单胞菌、 金黄色葡萄球菌和大肠埃希菌三种菌液浓度。 除了确定水体菌液的浓度, 紫外可见光谱技术也可以用于对微生物其他参数测量。 Edlich等[28]利用紫外可见光谱技术, 得到了酵母菌细胞大小、 核酸(DNA/RNA)浓度等信息。
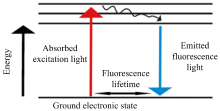
荧光光谱是利用荧光化合物, 又称荧光团, 在可见光或近紫外光的激发下发射荧光。 荧光团吸收某些波长的紫外光或可见光, 分子从基态跃迁到激发态, 然后从激发态返回基态释放更低的能量, 其荧光原理如图4所示。 关于荧光物质分为两类: 一类是病原菌体内本身生物化学荧光团, 如蛋白质内部分氨基酸、 还原型烟酰胺腺嘌呤二核苷酸(NADH)、 三磷酸腺苷、 丙酮酸及核黄素, 在可见光或近紫外光的激发下发出荧光, 其激发波长与发射波长如表2所示[29]。 另一种荧光团指在样品中添加一些试剂产生荧光, 如丹酰、 荧光素、 若丹明等。 因为特定波长激发下的发射光强度与荧光团浓度成正比[30], 使荧光光谱成为病原菌监测的工具。
| 表2 病原体内主要荧光物质激发波长与发射波长 Table 2 Excitation wavelength and emission wavelength of main fluorescent substances in the pathogen |
目前, 荧光光谱技术可以对不同微生物进行分类鉴定, 如Giana等[31]利用激发荧光光谱与主成分分析(PCA)相结合, 对大肠杆菌、 肠球杆菌以及金黄色葡萄球菌等细菌进行分类鉴别, 正确率和灵敏度均大于90%。 Schreier等[32]利用免疫磁分离(IMS)的荧光显微镜检测方法, 采用不同于荧光染料染色来检测水样中的细螺旋体病原菌, 其结果与PCR技术一样灵敏。 Khan等[33]利用流式细胞术结合荧光探针对大肠杆菌O157∶ H7、 假单胞菌和沙门氏菌等细菌进行了测定, 同时区分不可培养的活性与非活性细菌。 荧光光谱技术也可以获取细胞内信息。 李素文等[34]用荧光染料DAPI、 PyroninY和FITC对单个细胞的DNA、 RNA和蛋白质进行染色, 利用显微荧光光度法对细胞内DNA、 RNA和蛋白质含量进行测定, 其结果与流式细胞仪计算结果一致。
红外光谱是红外吸收光谱的简称, 当红外光子的能量等于物质的特定键振动所需的能量, 物质吸收了这个光的光子。 当连续波长的红光光束穿过样品时, 就能得到与该样品分子转动和振动能级信息有关的特异性吸收谱。 用于病原菌检测红外光谱包括近红外(800~2 500 nm)和中红外(2 500~25 000 nm)的光谱区域。 近红外光谱用于未知样品成分分析, 中红外光谱用于官能团归属分析。
目前, 傅里叶红外光谱(Fourier transform infrared spectroscopy, FTIR)技术, 作为一种主要病原菌检测技术, 该光谱提供分子振动吸收谱带, 可以检测分子基团及其周围环境变化。 通过FTIR光谱可以获得微生物内的核酸、 蛋白质和脂类等其他生物大分子振动和转动信息, 实现对微生物的鉴定和测量。 傅里叶红外光谱有三种测量模式, 即透射、 漫反射和衰减全反射(见图5)[35]。 通常根据样品的光学特性选择合适的红外光谱测量模式。 目前, 该技术已用于识别和区分不同水体病原菌。 Vargas等[36]开发了一种水体病毒自动连续监测系统。 将病毒收集在衰减全反射晶体上, 利用红外光谱特征可以区分脊髓灰质炎病毒和MS2噬菌体, 对于自来水样品检测限可达到103 pfu· mL-1。 Erukhimovitch等[37]利用傅里叶变换红外显微技术, 由光谱区分感染疱疹病毒、 细菌或真菌污染的Vero细胞。 李兆杰等[38]建立了4种志贺氏菌的FTIR光谱库, 使用聚类方法结合化学计量学方法, 实现了4种志贺氏菌快速分型。
拉曼光谱技术是一种基于单色光与样品相互作用时的非弹性散射技术。 当某一频率的单色光与样品相互作用时, 光被散射后波长产生变化, 这一现象称为拉曼散射效应。 入射光和散射光之间的波长变化取决于引起拉曼散射的化学键, 这使得拉曼光谱在分子结构检测上具有优势。 病原菌内核酸、 蛋白质、 脂类和糖类可生成特异性拉曼光谱, 微生物的拉曼光谱能够提供蛋白质、 核酸、 脂质和碳水化合物的化学成分和生物分子结构信息[39]。
近年来, 拉曼光谱已应用于水体不同病原菌分类鉴定。 如Escoriza等[40]利用拉曼光谱和成像技术对水中细菌微生物进行区分和定量。 Silge等[41]利用拉曼光谱对瓶装天然矿泉水中铜绿假单胞菌进行了鉴定, 并研究了不同水生环境条件, 如pH值、 矿物含量、 生长期对水体假单胞菌的影响。 由于拉曼光谱信号非常微弱, 目前出现各种应用于鉴定水体病原菌的是增强拉曼光谱技术, 如共振拉曼光谱、 紫外共振拉曼光谱和表面增强拉曼光谱等。 Grun等[42]利用二维共振拉曼光谱技术, 实现对不同细菌种类的鉴定, 准确率可达95%以上。 Jarvis等[43]利用紫外共振拉曼光谱获得整个病原体的指纹图谱, 结合化学计量学聚类分析方法, 实现对细菌样本鉴定, 并提高检测灵敏度。 Fan等[44]利用表面增强拉曼光谱(SERS)鉴别水源性病毒, 包括诺如病毒、 腺病毒和轮状病毒, 其检测限达到102滴度。 Grow等[45]利用表面增强拉曼光谱技术识别三种隐孢子虫(C. parvum, C. hominis and C. meleagridis)甚至达到亚种水平, 并发现新鲜卵囊(数月龄)和旧卵囊(12岁以上月)的拉曼光谱具有不同的指纹。
太赫兹(THz=1012 Hz)光谱, 也称为远红外光谱, 是一种利用微波和红外波长(0.1~1 mm)之间的电磁辐射技术, 其光谱是由分子结构决定。 即该光谱高度依赖于分子间的相互作用, 如氢的扭转和振动, 以及整个分子的伸展[46]。 太赫兹光谱的解析与红外光谱和拉曼光谱类似, 并补充了中红外光谱提供了结构信息。
与其他红外技术相比, 太赫兹光谱发展较慢, 可归因于难以产生和探测太赫兹辐射的仪器。 然而, 近15年来, 新半导体的太赫兹源和紧凑太赫兹探测器的开发, 当监测微生物分子低频集体振动模式时, 太赫兹光谱有望成为一个非常有用的技术手段。
由于太赫兹辐射与细菌组分的低频分子运动之间的相互作用, 产生细菌特定光谱特征, 使得太赫兹光谱能够用来检测细菌细胞。 THz光谱能够表征细胞成分的差异, 成为一种快速、 无标签的细菌检测方法。 余闻静等[47]利用太赫兹光谱对不同致病菌进行检测, 表明不同致病菌具有不同的生物成分组成和结构。 Mazhorova等[48]利用一种悬浮磁芯太赫兹光纤基模消逝场的大肠杆菌传感器, 检测浓度在104~109 cfu· mL-1范围内的大肠杆菌, 检测限达到104 cfu· mL-1。 Yang等[49]利用THz光谱区分四种细菌, 同时快速评估被测细菌的生存状态。
光谱检测技术具有低能量、 无创、 无损、 响应时间快和便于实时监测等优势, 有望成为一类快速、 简便的水源性病原菌检测与鉴别的方法。 各自光谱检测技术在病原菌检测中取得良好的效果, 但也各有利弊。 (1)紫外可见光谱技术, 由于已商业化的紫外可见光谱仪器结构紧凑, 价格便宜, 性能稳定, 使得该技术在水环境微生物污染监测应用中很有吸引力。 但由于水体病原菌对光产生散射效应, 光谱解析存在较大的困难。 (2)荧光光谱技术可以实现水体病原菌的检测, 已有实现自动化和商业化的检测仪器, 如TECTA[50]和Shaw水系统[51], 自动化的检测方法可以实现快速的现场检测, 易于操作, 能够节省技术人员时间。 但需要昂贵的荧光试剂, 并存在光漂白以及特异性问题; (3)红外光谱包含水体病原菌较全面的化学信息(核酸、 蛋白质、 脂类和糖等), 可以对病原菌进行快速可靠分析, 同时检测细菌微生物损伤。 但由于水对红外光吸收很强, 会掩盖光谱中出现的微生物重要信息; (4)拉曼光谱技术只需要小面积和少量的样品, 实现单个病原菌的测量, 同时由于光谱对水不敏感, 有望提供病原菌的组成、 结构和含量等信息。 但光谱信号较弱, 微生物内部分生物分子在拉曼散射区发出荧光, 造成明显地光谱干扰。 (5)太赫兹光谱技术具有测量快速、 操作简单、 免试剂和携带方便等特点, 同时能够监测细菌细胞的微小形态变化。 但由于太赫兹辐射波长与细菌大小不匹配, 使得灵敏度受限, 同时太赫兹光谱强吸水性, 细胞外的水影响了病原菌检测的准确性。 可见, 在选择水源性病原菌监测的光谱技术时, 必须考虑病原菌本身特性、 监测目的(鉴定、 定量和控制)和成本等各种因素, 进而选择合适的光谱技术和相关的采集方式。
与传统检测技术相比, 光谱技术对水体病原菌检测具有快速、 无损、 连续在线检测等优势, 但当前用于水源性病原菌检测的光谱技术的病原菌种类较少, 适用范围较窄。 另外, 某些目标病原菌的检出限、 灵敏度无法满足当前水质监测要求。 而且大多数水源性病原菌光谱检测技术在实验室取得了良好效果, 对于实际水环境的应用还存在着一定的难度, 需要考虑其他各类污染物的影响。 因此, 基于光谱技术用于水体病原菌检测需要从以下几个方面进一步研究: (1)进一步探究水体其他物质(有机物、 藻类, 无机盐等)对病原菌光谱的影响, 采取合适的实验方法或光谱分析手段去除其他物质对目标光谱的干扰。 (2)各种光谱技术具有各自独特的优势, 将多种光谱技术优点结合起来开发更先进的检测系统, 实现对水体病原菌快速准确检测。 (3)开发便携化、 小型化、 自动化病原菌检测仪器。 现有的光谱病原菌检测技术大多依赖于实验室环境, 复杂的水体环境要求检测仪器能够满足样品的现场快速检测, 便携式的仪器将有利于对某些突发状况、 现场检测分析等。 (4)由于水体病原菌部分光谱检测技术还处于研究初期, 研究进一步提高光谱技术测量微生物的灵敏度和准确度, 从而测量低浓度病原体的环境样品, 有望实现对水体病原菌高灵敏检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|