作者简介: 景建元, 1990年生,中国农业科学院农业资源与农业区划研究所博士研究生 e-mail: jyjing90@163.com
尿素生产过程中加入腐植酸生产腐植酸增值尿素, 可以有效延缓尿素水解, 提高作物产量与氮肥利用效率, 然而在此过程中腐植酸(HA)与尿素(U)主要发生什么反应还未见报道。 利用风化煤源HA生产含腐植酸5%, 10%及20%的腐植酸增值尿素(HAU5, HAU10及HAU20), 采集并分析了HAU5, HAU10, HAU20及U的红外谱图及其二阶导数谱图, 用XPS与O(1s)NEXAFS分别对HAU20, HA及U进行表征; 通过无水乙醇溶解HAU20的方式去除了HAU20中的尿素, 并利用FTIR与XPS对醇不溶物(UHA)进行表征。 结果表明: (1)FTIR原谱图及二阶导数谱图表明, 腐植酸增值尿素伯胺C—N振动强度低于普通尿素, 且振动强度随着HA添加量的提高而降低, XPS N(1s)与O(1s)NEXAFS检测到HAU20中分别存在较多仲胺氮与非羰基氧, 且FTIR发现UHA酰胺特征明显, 表明腐植酸增值尿素制备过程中HA与U发生了反应。 (2)XPS C(1s)表明, HAU20与UHA羧基碳比例少于HA, FTIR结果表明, UHA中不存在HA中检测到的羧酸C—O—H面内弯曲振动, 羧基C=O伸缩振动位置发生偏移且伯胺氮特征明显, 表明腐植酸的羧基参与了HA与U的反应, 且反应方式为腐植酸羧基C—OH化学键断裂, 与尿素胺基结合, 脱水形成R—CO—NH—CO—NH2。 因此, 采用光谱分析明晰了腐植酸增值尿素制备过程中, 腐植酸与尿素的主要反应方式, 这将为腐植酸增效尿素机理揭示以及增值尿素研制提供基础资料。
Humic acid-enhanced urea (HAU) can be produced by adding humic acid (HA) into melted urea during urea production. Field studies have proved that HAU showed a better urea hydrolysis rate, crop yield, and nitrogen use efficiency than normal urea (U). However, the main reaction between HA and U during the production of HAU has not been reported yet. In this study, HA, derived from weathered coal, was used to produce HAU, and the added amount of humic acid was 5%, 10%, and 20%, respectively (named HAU5, HAU10, HAU20). The paper collected and analyzed the infrared spectra and their second derivative infrared spectra of HAU5, HAU10, HAU20, and U. HAU20 and U were characterized using X-ray photoelectron spectroscopy (XPS), and oxygen 1s near-edge X-ray absorption fine structure (NEXAFS). The urea in HAU20 was removed by dissolving HAU20 with absolute ethanol, and FTIR and XPS characterized the residue(UHA). The result showed that: (1) FTIR spectra and the second derivative spectra showed that the vibration intensity of primary amine C—N in HAU was lower than that in U, and the vibration intensity decreased with the increase of the addition amount humic acid. There were more secondary amine nitrogen, and non-carbonyl oxygens in HAU20 were separated from the XPS N(1s) spectra and O(1s) NEXAFS spectra, respectively, and prominent amide characteristics were shown from the result of FTIR spectra for UHA, which indicated that HA reacted with urea during the HAU production. (2) the percentage of carboxyl carbon in HAU20 or UHA was lower than in HA. FTIR spectra showed that C—O—H in-plane bending vibration from carboxylic acid detected in HA did not exist in UHA, the C=O stretching vibration position from carboxyl groups in UHA was shifted, and the characteristics of primary amine nitrogen for UHA were obvious. The above indicated that the carboxyl groups of HA participated in the reaction of HA and urea. The structure for R—CO—NH—CO—NH2 in HAU will be produced after the dehydration reaction between the carboxyl group of HA and the amide group of urea. Therefore, the results from the spectral analysis used in this study clarified the main reaction modes of humic acid and urea during the production of HAU, which will provide basic information for the reveal of the synergistic mechanism of HAU and the development of value-added urea.
尿素因其含氮量高而成为我国主要使用的氮肥品种。 然而, 尿素施用到土壤(尤其是我国北方石灰性土壤)中极易发生水解, 进而造成氮素损失[1]。 尿素生产过程中, 加入腐植酸生产腐植酸增值尿素, 可以有效提高作物产量, 减少氮素损失, 提高氮肥利用效率[2]。
李军等[3]施用含1%~20%腐植酸的腐植酸增值尿素, 发现玉米籽粒产量较普通尿素可以提高6%~17%。 张水勤等[4]也报道, 与普通尿素相比, 施用腐植酸增值尿素, 玉米产量可以提高6%~19%。 此外, 腐植酸增值尿素也可以提高小麦产量。 刘艳丽等[5]研究腐植酸增值尿素的产量效应, 发现腐植酸增值尿素较普通尿素可以显著提高小麦产量15%~28%。 刘红恩[6]等也报道, 施用腐植酸增值尿素可以改善小麦产量构成要素, 籽粒产量可提高11%以上。
施用腐植酸增值尿素, 也可以减少氮素损失, 提高氮肥利用效率。 袁亮等[7]利用土柱15N示踪技术, 发现腐植酸增值尿素较普通尿素, 小麦地上部吸收的肥料氮显著提高7.4%, 氮肥表观利用率提高15.6个百分点, 肥料氮损失率降低9.5个百分点。 李军等[3, 8]也报道, 腐植酸增值尿素可以显著提高玉米地上部及籽粒肥料氮吸收量, 减少肥料氮损失量, 提高氮肥利用效率。 同时, 施用腐植酸增值尿素, 氨挥发量可以减少4.5%~9.8%[9]。
腐植酸增值尿素较普通尿素表现出良好的农学效应, 可能与腐植酸与尿素发生反应, 进而延缓尿素分解有关。 梁宗存与成绍鑫等[10]认为, 腐植酸与尿素之间可以发生离子化、 络合配位、 自由基反应、 氢键缔合、 亲核加成等反应, 腐植酸的羧基[11], 酚羟基、 羰基, 醌基, 酯(醚)键等[12]均参与了二者的反应。 然而, 腐植酸增值尿素制备过程中, 腐植酸的添加量(0.2%~5%)偏低, 且加入腐植酸后, 腐植酸与熔融尿素接触时间较短。 腐植酸增值尿素制备过程中, 腐植酸是否与尿素发生反应, 主要发生什么反应, 相关研究有待深入。 进行相关研究, 将有利于进一步揭示腐植酸增效尿素机理, 对增值尿素的研制及氮肥高效利用提供理论依据。
通过对传统“ 碱溶酸析” 法进行改进[13], 从风化煤(内蒙古自治区通辽市霍林郭勒市霍林河; 45° 23'N, 119° 15'E)中提取与纯化得到腐植酸(HA)。
将装有80 g尿素(国药)的烧杯置于电热炉上加热, 搅拌至尿素呈熔融状态; 将20 g HA加入烧杯中, 继续搅拌1 min至混合均匀, 冷却后粉碎, 过筛(20目), 制得含20%腐植酸的腐植酸增值尿素(HAU20)。 参考HAU20制备方法, 分别制备含5%与10%腐植酸的腐植酸增值尿素(HAU5与HAU10), 同时制备熔融但不添加腐植酸的尿素(U)。
为了证明HA与尿素发生了反应, 依据尿素易溶于无水乙醇的原理, 使用无水乙醇溶解HAU20, 将HAU20中的尿素去除, 通过对醇不溶物进行表征, 判断二者是否发生了反应。 提取过程如下: 将HAU20与无水乙醇按固液比1:20混匀, 充分搅拌后, 以5 000 r· min-1的速度离心10 min; 去除上清液, 将醇不溶物转移到烧杯中, 加入与上一步相同体积的无水乙醇, 再次以5 000 r· min-1的速度离心10 min; 去除上清液后, 将不溶物置于室温下风干; 将风干后的不溶物粉碎后过筛(20目), 得到腐植酸与尿素的反应产物(UHA)。
1.2.1 傅里叶变换红外光谱表征
对HA, U, HAU5, HAU10, HAU20与UHA的傅里叶红外变换光谱特征进行表征: 准确称取2 mg各样品和200 mg KBr(光谱纯)粉末, 在玛瑙研钵中研磨均匀后, 使用压片机压片, 采用傅里叶变换红外光谱仪(Nicolet iS20, Thermo Fisher Scientific, 美国)记录4 000~400 cm-1区域红外光谱数据, 以KBr片取背景, 扫描光谱的分辨率为4 cm-1, 扫描次数32。
1.2.2 X射线光电子能谱测定
使用X射线光电子能谱仪(ESCALab250, Thermo Fisher Scientific, 美国)分别对HA, U, HAU20以及UHA的表面元素组分, 化学价态和形式进行表征, 以Al Kα 射线作为激发源, 功率为150 W。 分析时的基础真空约为6.5× 10-10 mbar, 结合能用烷基碳C(1s)峰(284.8 eV)校正。
1.2.3 O K-edge X射线近边吸收光谱
HA, U及HAU20的O K-edge X射线近边吸收光谱(NEXAFS)在中国科学技术大学国家同步辐射实验室(NSRL)的BL10B站实验检测。
傅里叶变换红外光谱图用OMNIC 9.0软件进行基线校正和数据平滑校正, 并获取二阶导数谱图(Savitsky-Golay算法, 点数7, 多项式项数2)。 X射线光电子能谱数据使用XPSPEAK软件进行分峰。 所有数据采用Origin2021(Origin Lab Corporation, MA, USA)进行绘图。
腐植酸增值尿素与尿素(U)具有相似的傅里叶红外光谱特征峰, 与腐植酸(HA)存在较大差异[图1(a)]。 与U相同, HAU5, HAU10及HAU20酰胺特征明显, 均检测到了伯胺NH2反对称伸缩振动(3 444 cm-1)、 NH2对称伸缩振动(3 344 cm-1)、 伯胺C=O伸缩振动(1 683 cm-1)、 NH2变角振动(1 626与1 600 cm-1)、 N— H弯曲和C— N伸缩混频振动(1 464 cm-1)以及脂肪族伯胺C— N伸缩振动(1 156 cm-1)[14]。 进一步对尿素与腐植酸增值尿素的红外光谱二阶导数谱图进行分析[图1(b)], 发现其在1 155 cm-1附近出现较大差异[图1(b)]。 其中, 各腐植酸增值尿素振动强度均低于普通尿素, 且随着腐植酸添加量的提高, 振动强度降低。 这说明腐植酸与尿素发生了反应, 尿素中伯胺氮含量减少, 导致尿素伯胺C— N的振动强度降低, 且反应程度随着腐植酸添加量的提高而提高。
由XPS全谱图[图2(a)]可知, U主要含有C, N与O三种元素; HA主要含有C与O两种元素, 含N量偏低, 与国际腐植酸协会(IHSS)对腐植酸标准样品的介绍相符[15]; HAU20主要含有C, N与O三种元素, 但是由于HAU20中HA添加量为20%, 因此HAU20 N(1s)强度低于U。 图2(b— d)分别为HA, HAU20及U的XPS C(1s)分峰拟合图。 由XPS C(1s)分峰拟合结果可以看出, HA中的碳主要以C— C/C— H(284.7 eV)、 C— O(285.1 eV)、 羧基碳 (O=C— O, 285.9 eV)与羰基碳(C=O, 288.8 eV)的形式存在[16], 这四种形式的碳分别占40.31%, 30.22%, 13.81%与15.66%。 U含有两个不同类型的碳, 其中结合能284.9 eV的碳属于空气中的污染碳, 不参与碳类型的认定, 因此U中的碳仅以羰基碳(C=O, 289.2 eV)的形式存在。 HAU20中检测到了与HA相同的碳类型, 分别为C— C/C— H(284.7 eV)、 C— O(285.2 eV)、 羧基碳(O=C— O, 286.0 eV)与羰基碳(C=O, 288.8 eV), 其中, 由于HA与尿素反应, HAU20中羰基碳所占比例(16.93%)较HA(15.66%)有所提高(表1)。 同时HAU20中羧基碳所占比例(12.80%)低于HA(13.81%), 说明羧基可能是二者反应的主要官能团[11]。
 | 图2 XPS全谱(a)与HA(b), HAU20(c), 及U(d)C(1s)分峰拟合图Fig.2 The XPS full spectra (a) and C(1s) peak fitting spectra of HA (b), HAU20 (c), and U (d) |
| 表1 HA, HAU20及U表面C(1s)峰中各形态碳的比例(%) Table 1 XPS peaks (C1s) attribution and the relative content (%) of carbon species for HA, HAU20 and U |
图3为HA, HAU20与U的XPS N(1s)分峰拟合图。 HA表面氮类型主要为吡啶N-6与吡咯N-5[17], 但是由于HA 含氮量较低, 本研究未对HA N(1s)进行分峰, 而将其统一为腐植酸氮[NHA, 图3(a)], 结合能为400.0 eV。 U表面氮类型主要为伯胺氮[Primary amine-N, 图3(c)], 结合能为399.7 eV。 然而HAU20除了在400.6与400.0 eV分别检测到NHA与伯胺氮外[图3(b)], 同时在399.4 eV检测到了仲胺氮[Secondary amine-N, 图3(b)], 且NHA、 伯胺氮与仲胺氮的含量分别为17.19%, 39.54%与43.28%(表2)。 HAU20中NHA与仲胺氮的结合能均大于HA中NHA的结合能以及U中伯胺氮的结合能, 表明HAU20中NHA与仲胺氮化学环境发生了变化, 腐植酸与尿素发生了反应, 产生了仲胺氮。
 | 图3 HA(a), HAU20(b), 及U(c)XPS N(1s) 分峰拟合图Fig.3 XPS N(1s) peak fitting spectra of HA (a), HAU20 (b), and U (c) |
| 表2 HA, HAU20及U表面N(1s)峰中各形态氮的比例 Table 2 XPS peaks [N(1s)] attribution and the relative content (%) of nitrogen species for HA, HAU20, and U |
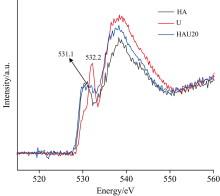
HA, U及HAU20的O(1s) NEXAFS如图4所示, 三者O-K-edge光谱特征相似, 均在530~535 eV左右存在边前峰, 在540 eV左右存在边后宽峰。 不同之处在于边前尖峰出现的位置与强度不同。 U的边前峰出现在532.2 eV, 边后峰出现在538.0 eV, 这是羰基氧存在的标志[18]。 与U不同, HA边前峰出现在531.1 eV, 边后峰出现在538.2 eV, 说明HA中氧主要来源于羧基[18]。 然而, 实验中HAU20的边前峰变宽(529.7~532.7 eV), 边后峰出现在538.3 eV左右, 分析认为由于腐植酸与尿素发生了反应, 导致腐植酸增值尿素中不止存在羰基氧, 还存在其他类型的氧, 这与XPS C(1s)结果相符[图2(a)]。
实验中又使用无水乙醇溶解HAU20, 由于尿素易溶于 无水乙醇, 将HAU20中的尿素去除, 通过对醇不溶物(UHA)进行傅里叶红外光谱与X射线光电子能谱表征, 判断腐植酸与尿素如何发生反应。 从UHA傅里叶红外光谱可以看出, 其与HA存在较大差异[图5(a)], 并出现几个新的特征峰。 结合腐植酸增值尿素傅里叶红外光谱, UHA在3 500~3 300 cm-1存在羟基与酰胺基中NH2反对称伸缩振动混合峰; 在1 677与1 605 cm-1处存在酰胺伸缩振动双峰; 同时UHA中1 677 cm-1也可能为羧基C=O伸缩振动峰, 由于与尿素反应, 波数从1 709 cm-1(HA)偏移到了1 677 cm-1处[14]。 同时, UHA XPS C(1s)结果表明, UHA羧基碳含量为11.59%[图5(b)], 而HA为13.81%(表1), UHA羧基碳含量少于HA。 另外, 与HA相比, UHA在1 415 cm-1左右羧酸C— O— H面内弯曲振动消失。 以上结果均说明HA与尿素反应的主要官能团是羧基[11]。 同时UHA在1 453, 1 402, 1 257与1 155 cm-1处产生了伯酰胺C— N伸缩振动, 这说明尿素与腐植酸反应产物中, 伯胺氮特征明显。 与前期研究发现柠檬酸或水杨酸改性尿素制备过程中, 柠檬酸或水杨酸的羧基会与尿素的酰胺基发生脱水反应结果相一致(待刊)。 因此本研究推测腐植酸增值尿素制备过程中, 腐植酸与尿素反应方式为尿素分子一端— NH2脱— H与腐植酸羧基脱— OH, 形成新的伯胺氮(R— CO— NH— CO— NH2)。
(1)采用傅里叶红外光谱及其二阶导数谱图, 发现腐植酸增值尿素特征峰振动强度低于普通尿素, 且随着腐植酸添加量的提高, 伯胺C— N振动强度降低; 通过X射线光电子能谱N(1s)发现, 腐植酸增值尿素(HAU20)中存在较多仲胺氮; O(1s)X射线近边吸收光谱表明, HAU20中不止含有羰基氧; 采用无水乙醇去除HAU20中尿素后, 发现醇不溶物(UHA)傅里叶红外光谱特征不同于腐植酸(HA), 且表现出更多的酰胺特征, 以上结果表明腐植酸增值尿素制备过程中腐植酸与尿素发生了反应, 二者反应将有利于延缓尿素的释放, 减少氮素损失。
(2)X射线光电子能谱 C(1s)表明, HAU20以及UHA羧基碳相对比例低于HA; 与腐植酸相比, UHA中羧酸C— O— H面内弯曲振动消失, 且羧基C=O伸缩振动位置发生偏移。 推测腐植酸的羧基参与了腐植酸与尿素的反应。 傅里叶变换红外光谱表明UHA伯胺氮特征明显, 推测腐植酸增值尿素制备过程中, 腐植酸与尿素的反应方式为腐植酸羧基处C— OH化学键断裂, 与尿素胺基结合, 脱去一分子水, 形成R— CO— NH— CO— NH2。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|