作者简介: 钱成, 1988年生,上海应用技术大学化学与环境工程学院硕士研究生 e-mail: 316353009@qq.com
通过使用适配体、 十六烷基三甲基溴化铵(CTAB)、 三聚氰胺和环丙氨嗪控制金纳米粒子的聚集和分散, 设计了简单的双与门逻辑开关用来检测牛奶中的三聚氰胺和环丙氨嗪。 首先, 基于适配体T31与三聚氰胺的强特异性, 通过CTAB的加入控制纳米金的聚集, 制作了一个与门逻辑开关(AND logic gate 1)检测是否存在三聚氰胺。 此逻辑开关用肉眼可识别的三聚氰胺检出限为0.24 mg·L-1, 借助分光光度计的检出限(LOD)为85 μg·L-1。 根据适配体Tcy1与环丙氨嗪的强特异性, 通过CTAB的加入控制纳米金的聚集, 设计了与门逻辑开关(AND logic gate 2)。 此逻辑开关用肉眼可识别的检出限为0.17 mg·L-1, 借助分光光度计的检出限(LOD)为9.0 μg·L-1。 因此, 通过这一逻辑开关组可以实现牛奶中三聚氰胺和环丙氨嗪的快速检测。
In this paper, we developed a simple design and a detection method for AND logic gates by using aptamers, Cetyltrimethyl Ammonium Bromide (CTAB), and melamine and cyromazine to control the aggregation and dispersion of gold nanoparticles (AuNPs). First, Based on the fact that aptamer T31 can specifically bind with melamine, and CTAB immediately resulted in the aggregation of AuNPs, an AND gate was fabricated to find whether there was melamine. It also has a detection limit of 0.24 mg·L-1 by the naked eye to detect melamine, and the limit of detection (LOD) by a spectrophotometer is 85 μg·L-1. Second, with the adsorption of aptamer Tcy1 on AuNPs and the strong coordination of Tcy1 with cyromazine, the addition of cyromazine and CTAB immediately resulted in the aggregation of AuNPs, giving rise to another AND gate. It also has a detection limit of 0.17 mg·L-1 by the naked eye, and the limit of detection (LOD) is 9.0 μg·L-1 by spectrophotometer. So, these logic gates can be used to detect melamine and cyromazine in raw milk.
最初, 三聚氰胺(Mel)是作为一种工业化合物使用的。 由于三聚氰胺含氮量很高, 达到66%, 因此被不法商贩非法添加到动物饲料和原料奶中, 假冒增加蛋白质的含量[1, 2, 3]。 三聚氰胺是环丙氨嗪的一种降解产物[4], 高剂量的三聚氰胺可导致肾结石和肾衰竭[5]。 环丙氨嗪(Cyr)是一种三嗪类昆虫生长抑制剂, 广泛应用于畜禽业中控制苍蝇和蛆[6]。 环丙氨嗪的过度使用会导致动物源食品污染, 产生一系列潜在的环境问题, 并且通过食物链的富集作用危害人类健康[7]。 已有研究证实它能引起小鼠乳腺肿瘤[8]。 因为, 动物源食品在进入市场前必须按照国家标准对环丙氨嗪和三聚氰胺的残留进行检测, 所以如何现场检测环丙氨嗪和三聚氰胺的残留已成为动物源性食品和原料奶生产的热点问题[9, 10, 11]。 美国FDA将在动物源食品中环丙氨嗪的最大残留限量(MRLs)设定为0.05~0.5 μg· kg-1; 中国规定原料奶中三聚氰胺的安全限量为2.5 mg· L-1。
电子集成电路系统由基本逻辑开关组成, 它们能够通过接收表示真(1, 高电压)或假(0, 低电压)值的布尔输入并产生适当的布尔输出来执行布尔逻辑。 分子逻辑开关使用逻辑开关概念构建生物传感器, 为检测问题提供了一种可能的解决方案[12]。 根据值和输入之间的关系, 可以获得广泛的逻辑函数, 包括非门(NOT gate), 与门(AND gate), 或门(OR gate), 或非门(NOR gate), 抑制门(INHIBIT gate)等。 在过去的几十年里, 基于超分子复合物和小分子、 酶生化网络[13]、 生物聚合物-配体和光子相互作用[14]和其他系统的各种分子逻辑开关已经被设计出来。 这些光和电信号形式的逻辑开关是对特殊输入刺激的响应。 比色信号的逻辑开关成本低、 速度快, 尤其是能通过肉眼识别, 这些特点使它的应用范围非常广泛。 在全新的研究中表明, 基于金纳米粒子的高消光系数和强距离依赖性光学特性的均匀比色检测方法变得越来越有吸引力[15, 16]。
核酸适配体能够以高亲和力和靶标特异性结合[17], 已被广泛用作生物传感器[18]构建中的识别元件[19, 20, 21]。 在以往研究中, 曾利用胸腺嘧啶和氨基之间的氢键, 设计了一系列适配体修饰的纳米金探针, 用来检测牛奶中的三聚氰胺或环丙氨嗪[22, 23]。
采用金纳米粒子设计逻辑开关, 一般需要用有机配位剂对金纳米粒子进行修饰。 Du等设计了一种含有三聚氰胺和Hg2+的游离金纳米粒子的比色逻辑开关[24]。 Huang等采用谷胱甘肽、 金属离子和乙二胺四乙酸控制金纳米粒子分散和聚集的装置, 开发了系列简单的逻辑开关[25]。 此外, 有研究人员基于金纳米粒子的分散和聚集状态, 设计了三个输入信号的比色逻辑开关, 用于检测三聚氰胺、 半胱氨酸和Hg2+[26]。 上述方法只为三聚氰胺检测设计了一个逻辑开关[24, 26]。 而Huang等尽管设计了三个逻辑开关, 但是开关之间没有直接的逻辑关系, 只是简单的罗列了三个逻辑开关形式[25]。 本研究基于三聚氰胺和环丙氨嗪的适配体, 借助纳米金设计了两个与门逻辑开关, 将待测溶液分别通过两种逻辑开关, 可以检测出牛奶中三聚氰胺和环丙氨嗪的含量。 通过设计双与门逻辑开关组, 首次开发出同时检测三聚氰胺和环丙氨嗪的快速检测逻辑开关组, 可以用于现场同时检测牛奶中的三聚氰胺和环丙氨嗪。
核酸适配体序列如下:
Tcy1 5’ -GGTTGGTTGGTTGGTT-3’ (16 bp),
T31
5’ -TTTTTTTTTTTTTTTTTTTTTTTTTTTTTTT-3’ (31 bp)。
上述核酸适配体由生工生物工程(上海)股份有限公司合成。
氯金酸、 柠檬酸三钠、 十六烷基三甲基溴化铵(CTAB)、 氨苯胺、 氨苯胺、 苯胺、 L-酪氨酸、 三聚氰酸、 L-赖氨酸、 L-盐酸赖氨酸、 环丙氨嗪、 三聚氰胺等均为分析纯。 所有试剂和缓冲溶液均用超纯水(电阻率18 MΩ · cm)配置, 实验中所用原料奶采购自光明乳业的一个原料奶厂, 具体见表2。
| 表2 实验试剂 Table 2 Experimental reagents |
在10 mL离心管中向1.0 mL原料奶样品中加入5 mL 1%乙酸, 混合均匀后在室温下孵育5 min。 样品以10 000 r· min-1的速度离心10 min, 将上清液与白色不透明沉淀分离后, 取上清液。 用2.0 mol· L-1氢氧化钠溶液将pH值调节至8.0。 用纯水稀释至最终溶液体积。
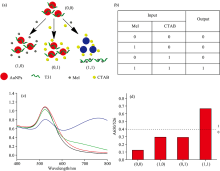
在AND逻辑开关1中, 当两个输入都为“ true” 时, 输出为“ true” 。 否则, 输出为“ false” 。 将表面包裹了T31的AuNPs (0.24 mM)溶液加入到试管中。 逻辑开关是通过不同组合和顺序的输入来实现: (1) H2O (0, 0); (2) 0.5 mg· L-1环丙氨嗪(1, 0); (3) 1.8 μmol· L-1 CTAB (0, 1); (4) 0.5 mg· L-1环丙氨嗪+1.8 μmol· L-1 CTAB (1, 1)。
在AND逻辑开关2中, 当两个输入都为“ true” 时, 输出为“ true” 。 否则, 输出为“ false” 。 将表面包裹了Tcy1的AuNPs (0.24 mmol· L-1)溶胶加入到试管中。 逻辑开关是通过不同组合和顺序的输入来实现的: (1) H2O (0, 0); (2) 0.5 mg· L-1环丙氨嗪(1, 0); (3) 1.8 μmol· L-1 CTAB (0, 1); (4) 0.5 mg· L-1环丙氨嗪+1.8 μmol· L-1 CTAB (1, 1)。
为了检测溶液中是否含有三聚氰胺, 首先设计了AND逻辑开关1, 将适配体T31包裹在纳米金表面, 并使用T31和三聚氰胺作为两个输入[27]。 单链核酸适配体T31可以通过分子间作用力和疏水作用结合在纳米金表面, 也可以通过电荷作用和十六烷基三甲基溴化铵(CTAB)相结合, 保护纳米金在高浓度的电解质中不被聚集[22]。 在体系没有三聚氰胺的情况下, AuNPs在T31的保护中不会聚集和改变颜色。 当体系中存在三聚氰胺时, T31可以通过氢键与三聚氰胺结合。 T31与三聚氰胺的特异性远强于环丙氨嗪或其他含氨基类化合物[20], 因此三聚氰胺的加入会特异性结合T31, 使AuNPs失去保护, 在CTAB的作用下产生聚集。 因此可以用肉眼观察到溶液的颜色从红色变为蓝色[图1(a)]。
如图1(b)所示, 三聚氰胺、 T31作为逻辑开关的信号输入, 它们的存在与否被定义为“ 0” 和“ 1” [图1(b)]。 当A650/A526比值≥ 0.4时, 把输出值定义为“ 1” 。 当比值< 0.4时, 把输出值定义为“ 0” [图1(d)]。 当溶液中含有T31时, 只有溶液中存在三聚氰胺的情况下, 溶液颜色才会从红色变为蓝色, 样品的吸收曲线可直接反映出此变化。 当溶液颜色由红变蓝时, 纳米金526 nm吸光度显著降低, 而650 nm处吸光度显著增大[图1(c)]。 因此, AND逻辑开关1可以用检测体系中是否含有三聚氰氨, 而用A650/A526的比值代替单一吸光度度值作为信号输出可以更敏锐地反映信号变化。 因此, AND逻辑开关1可以用于检测体系中是否含有三聚氰胺。 当T31输入值为“ 1” , 且输出值为“ 1” 时, 表示溶液中肯定含有三聚氰胺。 可以仅通过肉眼就判断溶液中是否有三聚氰胺[图1(c)]并且通过AND逻辑开关1的标准曲线来检测牛奶中三聚氰胺的浓度。
AND逻辑开关1的输出情况可以通过透射电子显微镜直观地证明。 如图2所示, 在不含Mel和CTAB的情况下, AuNPs分散良好如图2(a)。 在只含有三聚氰胺的情况下, 包裹在纳米金表面的和游离的T31与三聚氰胺通过氢键结合, 因此, AuNPs仍然处于分散状态, 如图2(b)。 当体系中只有CTAB时, T31一部分通过分子间作用力包裹在AuNPs表面, 另一部分会通过电荷作用与CTAB形成复合物, 保护AuNPs不被聚集, 如图2(c)。 在三聚氰胺和CTAB同时存在的情况下, Mel可以通过氢键和T31相结合, AuNPs失去保护, 在CTAB的作用下聚集[如图2(d)]。
 | 图2 AND逻辑开关1的透射电子显微镜(TEM)图像 (a): (0, 0); (b): (1, 0); (c): (0, 1); (d): (1, 1)Fig.2 Transmission electron microscopy (TEM) images of AND logic gate 1 (a): (0, 0); (b): (1, 0); (c): (0, 1); (d): (1, 1) |
2.1.1 检测体系pH的优化
三聚氰胺的水溶液呈弱碱性, pH值为8.0, 因此溶液pH会影响三聚氰胺的溶解度。 当然, pH值也会影响纳米粒子的表面电荷。 经过简单的预处理, 用HCl和NaOH调节溶液的pH值, 以找到AND逻辑开关1的最佳pH值。 在强碱性的条件下(pH> 12.0), 三聚氰胺会失去所有的氨基而转化为氰尿酸, 不会与适配体T31结合, CTAB无法正常聚集AuNPs, 如图3(b)所示, 吸收率比值(A650/A526)非常低。 在 强酸性条件中(pH< 2.0), 吸收率比值(A650/A526)变得高得多, 这是因为纳米粒子的表面电荷被破坏了。 在pH 8.0时, 吸光度比值是在pH 4.0~13.0范围内的最大值, 因此选择pH 8.0作为检测介质的最佳pH值。
2.1.2 AND逻辑开关1中适配体(T31)浓度的优化
在AND逻辑开关1中, 核酸适配体T31会通过疏水作用包裹在纳米金表面, 并通过电荷作用保护纳米金颗粒。 太 高或太低的适配体浓度都会影响到体系的检测结果。 图3(a)显示了当0~36 nmol· L-1之间不同浓度的T31被加入到AuNPs溶液中时的颜色变化。 其中高浓度的三聚氰胺的浓度为0.50 mg· L-1, 较低浓度的为0.25 mg· L-1。 如图3(b)所示, 当T31的浓度大于18 nmol· L-1时, A650/A526的比值不再降低, 并趋于稳定。 这意味着T31的浓度足以保护所有的AuNPs颗粒不被聚集, 而过多的T31会导致浪费。 因此, 选择18 nmol· L-1的适配体浓度进行后续的研究。
2.1.3 AND逻辑开关1的响应时间
时间在AND逻辑开关1中起着重要的作用, 作为一种快速检测方法, 在满足检测要求的条件下, 方法全过程所需时间越少越好。 因此研究了不同反应时间的A650/A526比值。 如图3(c)所示, 三聚氰胺浓度越高, 650 nm处的吸光度值增加越明显。 首先, 随着时间的延长, 吸收度比值明显增加。 而反应5 min后, 该比值达到稳定值, 因为所有的AuNPs都已经聚集。 在三聚氰胺存在的情况下, 环丙氨嗪的加入会使颜色变化更加明显。 这些结果表明, 反应时间选择5 min足矣。
2.1.4 反应温度的优化
该检测体系对温度也比较敏感, 过高的温度会影响适配体的活性。 因此研究了不同浓度的三聚氰胺在不同温度下的吸光度比值。 如图3(d)所示, 由于核酸适配体的DNA活性, A650/A526的比值在50 ℃时最高。 但所设计的逻辑开关通常用于室温下的现场测试, 而20 ℃下的比值足以进行检测。 因此我们选择常温(20 ℃)作为现场试验的最佳选择。
2.1.5 AND逻辑开关1的灵敏度
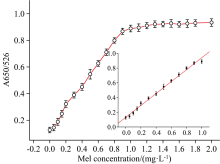
为了证明AND逻辑开关1可以用于检测牛奶中的三聚氰胺, 向原料牛奶中添加了不同量的三聚氰胺。 再向溶液中加入18 nmol· L-1 T31, 并使T31的输入为“ 1” 。 经过预处理后, 每个样品在526和650 nm测量三次。 如图4所示, 当三聚氰胺和适配体T31特异性结合后, AuNPs就失去了保护产生聚集, 与此同时溶液颜色由红色变为蓝色, 而AND逻辑开关1的输出由三聚氰胺浓度决定(“ 1” , A650/A526> 0.4; “ 0” , A650/A526< 0.4)。 根据溶液颜色的变化, 选择三聚氰胺浓度为0~0.5 mg· L-1, 记录下吸光度比值, 并拟合标准曲线。 吸光度比值与三聚氰胺浓度呈线性相关, 相关系数为0.997, 曲线拟合方程为y=0.809 9x+0.13。 通过3σ /斜率得到该传感器的检测限(LOD)为85 μg· L-1。 当三聚氰胺的浓度大于0.24 mg· L-1时, 此时A650/A526的比值大于0.4, 这意味着输出值为“ 1” , 也可以通过肉眼看到溶液颜色从红色变为蓝色。 这个浓度远远低于2.5 mg· L-1(美国FDA和欧盟规定了牛奶中三聚氰胺的最大残留限量)[22]。
2.1.6 用AND逻辑开关1检测牛奶样品中的三聚氰胺
在样品预处理之前, 在牛奶中加入不同含量的三聚氰胺, 浓度分别为0.200 0, 0.500 0和1.000 mg· L-1。 通过AND逻辑开关1, 每个样品重复检测3次, 同时用高效液相色谱-质谱(HPLC-MS)法分析同样的牛奶样品3次。 分析结果如表1所示, AND逻辑开关1的回收率在95%~105%之间。 这表明AND逻辑开关1可以用于牛奶中三聚氰胺的快速检测。
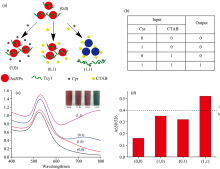
纳米金的颜色变化反映了金纳米粒子在悬浮液中的聚集状态[28], 这种聚集是通过电解质所诱导产生的[29]。 由三聚氰胺或环丙氨嗪引起的AuNPs的聚集不稳定, 容易受到干扰。 由于Tcy1可以包裹在AuNPs表面, 也可以通过电荷作用与十六烷基三甲基溴化铵(CTAB)相结合, 保护AuNPs在高浓度CTAB或其他强电解质中不聚集。 根据以上原理, 将环丙氨嗪的适配体Tcy1包裹在纳米金表面, 并以环丙氨嗪和CTAB为输入构建了AND逻辑开关2[图5(a)]。 与AND逻辑开关1类似, CTAB作为一种带正电荷的强电解质, 根据环丙氨嗪的输入值, 产生不同的作用。 在体系没有环丙氨嗪的情况下, Tcy1可以通过分子间作用力和疏水力与AuNPs结合, 也可以与CTAB结合形成复杂的结构, 因此AuNPs在Tcy1的保护下不会聚集和改变颜色。 当环丙氨嗪加入到体系中时, 胸腺嘧啶和环丙氨嗪的氨基可以形成氢键, 因此富含鸟嘌呤的Tcy1和环丙氨嗪可以形成稳定的G-四联体结构, 因而Tcy1就不再保护AuNPs, AuNPs就会在CTAB的作用下产生聚集, 因此可以通过比色测定法检测到溶液颜色从红色到蓝色的明显变化。
| 表3 应用AND逻辑开关1和HPLC-MS技术检测牛奶样品中的三聚氰胺 Table 3 Application of AND gate 1 and HPLC-MS to detect the melamine in raw milk samples spiked with different amounts of melamine |
如图5(b)所示, 环丙氨嗪和CTAB存在与否被定义为输入值“ 0” 和“ 1” 。 当A650/A526比值大于0.4时, 输出值定义为“ 1” , 否则定义为“ 0” [图5(d)]。 只有当环丙氨嗪和CTAB同时存在的情况下, 颜色才会从红色变为蓝色, 这与AND逻辑开关的功能一致[30], 不仅可以通过吸光度体现溶液颜色改变, 而且可以仅从肉眼判断溶液中是否有环丙氨嗪[图5(c)], 因此AND逻辑开关2可以用于检测环丙氨嗪的浓度。
AND逻辑开关2的输出可以通过透射电子显微镜直观地证明。 如图6所示, Tcy1导致AuNPs的粒径大小增加了一点, 因为适体通过分子间作用力和疏水作用包裹在AuNPs表面但包裹后的AuNPs依然是分散状态[图6(a)]。 当环丙氨嗪加入到体系中时, Tcy1和环丙氨嗪结合并形成稳定的G-四联体结构, 见图6(b)。 当体系中只有CTAB时, 一部分围绕在纳米粒子周围的Tcy1会通过电荷作用与CTAB形成复合物[图6(c)]。 当环丙氨嗪和CTAB加入体系中时, Tcy1与环丙氨嗪形成稳定的G-四联体结构, 而失去保护的AuNPs被CTAB聚集[图6(d)]。
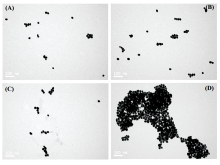 | 图6 AND逻辑开关2的透射电子显微镜(TEM)图像 (a): (0, 0); (b): (1, 0); (c): (0, 1); (d): (1, 1)Fig.6 Transmission electron microscopy (TEM) images of AND logic gate 2 (a): (0, 0); (b): (1, 0); (c): (0, 1); (d): (1, 1) |
2.2.1 AND逻辑开关2中适配体(Tcy 1)浓度的优化
在AND逻辑开关2, 部分适配体会通过分子间作用力和疏水作用包裹在AuNPS表面, 其余适配体也会和CTAB通过电荷作用结合。 图7(a)显示了当在AuNPs溶液中加入0~36 nmol· L-1的Tcy1时的颜色变化。 其中高浓度的环丙氨嗪的浓度为0.50 mg· L-1, 低浓度为0.25 mg· L-1。 如图7(a)所示, 当Tcy1的浓度大于15 nmol· L-1时, A650/A526的比值低于0.4, 与值“ 0” 一致。 因此, 当Tcy 1的浓度大于15 nmol· L-1时, 可以保护AuNPs不聚集, 而Tcy 1过多会造成浪费和过度保护, 推后CTAB对AuNPs的聚集作用。 为了避免AuNPs的聚集反应来得太晚, 选择了15 nmol· L-1的适配体浓度来进行后续研究。
2.2.2 AND逻辑开关2中CTAB浓度的优化
CTAB的浓度对AND逻辑开关2的性能至关重要。 因此将0.3~3.0 μmol· L-1浓度的CTAB加入到15 nmol· L-1 Tcy1的AuNPs溶液中, 分别与0.25和0.50 mg· L-1的环丙氨嗪相互作用6分钟。 图7(b)说明当CTAB浓度从0.30增加到1.50 μmol· L-1时, 含0.25 mg· L-1环丙氨嗪的溶液的颜色与含0.50 mg· L-1环丙氨嗪的溶液颜色变化一致, A650/A526两个比值都在逐渐增加。 因此1.50 μmol· L-1的CTAB适用于高、 低浓度环丙氨嗪的检测。
2.2.3 AND逻辑开关2的响应时间
时间在AND逻辑开关2中起着重要的作用。 作为一种快速检测方法, 在满足检测要求的条件下, 方法全过程所需时间越少越好, 因此研究了不同反应时间的A650/A526比值。 如图7(c)所示, 环丙氨嗪浓度越高, 纳米粒子聚集越快, 650 nm的吸光度增加越明显。 分析认为不断增加的环丙氨嗪可以与适配体特异性结合, 更多的AuNPs会暴露在CTAB下。 在最初的6 min内, 吸光度比值随着时间的延长而明显增加。 6 min后, 游离的AuNPs差不多全部都聚集, 因此吸光度比值缓慢增加并很快达到平衡。 聚集反应完全, 溶液颜色在接下来的几个小时内不会改变。 因此, 6 min的反应时间足以检测体系完全反应, 实验选择6 min作为体系的最适反应时间。
2.2.4 环丙氨嗪检测的AND逻辑开关2的灵敏度和选择性
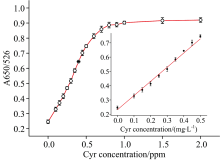
为了证明AND逻辑开关2是否可以用于牛奶中环丙氨嗪的检测, 在牛奶中加入了不同含量的环丙氨嗪。 在包裹了适配体的AuNPs中加入了1.5 μmol· L-1的CTAB, 使CTAB的输入为“ 1” 。 经过预处理后, 在526和650 nm波长下检测每个样品的吸光度比值三次。 结果如图8所示, 当环丙氨嗪-Tcy1的G-四联体形成时, AuNPs失去了Tcy1的保护, 发生聚集, 同时溶液颜色由红色变为蓝色。 因此AND逻辑开关的输出由环丙氨嗪浓度决定(“ 1” , A650/A526> 0.4; “ 0” , A650/A526< 0.4)。 根据溶液颜色的变化, 测定0~2.0 mg· L-1环丙氨嗪的吸光度比值, 并绘制标准曲线。 吸光度比值与0.10~0.50 mg· L-1浓度的环丙氨嗪之间存在线性相关性, 拟合方程为y=0.231+0.993x, 相关系数为0.991。 根据该方程, 当环丙氨嗪浓度大于0.17 mg· L-1时, A650/A526的比值大于0.4, 此时输出值为“ 1” 。 根据3σ /斜率计算出该传感器的检测限(LOD)为9.0 μg· L-1, 这个值远远低于2.5 mg· L-1(美国FDA和欧盟规定了牛奶中灭蝇胺的最大残留限量)。
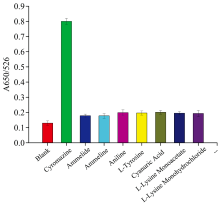
为了检查信号值的假阳性, 采用其他常用兽药和结构类似物来验证AND逻辑开关2的选择性。 对照实验组使用了环丙氨嗪、 三聚氰胺、 三聚氰酸、 苯胺、 L-酪氨酸、 氰尿酸、 L-赖氨酸、 L-盐酸赖氨酸。 实验结果如图9所示, 在对照实验中没有明显的颜色变化, 除了环丙氨嗪外, 其他八种化合物的输出结果都是“ 0” 。 这表明, 这些化合物在使用AND逻辑开关2检测牛奶中环丙氨嗪时, 对检测体系的干扰可以忽略。
2.2.5 用AND逻辑开关2检测牛奶样品中的环丙氨嗪
样品预处理之前, 向牛奶中加入不同含量的环丙氨嗪, 浓度分别为0.200 0, 0.300 0, 0.500 0和1.000 mg· L-1。 通过AND逻辑开关2, 每个样品重复检测3次, 同时用高效液相色谱-质谱(HPLC-MS)法分析同样的牛奶样品3次。 如表4所示, AND逻辑开关2的回收率在95%~115%之间。 分析结果表明, 该方法可用来检测牛奶中的环丙氨嗪。
| 表4 应用AND逻辑开关和HPLC-MS技术检测牛奶样品中的环丙氨嗪 Table 4 Application of AND gate 2 and HPLC-MS to detect the cyromazine in raw milk samples spiked with different amounts of cyromaizne |
通过使用适配体、 十六烷基三甲基溴化铵(CTAB)、 三聚氰胺和环丙氨嗪来控制金纳米粒子的聚集和分散, 设计了一个双与门逻辑开关组(AND 逻辑开关 1, AND 逻辑开关 2)用来检测牛奶中的三聚氰胺和环丙氨嗪。 首次利用适配体修饰的AuNPs, 设计出了逻辑开关组, 用来同时检测环丙氨嗪和三聚氰胺。 这两个逻辑开关快速、 简便, 可用于现场检测中, 颜色变化可以通过肉眼观察。 相信构建这一双与门逻辑开关组的过程可以对其他分析物的检测提供帮助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|