作者简介: 辛鸿娟, 女, 1997年生, 中国农业大学农学院硕士研究生 e-mail: hjxin@cau.edu.cn
作物残茬还田对农业绿色发展和地力提升意义重大。 我国作物残茬产量大, 种类多, 研究典型作物残茬中磷的赋存形态是预测其还田后作物有效性的前提。 目前, 液相磷-31核磁共振(31P-NMR)是可在分子水平上表征磷素形态的主流分析技术。 而利用该技术表征作物残茬磷素形态的已有研究有限, 且主要采用不同磷化合物的化学位移进行图谱解析。 由于某些有机磷的峰位置相邻, 其化学位移受样品pH等化学条件影响较大, 导致单纯依靠文献报道进行图谱解析存在较大不确定性, 并且识别出的有机磷种类偏少。 该研究进行加标实验, 选取典型作物残茬(玉米、 小麦、 水稻、 大豆、 花生、 棉花), 利用液相31P-NMR技术表征了不同部位(茎叶、 谷壳和种子)磷的分子形态及其含量。 研究发现, 所有供试作物残茬中总磷含量均为种子>谷壳>茎叶。 NaOH-EDTA前处理对供试作物残茬总磷有较高的提取率(73%~139%), 平均105%。 根据加标试验的31P-NMR图谱, 供试样品中检测出的无机磷形态包括正磷酸盐、 焦磷酸盐、 三聚磷酸盐, 有机磷包括植酸、 α/β-甘油磷酸盐、 单核苷酸, 首次在作物残茬的正磷酸二酯组分中检测到脱氧核糖核酸; 供试茎叶和谷壳中磷均以正磷酸盐为主, 大约占NaOH-EDTA可提取磷的49.3%~71.6%, 种子以植酸为主, 占比达48.5%~82.9%; 将正磷酸单酯和正磷酸二酯含量针对正磷酸二酯的降解产物进行矫正, 发现作物茎叶中正磷酸二酯(17.1%~33.5%)高于正磷酸单酯(9%~13.5%), 谷壳中正磷酸单酯和正磷酸二酯的百分含量分别为8.8%~23.2%及8.8%~24.6%, 种子中则以正磷酸单酯为主(57.6%~82.9%)。 研究结果表明, 供试作物残茬尤其茎叶秸秆还田后可能释放正磷酸盐和正磷酸二酯, 作为有效磷源供给后茬作物吸收。 该研究为作物残茬还田及农田磷肥管理提供重要科学依据。
The returning of crop residues to agricultural soils are of great significance to the development of Green Agriculture and soil fertility improvement. In China, there are various types of crop residues with high abundance. It is essential to characterize phosphorus (P) speciation in typical crop residues to predict the crop availability after returning them to the agricultural fields. To date, liquid-phase phosphorus-31 nuclear magnetic resonance (31P-NMR) spectroscopy is a state-of-the-art technique for characterizing P species at the molecular level. However, there were limited investigations on the characterization of P speciation in crop residuals by31P-NMR spectroscopy. Moreover, spectral peaks of different P forms, generally assigned based on the published literature, were significantly affected by sample properties (i.e pH), which resulted in large uncertainty and limited P forms to be identified. Therefore, with spiking experiments, this study used31P-NMR spectroscopy to characterize molecular P species in different parts (straw, chaff and seed) of the typical crops, including corn, wheat, rice, cotton, soybean and peanut. The results showed that the total P content in all investigated crop residues was seed > chaff > straw. NaOH-EDTA extractable P ranged from 73% to 139% of total P, with an average value of 105%. Based on the spiking experiments, inorganic P forms (orthophosphate, pyrophosphate, tripolyphosphate) and organic P forms (phytate, α and β-glycerophosphate, adenosine monophosphate) were detected in the investigated samples. Additionally, as one type of orthophosphate diesters, deoxyribonucleic acid was first detected in this study. In all investigated straw and chaff samples, the major P species were orthophosphates, comprising 49.3%~71.6% of the NaOH-EDTA extracted P, while P in the seeds was mainly phytate (48.5%~82.9%). With correction for diester degradation, orthophosphate diester (17.1%~33.5%) was more than orthophosphate monoester (9%~13.5%) in crop straw samples. In contrast, the orthophosphate monoester and orthophosphate diester percentages in chaff samples were 8.8%~23.2% and 8.8%~24.6% respectively, and orthophosphate monoester was the main component in seed samples (57.6%~82.9%). It showed that the investigated crop residues, especially straw, probably release orthophosphate and orthophosphate diesters as labile P forms for subsequent crop uptake after returning to the soil. These results provide a significant scientific basis for crop residue returning and P fertilization management in agricultural lands.
磷素作为植物生长发育必需的营养元素, 在农业生产中发挥着不可替代的作用。 长期以来, 由于磷肥在作物当季利用率低, 为保障粮食产量, 磷肥被大量施用, 造成绝大部分磷素在土壤中被固定, 并可能通过地表径流进入地表水体, 造成水体富营养化等生态环境问题[1]。 为有效防止我国农田土壤磷等养分过量累积, 推进我国农业的绿色发展, 农业农村部相继出台《农业化肥减量施肥》、 《农业化肥零增长》等政策, 强调“ 坚持农业绿色发展, 减少化肥农药使用” 等重要举措。
我国作为农业大国, 每年的作物残茬产量高达10亿多吨[2], 为有效补充因化肥减量施肥导致的农田养分缺失, 改善土壤结构, 充分发掘我国作物残茬资源还田利用具有重要现实意义。 作物残茬因含有氮磷钾等营养元素, 就地还田是其资源化利用的主要处置方式之一。 长期以来, 作物残茬还田的研究主要侧重于氮素的研究及其对作物产量及土壤性质的影响, 关于作物残茬还田后对土壤磷素的影响则主要侧重于废弃物中碳氮比、 碳磷比等化学计量学方法进行预测, 而对废弃物中磷素赋存形态以及还田后的潜在活性研究较少[3], 有必要进一步深入探讨。
作物残茬中磷形态决定其还田后的活性及转化过程, 有效表征作物残茬中磷的赋存形态意义重大。 目前液相磷-31核磁共振技术(31P-NMR)是可在分子水平上表征磷素形态的主流分析技术; 相比于传统以化学提取表征磷形态的方法, 31P-NMR方法具有样品前处理相对简单、 分析时破坏性小, 且可同步表征正磷酸单酯、 正磷酸二酯等有机磷及多聚磷酸盐、 焦磷酸盐等无机磷的优点[4]。 液相磷-31核磁共振已广泛应用于土壤和肥料中有机磷形态的鉴定[1], 在作物残茬中也有所应用[5, 6]。 然而, 当前所报道的文献利用31P-NMR表征作物残茬中磷素形态解谱不确定性较大, 并且识别出的有机磷种类偏少。 例如, Noack等[5]基于文献报道的峰化学位移, 利用31P-NMR定量表征了不同作物残茬中的甘油磷酸盐和植酸(肌-肌醇六磷酸)。 由于两者的峰位置相邻, 加之其吸收峰在测试过程中因样品pH、 粘稠度等条件差异造成峰位漂移, 因而在没有加标实验的辅证下往往难以准确解析[4]。 另外, 31P-NMR测试过程因NaOH-EDTA前提取而处于碱性条件, 可导致有机磷降解[7], 因此通常在解谱过程中需对此进行数据校正[8]。 随着31P-NMR实验方法与解谱技术的发展, DNA等正磷酸二酯可被有效解析[9, 10]; 由于DNA等正磷酸二酯生物可降解性高, 是重要的潜在活性磷库, 因此有效解析作物秸秆中的DNA等有机磷形态对于准确评估其还田后所含磷库的有效性具有重要意义。
本研究以我国主要作物残茬, 包括主粮作物(玉米、 小麦、 水稻)、 经济作物(棉花)、 豆科作物(大豆)和油料作物(花生)的茎叶、 谷壳和种子为研究对象, 采用液相磷-31核磁共振技术, 基于加标试验, 在分子水平上定量表征作物残茬中不同部位磷素赋存形态, 以期完善作物残茬磷核磁表征方法, 并为作物残茬还田以及磷素施肥管理等提供理论依据。
本研究供试作物残茬采自中国农业大学上庄实验站(东经116° 11', 北纬40° 08')。 该地属于温带大陆性季风气候, 年平均气温12.5 ℃, 年均降水量629 mm。 在土壤表面上方1 cm处割茬, 分别采集玉米、 小麦、 水稻、 棉花、 大豆和花生地上部植株, 每种作物田间多点取样后混合, 洗净, 60 ℃下烘干, 按茎叶、 谷壳和种子分装待测。
上述作物残茬样品分别研磨过2 mm筛, 经浓HNO3消解[11], 以电感耦合等离子体原子发射光谱仪(ICP-OES, Agilent 5110)测定总磷。
核磁共振实验前提取参照Cade-Menun和Preston[12]推荐的方法: 分别称取0.5 g种子样品及2.0 g其他作物残茬样品, 以40 mL 0.25 mol· L-1 NaOH+0.05 mol· L-1 Na2EDTA提取剂振荡。 提取液离心后, 取1 mL上清液以ICP-OES测定总磷含量, 剩余上清液冷冻干燥。 将上述冻干样品研磨混匀, 分别加入1.2 mL蒸馏水、 0.6 mL重水(D2O)、 1.2 mL NaOH-EDTA溶液及0.6 mL 10 mol· L-1 NaOH, 涡旋振荡使样品再溶解, 离心后将上清液转移至10 mm核磁管中。 31P-NMR图谱于中国农业科学院农业环境与可持续发展研究所农业环境核磁微结构分析实验室, 以500 MHz超导核磁共振仪(BRUKER ASCEND)采集NMR谱, 脉冲90° 、 采集时间1 s、 循环延迟50 s、 测定温度20 ℃、 扫描2 500~3 500次。 以单核苷酸、 植酸、 α 及β -甘油磷酸酯进行加标试验。 化学位移(ppm)参照85%的正磷酸, 设定样品谱中正磷酸盐的化学位移为6 ppm, 以NUTS软件对各磷形态进行定量分析。
所有供试作物残茬中总磷含量均为种子> 谷壳> 茎叶(表1)。 一般在作物成熟期, 磷往往由营养器官向生殖器官迁移[3], 这解释了磷含量在不同器官的如上差异。 收获期, 大部分还田的地上部作物残茬通常以茎叶秸秆为主(> 60%), 谷壳一般仅10%左右(小麦可高达20%~40%), 种子还田量虽一般低于5%, 但在极端或恶劣天气下该比例可能偏高[5]。 综合供试作物残茬的含磷量, 残茬还田导致的磷输入潜力不可忽视。
| 表1 供试作物残茬总磷含量(g· kg-1)a Table 1 Total phosphorus in the studied crop residues (g· kg-1)a |
高效的前提取是液相磷-31核磁共振技术实现样品磷分子形态有效表征的前提。 NaOH-EDTA对供试作物残茬总磷的提取率为73%~139%, 平均105%(表2), 与文献报道相一致[5], 较高的提取率表明31P-NMR可有效表征供试样品的磷形态。
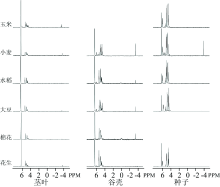
供试样品31P-NMR检测到的无机磷化合物包括正磷酸盐(6 ppm)、 焦磷酸盐(-4.3 ppm), 三聚磷酸盐(三重峰, -4.0, -4.1, -4.2 ppm), 有机磷化合物包括正磷酸单酯(5.9~2.5 ppm)、 正磷酸二酯(2.5~-2.0 ppm, 图1, 表2)。 在供试作物茎叶和谷壳中, 正磷酸盐是最主要的无机磷形态, 大约占NaOH-EDTA可提取磷的49.3%~72.1%, 仅有少量的三聚磷酸盐(< 3.7%)和焦磷酸盐(< 3.7%); 在作物种子中, 正磷酸单酯中的植酸为主要形态(48.5%~82.9%, 表2), 而植酸在作物茎叶秸秆与谷壳中百分含量基本低于10%, 仅小麦谷壳中百分含量达17.2%, 以上作物残茬各器官的主要磷形态分布特征与以往研究结果相似[3, 6]。
| 表2 供试作物残茬NaOH-EDTA提取率及磷形态解析(%) Table 2 Phosphorus forms in NaOH-EDTA extraction in the studied crop residues (%) |
依据加标试验图谱(图2), 正磷酸单酯中可识别出植酸、 α -、 β -甘油磷酸盐、 单核苷酸四种磷形态。 如图2所示, 供试样品中植酸与β -甘油磷酸盐位移(~4.5 ppm)非常相近, 如没有加标实验辅证仅基于文献报道的化学位移难以有效解析。 此外, 其他未被识别的正磷酸单酯归为Mon2, 化学位移主要在6~3.5 ppm之间, 可能包含其他肌醇磷酸盐、 磷酸糖类及正磷酸二酯的降解产物[8]。 正磷酸二酯中可识别出脱氧核糖核苷酸(DNA, -0.5 ppm, 图1), 为正磷酸二酯的主要形态。 鉴于31P-NMR分析过程中的高pH条件可能会导致部分有机磷水解。 例如, 通常认为, α -和β -甘油磷酸盐是磷脂的降解产物, 而单核苷酸是核糖核酸(RNA)的降解产物[13]。 因而本研究定量时通过将以上三种降解产物计入正磷酸二酯中进行了校正, 校正后作物茎叶秸秆的正磷酸单酯百分含量为9%~13.5%, 正磷酸二酯百分含量为17.1%~33.5%。 对于谷壳而言, 校正后作物的正磷酸单酯百分含量为8.8%~23.2%, 正磷酸二酯百分含量为8.8%~24.6%。 种子则以正磷酸单酯为主(57.6%~82.9%)。
 | 图2 液相31P-NMR谱图正磷酸单酯各形态磷的特征峰位置及加标谱图Fig.2 Solution P-NMR spectra showing the assignment of peaks in the orthophosphate monoester region, including spiking experiments |
供试作物茎叶中, 校正后正磷酸二酯在不同作物中的百分含量均高于正磷酸单酯, 鉴于正磷酸二酯的生物可降解性显著高于正磷酸单酯[1], 可见供试作物茎叶残茬是重要的有机磷库供给源。 另外, DNA是正磷酸二酯可唯一识别的磷形态, 而该形态在前期利用核磁共振技术表征作物残茬磷形态的研究中均未加以报道[5, 6]。 虽然作物茎叶秸秆中DNA的百分含量为0.8%~2.2%, 然而鉴于我国每年作物秸秆产量高, 其中80%的秸秆进行还田利用, 因此秸秆茎叶中DNA输入对于土壤磷素周转具有重要意义。 另外, 在供试作物谷壳中, 也同样检测到DNA的赋存, 但是在供试作物种子中则未有效检测。 一般而言, DNA作为遗传物质的重要组分, 在作物种子中应该有所赋存, 而在本实验中并未检出, 很可能是由于种子中正磷酸单酯含量过高导致含量低的DNA在核磁谱图上难以有效辨识。
利用液相31P-NMR技术定量表征了六种典型作物残茬茎叶、 谷壳及种子中不同形态磷含量。 结果表明供试作物残茬茎叶和谷壳中磷形态以正磷酸盐为主, 且茎叶中经校正后的正磷酸二酯含量高于正磷酸单酯; 同时正磷酸二酯中的DNA首次在茎叶秸秆中被检出。 鉴于我国作物秸秆产量巨大, 其所含的正磷酸盐生物有效性高, 正磷酸二酯较正磷酸单酯生物可降解性强, 因此作物秸秆还田过程中可提供磷素养分供后茬作物吸收利用。 本研究对于指导作物秸秆还田以及磷素施肥管理等提供了重要理论依据。
致谢: 感谢加拿大农业部Swift Current研发中心研究员Barbara Cade-Menun在数据解析中给予的帮助和建议。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|