作者简介: 丁俊男, 1982年生, 哈尔滨学院地理与旅游学院讲师 e-mail: ding.junnan@163.com
以叶绿素荧光分析为技术手段, 通过研究土壤中多环芳烃(菲)胁迫对野生大豆叶绿素荧光特性以及光能分配参数的影响。 结果表明: 土壤菲胁迫降低了PSⅡ反应中心活性和电子传递能力, 导致其光能利用能力降低。 200 mg·kg-1菲胁迫促使 Fv/ Fm, qP, ETR和 NPQ的发生变化, 降低了光合电子传递链上的电子传递能力和光合反应活性; 在不同光强的调控下, 土壤菲胁迫浓度的增大使得大豆幼苗叶片叶绿素荧光响应曲线 ФPSⅡ和 qP参数呈现降低趋势, NPQ的上调启动了叶黄素循环途径耗散过剩的辐射激发能, 以维持光合机构的正常生理功能。 土壤菲胁迫下野生大豆叶片的 Fm, Fv/ Fm, Fv/Fo和 PIABS等参数均随着菲含量的增加而降低, 即土壤菲胁迫抑制了野生大豆叶片的PSⅡ光化学活性。 通过对PSⅡ电子供体侧和受体侧的电子供应及传递能力的研究发现, 土壤菲胁迫下野生大豆叶片OJIP曲线上0.3 ms时(即K点)的荧光强度增加, 即放氧复合体(OEC)活性降低。 土壤菲胁迫还导致OJIP曲线上J点和I点荧光强度的增加, 说明土壤菲胁迫导致了野生大豆叶片PSⅡ受体侧电子接受能力的降低, 使电子由QA向QB传递受阻。 野生大豆叶片的光能吸收和分配参数也明显受到土壤菲胁迫的影响; 随着土壤菲浓度的增加野生大豆叶片PSⅡ反应中心吸收光能用于Q-A以后的电子传递能量比例和单位反应中心捕获用于电子传递的能量降低, 即吸收的光能用于光化学反应的比例降低。 因此, 土壤菲胁迫下导致PSⅡ电子供体侧OEC的损伤和PSⅡ电子受体侧电子传递能力的降低, 以及光能分配利用的改变均是导致其PSⅡ反应中心的活性降低的重要原因。 研究结果表明, 以叶绿素荧光分析技术可为环境中多环芳烃(菲)胁迫对植物光合作用的影响机理研究提供指导。
In this study, the chlorophyll fluorescence analysis was used as a technical means to study the effects of PAHs (Phe) stress in soil on chlorophyll fluorescence characteristics and light energy distribution parameters of Glycine soja. The results showed that Phe stresses can decrease PSⅡ activity center and the electron transfer ability, resulting in the decrease of the light energy utilization ability, especially for the use of the strong specular ability. Under 200 mg·kg-1 Phe stress conditions, Fv/ Fm, qP, ENR and NPQ were changed, and slow light inhibition occurred in G. soja leaves, which reduced the electron transport capacity and photosynthetic reactivity of the photosynthetic electron transport chain. Under the control of different light intensity and the increase of concentration of Phe stresses that G. soja leaves chlorophyll fluorescence response curve ФPSⅡ and qP parameters showed a trend of decrease, increase of NPQ launched the PSⅡ cycles way excitation energy dissipation of excess radiation, in order to maintain the normal physiological function of photosynthetic institutions. Those parameters such as Fm, Fv/ Fm, Fv/ Fo and PIABS decreased with the increasing concentration of Phe, which means that the soils Phe stressing subdued the photochemical activity of PSⅡ of those G. soja. Based on the study of electronic supply and transmission capacity at electronic donor side and receptor side of the PSⅡ found that on 0.3 ms (K point) of the OJIP curve of Phe stressed G. soja leaf, the fluorescence intensity increased the activity of OEC decreased. Phe stressing also caused the increase of the fluorescence intensityat the J point and I point on the OJIP curve of Phe stressed G. soja leaf. It showed that the Phe stressing reduced the electronically acceptability at the electronic receptor side of PSⅡon the leaves of G. soja, and made the electronic from QA to QB transfer blocked. The optical energy absorption and distribution parameters of seedling leaves of G. soja were influenced by Phe stressing. With the increase of soil Phe concentration, theratio of optical energy absorbed by PSⅡ reaction center and used for electron transfer after Q-A and the energy absorbed by each unit reaction center and used for electron transfer was reduced in the leaves of treated G. soja. It means that the proportion of optical energy captured by the reaction center and used for the photochemical reaction was reduced, and the proportion used through the invalid heat dissipation was increased. It could be concluded that there were three important reasons that generated the reduction of activity of PSⅡ reactive center of G. soja leaves under the soil Phe stress, which was the damage of OEC at electron donor side of PSⅡ, the electron transfer ability reducing at the electron acceptor side of PSⅡ and the change of the distribution and utilization of optical energy. This studise on the chlorophyll fluorescence analysis technique could provide guidance for the effect mechanism of plant photosynthesis to PAHs (Phe) stress.
随着我国城镇化和经济建设的快速发展, 工农业废弃物及人类生活垃圾所产生的持久性有机污染物危害生态环境状况愈发严重, 已成为世界各国所面临的重大环境与公共健康问题[1]。 其中具有致癌、 致突变和致畸性特性的多环芳烃(polycyclic aromatic hydrocarbons, PAHs)极易被动植物所吸收富集, 并可通过食物链和环境接触等途径危害人类的健康, 是各国优先控制的一类有机污染物[2]。 菲(phenanthrene, Phe)是具有三个苯环的多环芳烃类有机污染物, 来源主要由垃圾处理中有机物的不完全燃烧、 工农业“ 三废” 和汽车尾气排放, 因其结构性质稳定、 难降解而广泛存在于土壤、 水体的沉积物和空气中, 其中土壤菲的环境污染问题尤为突出[3]。 植物长期处于土壤菲胁迫下会影响其正常的生长发育, 菲可通过根部吸附积累在植物体中, 产生的中间产物活性氧可参与植物体的氧化还原循环过程, 引起植物体内分子水平和膜脂器官的氧化损伤等一系列毒害效应[4]。 野生大豆(Glycine soja)是我国重点二级保护渐濒危野生物种, 是改良栽培大豆重要的天然种质基因库, 亦可作为土壤多环芳烃污染修复的理想植物。
植物光合作用是对逆境胁迫比较敏感的过程之一, 而叶绿素荧光技术作为研究植物逆境下光合机构功能主要研究方法, 特别是可以反映逆境下植物叶片对光能的吸收和利用能力以及PSⅡ 反应中心活性的变化, 目前在植物生理生态学领域得到了广泛的推广应用[5]。 根据光合电子传递和叶绿素荧光产率理论, 捕光色素吸收的光能绝大部分用于光化学反应, 其余的能量以热能和荧光的形式耗散掉。 利用叶绿素荧光技术测量时, 通常会在光合作用单次周转期间(初级电子受体QA再氧化周期内)发射一束饱和激发光, 使初级电子受体QA完全被氧化, 无法再接收来自水裂解产生的电子, 导致电子传递链被完全阻塞, 从而使得PSⅡ 反应中心全关闭, 叶绿素吸收的过量能量只能以荧光、 热能等形式发散[6]。 为探明叶绿素荧光分析技术在野生植物受环境中有机污染物— — 多环芳烃(菲)胁迫研究中应用的方法, 本试验以野生大豆为试验材料, 应用叶绿素荧光分析技术, 主要研究土壤菲胁迫下野生大豆叶片PSⅡ 反应中心活性以及光合能量分配参数的变化特点, 探讨土壤菲胁迫对野生大豆叶片放氧复合体活性、 光合电子传递能力以及光合能量分配参数的影响, 以期探明环境中多环芳烃(菲)胁迫对植物光合作用的影响机理。
供试材料野生大豆品种ZYD5由黑龙江省农业科学院耕作与栽培研究所大豆室提供, 采自黑龙江省大兴安岭地区呼玛县, 生境内主要植被有乔木、 杂草、 蒿等植物, 该地区年平均日照时数2 529 h, 年平均降水量500 mm, 土壤类型主要为暗棕壤。 供试材料主要形态特征: 主根细长, 侧根极少。 蔓茎纤细, 缠绕, 略带四棱形, 密披浅棕色茸毛。 叶互生, 3小叶, 叶柄长2.6~3.0 cm, 浅棕色茸毛, 小叶披针形, 长4.5~5.0 cm, 宽1.0~1.5 cm, 侧生小叶片表面绿色, 背面浅绿色, 两面均有浅棕色茸毛, 叶脉于两面稍隆起, 全缘, 密披棕褐色茸毛。 蝶形花, 紫红色, 腋生总状花序, 花萼钟状, 5裂, 旗瓣近圆形, 雄蕊10枚, 9枚花丝连在一起成管状, 1枚单独分离, 二体。 荚有棕色茸毛, 弯镰形。 籽粒黑色, 长椭圆形, 有泥膜, 脐黑色。
试验采用盆栽种植方式, 以草炭土为土壤基质。 土壤中分别添加培养基质采用草炭土, 试验基质中菲的含量分别设为0(CK为对照组), 50, 100和200 mg· kg-1共4个浓度梯度, 质量分数以风干土壤计算, 各处理中的菲以10 mL的丙酮作助溶剂, 将丙酮和菲混匀后加入土壤中充分搅拌, 置于阴凉通风处风干12 h, 使丙酮充分挥发。 将精选成熟饱满、 大小相对一致的野生大豆品种ZYD5的种子均匀播种到含有不同浓度菲土壤的培养钵中, 培养钵直径12 cm、 高15 cm, 每钵种植20粒种子, 每个处理5钵重复, 共计20钵。 将培养钵放在光照强度200~300 μ mol· m-2· s-1、 光周期12/12 h(光/暗)的培养室内培养, 定期浇水和苗期管理, 待幼苗出土长至株高约10 cm时, 间苗处理, 每钵保留健壮、 生长相对一致的幼苗8株, 待播种60 d后开始进行叶绿素荧光参数的测定。
1.2.1 叶绿素荧光参数测定
叶绿素荧光参数的测定: 将不同处理野生大豆植株叶片进行0.5 h暗适应后, 利用便携式脉冲调制荧光仪FMS-2(Hansatch公司, 英国)测定PSⅡ 最大光化学效率(Fv/Fm)和电子传递速率(ETR)、 光化学猝灭系数(qP)和非光化学猝灭(NPQ)等。 各叶绿素荧光参数值的计算方法分别为 PSⅡ 电子量子产率
电子传递速率
式(1)和式(2)中, PFD为光强, 本试验中为800 μ mol· m-2· s-1; qP=(F'm-Fs)/(F'm-F'o); NPQ=(Fs/F'm)-(Fs/Fm)[7]。
1.2.2 叶绿素荧光动力参数的测定
利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100 max, 捷克)测定各处理叶片的OJIP参数, 其中O, J, I和P点分别为0, 2, 30和1000 ms对应的时刻, OJIP参数由3 000 μ mol· m-2· s-1的脉冲红光诱导, 荧光信号记录从10 μ s开始至1 s结束, 每秒105个数据。 利用5次OJIP参数平均值绘制OJIP柱形图, 将原始数据进行O-P点和O-J点标准化, 参数横坐标以对数形式表示。
O-P点标准化时
O-J点标准化时
式(3)和式(4)中, Ft为各时间点的荧光强度。 分别计算菲浓度为50, 100和200 mg· kg-1处理(TR)和CK标准化后的OJIP参数差值, 即Δ VO-P=VO-P(TR)-VO-P(CK), Δ VO-J=VO-J(TR)-VO-J(CK)。
对所测OJIP参数通过JIP-test分析得到叶绿素荧光参数: 初始荧光(Fo)、 最大荧光(Fm)、 PSⅡ 最大光化学效率(Fv/Fm)、 PSⅡ 潜在光化学效率(Fv/Fo)、 以吸收光能为基础的光合性能指数(PIABS)、 OJIP参数上2 ms时有活性反应中心的开放程度(Ψ o)、 吸收光能用于
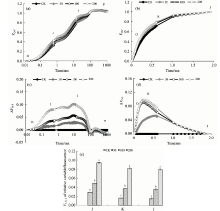
叶绿素荧光参数可表征植物叶绿体PSⅡ 系统反应中心的能量吸收利用、 传递和耗散过程, 采用叶绿素荧光技术能够灵敏、 无损地测定植物PSⅡ 系统反应中心活性, 快速了解逆境条件下光合器官的损伤状况, 被广泛称为研究植物光合作用反应机制与环境因子胁迫响应的无损探针[9]。 Fv/Fm表示植物光系统中光能的转化效率(如图1所示), 本研究中不同土壤菲浓度下Fv/Fm均保持在0.8左右, 土壤菲浓度低于100 mg· kg-1时野生大豆叶片的Fv/Fm与CK无显著差异, 土壤菲浓度达200和Fv/Fm分别较CK降低了2.74%(p< 0.05), 能够基本保持稳定, 与前人的研究结果相一致[10]; 同时, 土壤菲胁迫导致光合电子传递速率(ETR)能力减弱, 降低了光合电子传递链上的电子传递能力[图1(a)]; 光化学猝灭系数(qP)参数的下降表明土壤菲胁迫降低了野生大豆叶片PSⅡ 反应中心的活性及开放程度, 减少了参与光合CO2固定和光呼吸的能量; 土壤菲胁迫浓度的增大使得野生大豆叶片非光化学猝灭参数(NPQ)的上调, 确保以更多的热耗散形式来有效降低由天线色素吸收的光能过剩而引起对PSⅡ 反应中心造成的生理损害[图1(b)][11]。
OJIP曲线中蕴含着丰富的PSⅡ 原初光化学反应信息, 通过短时间光照后荧光信号的瞬时变化以较高的分辨率研究Fo到Fm变化的荧光信息, 即可以研究包括PSⅡ 电子供应、 传递以及PSⅡ 反应中心活性的变化等。 土壤菲胁迫下野生大豆叶片的OJIP曲线发生了改变[图2(a, b)所示], 土壤菲浓度为50和100 mg· kg-1时OJIP曲线上O点荧光强度无明显变化, 而菲浓度达200 mg· kg-1时O点荧光强度明显增加(p< 0.05), 随着菲浓度的增加, OJIP柱形图上J点荧光强度增强, P点荧光强度下降[图2(a, b)]。
如图3(a— e)所示由于原始OJIP数据变异性受外界因素的影响较大, 因此常通过数学方法把荧光信号数据标准化, 即使所有的OJIP数据具有相同的起点和终点, 将OJIP数据标准化后可以发现, 随着土壤中菲浓度的增加, OJIP数据变化上J点和I点的相对可变荧光明显上升, 并且随着土壤中菲浓度的增加, 增加趋势更为明显[图3(a, b)所示]。 将不同浓度菲处理与CK之间的标准化OJIP曲线做差值也可以看出, 随着土壤中菲浓度的增加, J点和I点的相对可变荧光强度变化较明显, 并且表现出明显的浓度效应, 即菲胁迫明显抑制了大豆幼苗叶片PSII受体侧的电子传递, 如图3(c, d)所示。 研究发现, PAHs会抑制植物蛋白质的合成, 或加速蛋白质的降解, 如D1蛋白等, 而D1蛋白的第190位His残基与原初电子供体中的Mn原子相结合, D1蛋白的含量会直接影响到放氧复合体的功能, 土壤菲胁迫下野生大豆幼苗叶片OJIP曲线上0.3 ms时K点荧光强度增加, K点的荧光强度的增加与PSⅡ 电子供体侧OEC的损伤有关, 当OEC活性受到抑制时会使水裂解过程中产生大量的H2O2, 而叶绿体内还不含有清除H2O2的CAT, H2O2氧化细胞中的DNA和蛋白质等, 还会通过破坏OEC的构成亚基而反馈抑制OEC的活性, 因此, 菲胁迫会通过抑制野生大豆幼苗叶片OEC的活性而降低光合电子的产生; 另外OEC活性的抑制导致活性氧的代谢紊乱也可能是导致PSⅡ 反应中心发生光抑制的重要原因之一。
土壤菲胁迫下野生大豆叶片的光能吸收和分配参数发生了明显的改变(如图4所示), 50 mg· kg-1土壤菲浓度下野生大豆叶片的ABS/RC与CK相比无明显变化, 而100 mg· kg-1菲浓度明显降低了野生大豆叶片的ABS/RC, 但当菲浓度增加到200 mg· kg-1时野生大豆叶片的ABS/RC降低程度却较100 mg· kg-1时有所下降。 当PSⅡ 反应中心有活性反应中心的数量降低时会迫使剩余有活性反应中心效率增加而表现为吸收光能增强[12], 这暗示了土壤中菲浓度过高时会降低野生大豆叶片PSⅡ 反应中心有活性反应中心的数量。 随着菲浓度的增加, 野生大豆叶片的φ Eo, TRo/RC和ETo/RC降低, 而φ Do和DIo/RC呈增加趋势, 吸收光能用于
应用快速叶绿素荧光分析技术测定野生大豆响应多环芳烃(菲)胁迫的生理机制, 研究表明: 低浓度土壤菲胁迫(50 mg· kg-1)对野生大豆生长及叶片PSⅡ 反应中心的影响较小, 野生大豆对土壤菲胁迫具有一定的耐受性, 但随着土壤菲含量的继续增加, 野生大豆叶片中电子传递能力的降低, 但野生大豆可以通过启动依赖于叶黄素循环的非辐射能量耗散机制和反应中心的活性降低的方式来降低土壤菲胁迫下的叶片PSⅡ 的光抑制程度, 防止PSⅡ 反应中心的大量失活。 同时, 土壤菲胁迫会抑制PSⅡ 电子供体侧放氧复合体OEC的活性, 还会降低PSⅡ 电子受体侧电子的接受能力而影响电子由QA向QB的传递。 另外, 土壤菲胁迫还导致了野生大豆叶片光能吸收和分配不平衡, 光能分配到电子传递的能量比例降低, 而用于热耗散的比例增加, PSⅡ 反应中心的活性降低。 因此, 土壤菲胁迫引起野生大豆叶片电子传递速率的降低和光能利用紊乱是引起其光抑制的主要原因。 土壤菲胁迫会抑制PSⅡ 电子供体侧放氧复合体OEC的活性, 还会降低PSⅡ 电子受体侧的电子的接受能力而影响电子由QA向QB的传递。 另外, 土壤菲胁迫还导致了野生大豆叶片光能吸收和分配不平衡, 光能分配到电子传递的能量比例降低, 而用于热耗散的比例增加, PSⅡ 反应中心的活性降低。 因此, 土壤菲胁迫引起野生大豆叶片电子传递速率的降低和光能利用紊乱是引起其光抑制的主要原因。 研究证实, 快速叶绿素荧光分析技术为广泛研究于植物响应多环芳烃胁迫的生理机制提供理论指导和技术支撑。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|