作者简介: 杨巧玲, 女, 1996年生, 上海大学环境与化学工程学院博士研究生 e-mail: yangqiaoling@shu.edu.cn
硫脲是一种含氮量高、 毒性较大的潜在蛋白掺假化合物, 常规的实验室检测方法过程复杂、 效率低, 无法满足口岸对大批次散装奶粉样本质量快速筛查的需求。 为解决口岸抽样监管缺乏快速实时评价方法的难题, 利用自主搭建的便携式点扫描拉曼高光谱成像系统, 开发了一种简单高效的奶粉中硫脲现场可视化快速检测方法, 确保散装奶粉在进出口环节的精准监管。 研究以不同添加浓度(0.005%~2.000%)的硫脲奶粉混合物为样本, 分别用Whittaker平滑方法和自适应迭代重加权惩罚最小二乘算法(airPLS)消除光谱数据的背景随机噪音信号和荧光背景干扰, 峰值识别后对硫脲特征位移处的单波段数据进行二值化处理, 得到混合样本感兴趣区域的二值热图, 通过二值图中硫脲像素点的有无和坐标, 对奶粉中的硫脲进行定性判别和定位分析。 进一步分析得感兴趣区域内硫脲像素点数目与添加浓度的关系, 结果表明随着添加浓度的增加, 硫脲像素点数目呈线性增长趋势, 其中线性拟合的决定系数( R2)为0.991 3, 硫脲的最低检出浓度为0.05%。 在0.25%, 0.60%, 1.20%和1.50%的添加水平下, 利用像素点数目和线性拟合关系预测奶粉中硫脲的浓度, 结果显示预测浓度的相对误差范围为-9.41%~4.01%, 相对标准偏差小于7%。 该点扫描拉曼高光谱成像系统能在10 min内完成单个样本的检测, 结合软件控制系统, 实时对奶粉中的硫脲颗粒进行定性、 定量和污染分布分析, 方法简单高效、 准确性好、 灵敏度高、 稳定性强, 为口岸现场对散装奶粉中硫脲掺假物的实时快速检测提供了技术监管手段, 能显著提升口岸现场散装样本的监管环节质量评价的精准性, 为进口奶粉快速通关提供技术保障。
Thiourea is a potential protein adulteration compound with high nitrogen content and high toxicity. Conventional laboratory testing methods are complicated in-process and low inefficiency and cannot meet the port’s demand for rapid quality screening of large batches of bulk milk powder samples. In order to solve the problem of the lack of rapid real-time evaluation methods for port sampling supervision, this research uses a self-built portable point scanning Raman hyperspectral imaging system to develop a simple and efficient on-site visualized rapid detection method of thiourea in milk powder to ensure accurate supervision of bulk milk powder in the import and export process. In the study, thiourea milk powder mixtures with different additive concentrations (0.005%~2.000%) were used as samples. Whittaker smoothing method and adaptive iteratively reweighted penalized least squares (airPLS) were used to eliminate random background noise signal and fluorescent background interference of spectral data.. After peak identification, the single-band data at the characteristic displacement of thiourea is binarized to obtain a binary heat map of the region of interest of the mixed sample. The qualitative identification and positioning analysis of thiourea in milk powder can be carried out through the presence or absence and coordinates of the thiourea pixel in the binary map. Further analysis of the relationship between the number of thiourea pixels in the region of interest and the concentration of addition showed that with the increase of the concentration of addition, the number of thiourea pixels increased linearly, and the coefficient of determination ( R2) of linear fitting was 0.991 3, the lowest detectable concentration of thiourea is 0.05%. Under the addition levels of 0.25%, 0.60%, 1.20%, and 1.50%, the number of pixels and the linear fitting relationship is used to predict the concentration of thiourea in milk powder. The results show that the relative error range of the predicted concentration is -9.41%~4.01%, the relative standard deviation is less than 7%. The point scanning Raman hyperspectral imaging system can complete the detection of a single sample within 10 minutes, combined with the software control system, real-time qualitative, quantitative and pollution distribution analysis of thiourea particles in milk powder. The method has the advantages of being simple and efficient, high sensitivity and stability, and good accuracy. It provides a technical supervision method for the real-time and rapid detection of adulterated thiourea in bulk milk powder at the port site and can significantly improve the quality evaluation of the supervision link of the bulk sample at the port, provide technical support for the rapid customs clearance of imported milk powder.
近十年来, “ 三聚氰胺毒奶粉” 事件使乳制品的质量安全成为消费者和科学研究关注的焦点, 并促使相关部门建立对乳制品质量进行更加严格的监管措施[1]。 乳制品的进口量呈现出快速增长的趋势。 2010年— 2019年间, 乳制品年均复合增长率达16.5%, 其中2020年散装奶粉进口量达131.0万t, 同比增长10.2%[2]。 而进口奶粉中的蛋白掺假事件近期也屡有发生, 如2013年新西兰进口奶粉中检出双氰胺污染[1]。 面对乳制品质量安全的严格管控以及大批次散装奶粉的进口通关, 口岸现场监管只能采用随机抽样后送实验室检验的方式, 监管流程长效率低, 缺乏现场快速实时评价的技术手段。
硫脲是一种含氮量高的重要化工原料, 常用于制造树脂、 染料、 压塑粉、 橡胶的硫化促进剂等。 而在食品领域, 非法商家使用硫脲增加奶粉的表观蛋白质含量。 研究表明, 长期接触或食用硫脲会导致白细胞减少、 甲状腺功能减退以及其他甲状腺类疾病[3], 美国环境保护署[4]和国际癌症研究机构[5]将硫脲及其衍生物分类为对人类有毒和致癌的物质。 目前食品、 污水、 空气、 土壤中硫脲的检测主要有高效液相色亲法[6]、 比色法[7]、 傅里叶变换红外光谱法[8]等。 舒友琴等[6]用高效液相色谱法成功对面粉中的硫脲进行定量分析, 样品的检出限和定量限分别为1.2和4.0 mg· kg-1。 现有的检测方法普遍存在前处理复杂、 检测成本高、 周期长、 效率较低等问题, 不适用于口岸现场大批次样品中硫脲的快速筛查。
近年来, 基于光谱成像的可视化无损快检方法发展迅速, 如近红外光谱成像技术、 拉曼光谱成像技术、 傅里叶变换红外光谱成像技术等。 这些技术能同时获得样品的光谱特征和图像信息, 具有无损、 快速、 可视化等优点[9], 广泛应用于食品质量安全领域如非法添加物的检测[10]、 营养成分的鉴定[11]、 掺伪物质的筛查[12]等。 其中点扫描拉曼光谱成像是拉曼光谱技术和点扫描成像技术的结合, 通过采集空间中每个像素点的拉曼光谱信息, 将分子信息在空间上展现, 并定性、 定量、 定位地分析物质分子。
本工作采用自主搭建的便携式点扫描二维拉曼高光谱成像仪器对不同浓度梯度(0.005%~2.000%)的硫脲奶粉混合物进行检测, 结合自主研发的软件系统, 对硫脲进行在线实时的定性、 定量和污染物分布分析, 并进一步预测奶粉中硫脲的浓度。 本研究为开发快速、 无损、 可视化检测奶粉中非法添加物提供技术支持, 可应用于口岸现场散装奶粉的通关检测, 确保进出口奶粉质量品质检测的科学性。
检测所用样品为奶粉(市售奶粉), 试剂为硫脲标准品(纯度≥ 99.0%; 购自上海安谱实验科技股份有限公司)。
硬件装置主要由高精度定位扫描装置、 光学显微镜平台、 拉曼光谱仪模块三部分组成, 如图1所示。 高精度定位扫描装置由一个定位精度优于5 μ m的二维微区定位电动平台和一个最小步长为0.1 μ m的电动对焦平台组成。 光学显微镜使用无限远校正物镜, 方便在显微镜光路中插入拉曼光谱仪模块。 拉曼光谱仪模块通过一个分束器与显微镜光路结合, 拉曼探头发射的平行光束通过分束器反射后经显微物镜聚焦于样品, 用CMOS相机可以观察到激光光斑和样品的成像。 点扫描激光器的激发光波长为785 nm, 最大输出功率为600 mW, 谱宽0.076 nm, 对应的拉曼成像光谱仪采集范围为200~3 200 cm-1, 光谱分辨率为0.7 nm; 电动载物平台的最大速度为20 mm· s-1, 定位精度≤ ± 5 μ m, 最小步长为0.1 μ m; CMOS相机的分辨率为2 048× 1 536, 采集的像素点尺寸为3.2× 3.2。 采集高光谱图像时, 点激光经二向色镜反射到样本表面, CMOS相机和光谱仪采集对应点的样本数据, 随着电动载物台沿X和Y轴移动最终完成整个样本的扫描。
 | 图1 点扫描二维拉曼光谱成像系统原理图Fig.1 Schematic diagram of point scanning two-dimensional Raman spectroscopy imaging system |
软件系统为自主研发的拉曼高光谱信息采集软件, 可以控制电动载物台的平移、 调整拉曼高光谱采集参数、 切换拉曼光谱预处理方式等, 同时还具有数据库相似度匹配功能, 对盲样物质进行初步的定性判别。 本实验中的采集参数为激光功率300 mW, 积分时间1 000 ms, 此时完成一种质量分数样本的数据采集需要约6 min。
1.3.1 样本制备
样本分为拉曼信号穿透厚度检测的双层样本和硫脲含量测定的奶粉混合样本, 样本制备过程如图2所示。 图2(a)为穿透深度检测中样本制备模具, 体积75 mm× 25 mm× 8 mm, 中央的样本盛放池尺寸24 mm× 24 mm× 7 mm, 中间镂空的圆洞直径14 mm, 金属垫片体积为24 mm× 24 mm× 1 mm。 通过增减金属垫片的数目可以调整样本盛放池的深度, 镂空的圆洞方便金属垫片的拿取。 图2(b1)为双层样本, 上层为奶粉, 下层为硫脲标准品, 制备过程中在样本盛放池底部放一个金属垫片, 加入1 mm厚度的硫脲标准品粉末, 铺上奶粉层进行高光谱采集, 保持硫脲标准品厚度不变, 依次增加金属垫片的数目, 控制奶粉层的厚度, 直至奶粉层与样本盛放池顶部平齐, 完成拉曼信号在奶粉层的穿透厚度检测。
根据硫脲标准品拉曼信号在奶粉层中穿透厚度的检测结果, 实验室定制了一种铝合金材质的样本检测模具用于制备硫脲奶粉混合样本。 样本检测模具体积为24 mm× 24 mm× 2 mm, 样本盛放池尺寸为24 mm× 24 mm× 1 mm, 硫脲奶粉混合样本制备如图2(b2)所示。 实验制备硫脲奶粉混合样本共11份, 浓度(W/W)范围为0.005%~2.000%, 每份样本质量为1 g。 制备样本前, 用研钵将奶粉和硫脲标准品颗粒分别研磨2 min, 称量取样, 倒入5 mL离心管中, 涡旋5 min得到硫脲奶粉混合样本。 高光谱采集时, 一份相同添加浓度的奶粉混合样本分三次放入样本盛放池中, 用载玻片刮平表面, 样本放在电动平移台上重复采集三次, 光谱数据平均求和得到感兴趣区域内样本的拉曼高光谱信息。
1.3.2 数据处理与分析
点扫描拉曼高光谱显微成像系统采集的信息是含有2 048个波段的三维数据, 为了减小高光谱数据处理的运算量, 需要对数据进行降维处理后再进行分析, 数据处理流程如下:
(1)单光谱有效数据截取。 从2 048个波段中提取921个有效波段(330~2 199 cm-1)进行处理, 波段选取在软件UspectralPlus5.1.0(上海如海光电科技有限公司研发)中完成。
(2)光谱平滑和荧光背景去除。 利用软件系统中的Whittaker平滑方法[13, 14]和自适应迭代重加权惩罚最小二乘算法[15](adaptive iteratively reweighted penalized least squares, airPLS)消除背景随机噪音信号和荧光背景干扰。
(3)峰值识别。 提取硫脲特征峰[(732± 5) cm-1]处的全部拉曼光谱数据, 按照感兴趣区域内样本的采集方向, 对数据进行10× 10矩阵的重新排列。
(4)空间多维光谱组装和可视化。 将奶粉在732 cm-1(± 5 cm-1)波数处的最大拉曼强度值设为阈值。 当像素点在732 cm-1波数处的拉曼强度高于阈值判定为硫脲颗粒并在二值图像上用黑红色显示, 低于阈值判定为奶粉背景用白色显示, 得到感兴趣区域内样本的二值图像, 通过二值图像可以清晰地展示出硫脲颗粒的检出情况和空间分布。 单波段图像二值化处理过程在软件Prism8.0(GraphPad Software .USA)中进行。
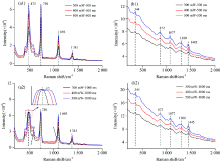
分别以固态标准品硫脲和奶粉为样品, 在不同的激光功率和积分时间下, 采集拉曼光谱, 结果图3所示。 不同激光功率、 积分时间下硫脲的拉曼原始光谱图如图3(a)所示。 由图可知, 随着激光功率和积分时间的增加, 硫脲标准品的拉曼特征峰不断增强, 当积分时间为1 000 ms, 积分功率分别为400和500 mW时, 475 cm-1处的峰强度值达到最大值[图3(a2)], 由于信息溢出会影响拉曼特征峰强度的准确判断, 故选择硫脲标准品的最佳采集参数为激光功率300 mW、 积分时间1 000 ms。
 | 图3 不同积分时间、 激光功率下硫脲和奶粉的拉曼光谱图Fig.3 Raman spectra of thiourea and milk powder under different integration time and laser power |
不同激光功率、 积分时间下奶粉的拉曼原始光谱图如图3(b)所示。 由图可知, 奶粉的拉曼特征峰强度随着激光功率和积分时间的增加而增强, 且未出现信号值饱和现象, 由于拉曼特征峰强度越高越有利于特征峰辨别和数据处理, 对比图3(b1)和(b2)可知, 采集奶粉的最佳仪器参数是激光功率500 mW、 积分时间1 000 ms。 综合考虑, 点扫描二维拉曼光谱仪器采集硫脲奶粉混合样本的最佳参数为激光功率300 mW、 积分时间1 000 ms。
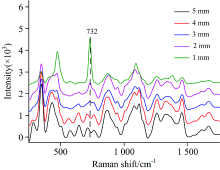
实验设置双层样本, 上层为奶粉, 下层为硫脲标准品, 奶粉厚度分别为0, 1, 2, 3, 4和5 mm。 利用点扫描拉曼光谱成像仪器分别采集双层样本表面拉曼光谱信息以及24 mm× 24 mm区域内10× 10个像素点的高光谱信息, 结果如图4和图5所示。 双层样本表面的拉曼光谱信息如图4所示, 由图可知, 随着奶粉厚度的增加, 732 cm-1的强度值越来越低, 说明激光的能量在穿透奶粉的过程中不断被削弱, 当奶粉厚度为2 mm时, 特征峰732 cm-1基本消失, 此时无法检测到下层硫脲的拉曼信息。
 | 图4 不同奶粉厚度下双层样本表面拉曼光谱图(n=3)Fig.4 Raman spectra of double-layer samples with different milk powder thickness (n=3) |
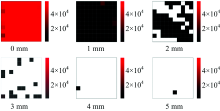 | 图5 不同奶粉厚度下双层样本的二值图像(n=3)Fig.5 Binary images of double-layer samples with different milk powder thickness (n=3) |
双层样本的拉曼高光谱数据经过二值化处理后得到二值热图, 结果如图5所示。 由图可知, 随着奶粉厚度的增加, 感兴趣区域内含硫脲的像素点数目即硫脲检测点越来越少, 当奶粉厚度为1 mm时, 硫脲检测点数目为100, 当奶粉厚度大于2 mm时, 硫脲的检出概率低于100并不断降低, 说明在本实验参数下, 硫脲标准品产生的拉曼信号能够穿透2 mm厚的奶粉层。 为了确保最底部硫脲颗粒产生的拉曼信号能被系统完全采集到, 避免样本信息的丢失, 研究定制样本模具使检测样本的厚度维持在1 mm左右。
2.3.1 奶粉中硫脲的定性分析
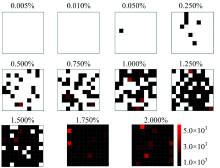
以硫脲标准品为添加剂, 分别制备添加浓度(W/W)为0.005%, 0.010%, 0.050%, 0.250%, 0.500%, 0.750%, 1.000%, 1.250 0%, 1.500%, 1.750%和2.000%的硫脲奶粉混合样本, 采集混合样本24 mm× 24 mm区域内100个像素点的拉曼高光谱信息, 经过阈值处理后的二值热图如图6所示。 由图可知, 在感兴趣区域内, 随着添加物浓度的增加, 硫脲检测点数目增多。 当添加浓度为0.050%时, 感兴趣区域内可检测到1个硫脲检测点, 说明基于该实验参数, 硫脲在奶粉中的最低检出浓度为0.050%, 比已有研究中的检出限(0.1%)更低[16], 采集时间(20 min)更短[17]。
2.3.2 奶粉中硫脲的定量分析
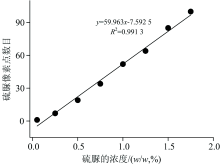
研究将感兴趣区域内硫脲像素点数目与添加浓度进行线性拟合, 结果如图7所示。 由图可知, 线性拟合的决定系数(R2)为0.991 3, 具有很好的线性关系。 实验中的样本厚度为1 mm, 比文献中样本厚度小[17], 系统能完全采集到底部样本信息(图5), 不存在样本信息遗漏, 且平行多次混合后采样能让表层和亚表层样本信息全部采集到, 减少样本信息覆盖的误差, 因此随着添加浓度的增加, 样本中硫脲检测点的数目呈线性增长[18], 可以根据感兴趣区域内硫脲检测点数目预测奶粉中硫脲的添加浓度。
2.3.3 方法的验证
为了验证该方法的准确性, 以三种不同品牌奶粉为基质, 制备4个不同浓度的硫脲奶粉混合样本, 分别为0.25%, 0.60%, 1.20%和1.50%, 重复制样6次, 采集拉曼高光谱信息并进行二值化处理, 记录硫脲检测点的数目并利用图7的线性关系预测硫脲的浓度, 结果如表1所示。 由表1可知, 在0.25%, 0.60%, 1.20%和1.50%的添加水平下, 预测浓度的相对误差范围为-9.41%~4.01%, 相对标准偏差(RSD)小于7%, 说明该方法具有较高的准确性和稳定性, 可以用于检测奶粉中添加物的浓度。
| 表1 方法准确性验证表 Table 1 Methodaccuracy verification form |
搭建了一套便携式点扫描拉曼高光谱成像检测系统, 针对奶粉中的硫脲进行快速无损检测研究, 结果显示该检测方法的检出限为0.05%, 硫脲像素点数目与添加浓度呈线性增长趋势, 线性决定系数为0.991 3, 预测浓度的相对误差范围为-9.41%~4.01%, 相对标准偏差小于7%, 能准确预测硫脲在奶粉中的浓度。 相比传统的检测技术, 本研究开发的硫脲快检方法具有以下优势: (1)仪器便携, 绿色环保, 可在口岸现场操作。 避免采用常规色谱、 光谱方法所需的前处理过程, 测定过程基本无有机试剂等有害化合物的使用; (2)方法检测时间短, 效率高。 整个检测过程包括前处理能在10 min内完成, 而且结果直观可视。 高效液相色谱法包括前处理过程至少需要50 min[6], 刘宸等[17]利用线扫描拉曼高光谱成像检测奶粉中的硫氰酸钠需要20 min。 同时利用二值热图法可以清晰地展示添加物质的空间分布; (3)准确性好, 稳定性高, 成功预测添加水平下硫脲浓度, 且相对标准偏差小于5%; (4)方法检出限(0.05%)低于现有高光谱方法, 灵敏度高。 陈秀明[16]等利用近红外光谱成像技术结合Adulterant Screen 算法对婴幼儿奶粉中的硫脲进行检测, 检出限为0.1%。 本研究搭建的便携式点扫描拉曼光谱成像系统不仅适用口岸现场奶粉中非法添加物的快速筛查, 在其他固体颗粒掺假中也具有较好应用前景。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|