作者简介: 吕铷麟, 1997年生, 中国人民公安大学侦查学院硕士研究生 e-mail: woshiziya1997@163.com
三聚氰胺是豆、 乳类制品中的非法食品添加剂, 曾作为蛋白质的廉价代替物被非法添加进奶粉等食品中, 造成了严重的社会危害, 极大地威胁人民生命财产安全。 目前光谱技术已成为识别和定量检测非法食品添加剂的有效手段, 为质量监管部门提供了可靠的研究方法和鉴定依据。 光谱检测技术的时效性、 无损性和准确性提高了食品中三聚氰胺的检测效率, 促进了精准化、 自动化食品质量检测的发展。 近年来有大量研究围绕着三聚氰胺的光谱检测新技术, 如开发新型增强底物或传感器, 降低三聚氰胺的检测限, 提高检测精度; 开发更加便携的自动化光谱快检设备, 降低检测成本, 提高检测效率。 这些光谱技术各具优势, 但很难形成标准化、 统一化的检测规范, 使得各种光谱检测技术仅仅停留在试验阶段, 无法应用于实战。 另一方面, 随着人工智能与模式识别技术的发展, 光谱数据分析方法在近年来也有着长足的进步, 各种光谱预处理和数据建模方法被不断提出, 大大提高了光谱检测技术的灵敏性和稳定性。 综述了近十年光谱技术(拉曼光谱、 近红外光谱、 荧光光谱、 光谱成像等)在三聚氰胺检测中的应用现状, 总结了不同仪器检测限、 定量范围和样品前处理方法; 分析了各种光谱预处理和光谱数据建模方法在不同光谱数据中的适用性, 归纳出这些方法的优劣与适配的仪器, 并对其应用前景和研究趋势进行了展望。
Melamine is an illegal food additive in beans and dairy products. As a cheap substitute for protein, melamine was illegally added into milk powder and other foods, causing serious social harm and greatly threatening the safety of people’s lives and property. At present, spectral technology has become an effective means to identify and quantitatively detect illegal food additives, which provides a reliable research method and identification basis for the quality supervision department. The timeliness, non-destructive and accuracy of spectral detection technology improve the detection efficiency of melamine in food and promote the development of accurate and automated food quality detection. In recent years, a large number of studies have focused on the spectral detection of melamine, such as the development of new enhanced substrates or sensors to reduce the detection limit of melamine and improve the detection accuracy; Develop more portable automatic spectrum rapid detection equipment, reduce the detection cost and improve the detection efficiency. These spectral technologies have their advantages, but it is difficult to form a standardized and unified detection specification, making all kinds of spectral detection technologies only stay in the experimental stage and can not be applied to actual combat. On the other hand, with artificial intelligence and pattern recognition technology, spectral data analysis methods have made great progress in recent years. Various spectral preprocessing and data modeling methods have been proposed, which greatly improves the sensitivity and stability of spectral detection technology. The application status of spectral techniques (Raman spectroscopy, near-infrared spectroscopy, fluorescence spectroscopy, spectral imaging, etc.) in the detection of melamine in recent ten years was reviewed. The detection limits, quantitative ranges and sample pretreatment methods of different instruments were summarized; The applicability of various spectral preprocessing and spectral data modeling methods in different spectral data is analyzed, the advantages and disadvantages of these methods and the suitable instruments are summarized, and their application prospects and research trends have prospected.
近年来, 食品安全问题不断涌现, 非法添加食品添加剂的事件频发, 严重威胁人民的生命财产安全, 为食品质量监管带来了巨大挑战。 随着生活水平的日益提高, 对豆、 乳类制品的需求量也越来越多。 氮元素是食品中蛋白质含量评定的重要指标, 一些不法商贩为了提高蛋白质的检测含量, 向食品中非法添加三聚氰胺[1, 2]。 根据我国卫生部的相关标准, 婴儿配方食品中三聚氰胺的限量值为1 mg· kg-1, 其他食品中三聚氰胺的限量值为2.5 mg· kg-1。 过量的三聚氰胺在体内会形成泌尿结石, 造成继发性肾损伤, 肾功能衰竭[3], 甚至还会对人的中枢神经系统造成影响, 如诱导神经细胞凋亡, 引起海马神经元的病理变化, 导致记忆力下降, 认知灵活性下降等[4]。 因此, 食品中三聚氰胺的检测工作已成为当前研究的热点问题。
食品中三聚氰胺常用的检测方法是色谱法和色谱-质谱联用法, 因大多需要较昂贵的实验耗材和复杂的前处理过程, 为检测工作带来了诸多不便[5, 6, 7]。 近年来, 光谱技术已广泛用于灵敏、 快速、 无损检测食品中的三聚氰胺[8]。 三聚氰胺掺假问题涉及的食品种类繁多, 从豆、 乳制饮品到粉剂都可能存在, 不同光谱技术对这些检材的前处理要求和检测能力均存在差异, 因此三聚氰胺的光谱检测标准长时间未得到统一。 综述了近十年食品中三聚氰胺的光谱检测技术和光学数据处理技术, 并对研究趋势进行了展望, 为食品安全工作提供参考。
拉曼光谱是基于散射光与待测物分子相互作用时, 频率发生改变而产生的散射光谱, 通常用于表征分子的结构特征, 也称为“ 分子指纹光谱” [9]。
1.1.1 便携式拉曼光谱
手持拉曼光谱仪是一种便携式分析仪器, 其操作简单, 常用于现场定性和定量检测各种食品、 药物中的掺假物质[10]。
Sanjeewa等[11]对比了两种便携式拉曼光谱仪和台式拉曼光谱在奶粉三聚氰胺检测中的应用效果。 便携设备一包含自动荧光扣除的系统, 便携设备二包含三聚氰胺信号快速检出系统。 通过非靶向软独立类比模型(SIMCA)对光谱数据进行判别后, 两种便携式设备对三聚氰胺掺假样品的识别率分别为97%和100%。 结果表明两种便携式设备均适合快速、 常规样品的三聚氰胺现场检测。 Nieuwoudt等[12]使用带有浸入式探头的便携式拉曼光谱仪, 检测了牛奶中的三聚氰胺、 双氰胺、 硫酸铵、 尿素等非蛋白氮, 结合偏最小二乘回归(partial least-square regression, PLSR)建立了定量校正模型, 结果表明在50~1 000 ppm的线性范围内, 决定系数R2为95%, 预测均方根误差(root-mean-square error of prediction, RMSEP)为0.46%, 说明该方法能够准确预测样品牛奶中的三聚氰胺含量。 有研究用便携式拉曼光谱仪和拉曼增强试剂检测了蛋清中的三聚氰胺, 并结合偏最小二乘法和谱峰分解法分别建立了定量校正模型, 决定系数R2分别为0.856和0.947, 该法能够准确快速定量蛋清中的三聚氰胺。
1.1.2 表面增强拉曼光谱
当三聚氰胺作为非法食品添加剂使用时, 往往浓度很低, 而常规的拉曼光谱法无法实现对低浓度三聚氰胺掺假的检出, 需要借助表面增强拉曼散射(surface-enhanced Raman scattering, SERS)技术增强拉曼信号, 提高检测灵敏度[13]。 SERS技术可以提供单分子指纹图谱信息, 实现超低浓度物质的超高灵敏度检测[14]。
由于三聚氰胺的拉曼信号过低, 使用纳米金属直接作为增强基底的检测效果并不理想[15]。 Lou等[16]研发了一种基于4-巯基吡啶(MPY)修饰金纳米粒子(AuNPs)的表面增强拉曼光谱法, 用于奶粉中三聚氰胺检测, 检测限低至0.1 ppb。 Hu等[17]研发了一种基于分子印迹聚合物(MIPs)的表面增强拉曼光谱法, 检测牛奶中三聚氰胺, 其分子印迹聚合物是由三聚氰胺、 甲基丙烯酸、 乙二醇二甲基丙烯酸酯和2, 2’ -偶氮二异丁腈为原料本体聚合合成的, 检测限和定量限可达到0.012和0.039 mmol· L-1。 Huang等[18]以银纳米粒子包覆的磁性聚磷腈颗粒作为表面增强基底, 检测了水溶液和牛奶样品中的三聚氰胺, 检测限分别为1× 10-7和0.6 mg· L-1。 Sharma等[19]研究了三聚氰胺在氧、 硫原子石墨烯量子点(oxygen graphene quantum dots, O-GQD; sulfur graphene quantum dots, S-GQD)上的结合机理, 采用表面增强拉曼散射检测三聚氰胺, 并利用密度泛函理论分析其电子和振动特性。 结果表明, O-GQD和S-GQD对三聚氰胺的拉曼信号增强效果分别为348.4%和48%, 石墨烯量子点是良好的表面增强基底。 Zhang等[20]研发了一种基于银纳米粒子(AgNPs)的新型疏水SERS滤纸基底用于检测三聚氰胺, 该新型SERS滤纸基底不仅能满足快速、 批量的制备要求, 而且能实现样品的重复性检测, 三聚氰胺检测限为0.02 ppm。
近红外光谱包含多个含H基团振动的倍频、 合频和差频叠加产生的重叠带, 通常需要使用化学计量模型对样品收集到的光谱进行数学分离。 近红外光谱技术的样品前处理简单、 采集速度快、 成本低, 近十年广泛用于食品安全检测。
Scholl等[21]研究了奶粉的不同前处理方法对近红外光谱检测三聚氰胺的影响。 研究中分别检测了干混样品和湿混样品三聚氰胺的近红外光谱特征谱线, 发现干混样品在1 468 nm波段有明显的三聚氰胺特征峰, 而湿混样品中则检测不到, 采用干混样品的三聚氰胺掺假识别准确率高于湿混样品。 Haughey等[22]使用近红外光谱技术检测了大豆豆粕样品中的三聚氰胺, 使用一阶、 二阶导数和滤波拟合对数据进行预处理, 比较了主成分分析(principal component analysis, PCA)回归和PLSR对大豆中三聚氰胺浓度的预测能力, 结果表明近红外光谱结合两种回归方法均有良好的检测精度, 决定系数R2为0.89~0.99。 Chen等[23]使用近红外光谱技术对婴幼儿奶粉中的多种非法添加物进行了检测, 其中三聚氰胺的最低检测限为0.04%, 在奶粉中多组分掺假物检测中发现, 无掺样品鉴别准确率为100%, 二组分掺假物鉴别准确率达到83.3%, 而三组分以上的掺假物识别能力较差。
奶粉溶液中加入三聚氰胺后, 荧光强度不仅变弱, 荧光峰位置也会发生变化, 说明三聚氰胺有荧光猝灭效应, 荧光光谱法可以对奶粉中的三聚氰胺进行定量检测, 但需要使用一定增强手段来提高荧光猝灭效应的强度。
Yin等[24]基于三聚氰胺与Hg2+之间极强的配位亲和力, 建立了掺氮碳点(NCD)荧光探针法测定三聚氰胺的浓度。 以尿酸和二亚乙基三胺分别作为碳源和氮源, 利用Hg2+对NCDs的荧光猝灭作用, 在极宽的线性范围内(50~400和800~2 500 μ g· L-1)实现了对三聚氰胺的准确定量, 决定系数R2分别为0.997和0.988, 检测限为21.76 μ g· L-1。 Rima等[25]基于三聚氰胺与甲醛和1, 3-二苯基丙烷-1, 3-二酮的络合作用, 建立了定量测定三聚氰胺的荧光光谱法, 可使荧光强度大大降低, 准确定量检测三聚氰胺, 检测限为7 μ g· L-1。 Paul[26]等基于AuNPs对三聚氰胺的荧光增强作用, 使用荧光光谱法测定了牛奶和奶粉中的三聚氰胺。 通过建立420 nm处的荧光强度与三聚氰胺浓度的回归模型, 对比了三种不同尺寸AuNPs对检测的影响, 结果表明30 nm AuNPs包裹的三聚氰胺在308 nm光激发下具有最强的荧光强度和最高的灵敏度, 检测限低至0.66 nmol· L-1。 张沛等[27]基于三聚氰胺对荧光素的荧光增强效应建立了三聚氰胺荧光光谱检测法。 采用天然鸡蛋膜作为生物膜基质, 添加戊二醛交联剂改性, 并将荧光素固定在鸡蛋膜表面。 添加戊二醛后的鸡蛋膜扫描电镜图像如图1(a, b)。
 | 图1 传感器交联化反应前(a)、 后(b)的扫描 电子显微镜图像[29]Fig.1 SEM images of biosensor before (a) and after (b) cross-linking reaction[29] |
对比图2(a)和(b)交联后的鸡蛋膜表面纤维网状结构被戊二醛完全覆盖, 形成了稳定、 性能良好的传感器膜。 该方法中三聚氰胺浓度与荧光强度在0.001~0.5 mg· L-1范围内呈线性相关, 检测限为0.47 μ g· L-1。
在食品检测中, 常用的光谱成像技术包括高光谱成像、 拉曼光谱成像和近红外光谱成像。 光谱成像集光谱和成像技术于一体, 通过增加光谱通道数来提高测量精度, 获得食品检材颜色和结构上的三维数据信息[28], 能够更加全面准确检测其化学成分, 评判品质优劣。
Shen等[1]用近红外光谱成像技术建立了豆粕中污染物的通用型检测方法, 将三聚氰胺作为代表性污染物, 结合局部异常检测(LAD)的非目标检测方法, 获得了较好的检测性能, 决定系数R2为0.998 4, 定量限为0.01%。 Fu等[29]用近红外光谱成像技术, 结合光谱相似性分析, 对奶粉中低浓度三聚氰胺进行了检测。 结果表明, 近红外光谱成像技术与光谱相似性分析结合是奶粉中三聚氰胺掺假的有效检测方法, 定量限为0.02%, 该法也可用于奶粉中其他化学物质掺假的检测。 Dhakal等[30]研究点扫描拉曼光谱成像技术检测含有三聚氰胺的食品粉末, 用图像二值化对检测到的像素进行分类, 得出每个组分的像素点数与样品中该组分的实际浓度相关, 相关系数为0.99。 6%水平下多组分图像二值化处理结果如图2所示。 该方法可用于复杂食品基质中不同组分的鉴定和浓度估算。 Zhao[31]等使用近红外高光谱成像技术对奶粉中掺杂的三聚氰胺和香兰素进行了检测。 研究中提取了高光谱图像中每个像素点的光谱图, 并使用竞争性自适应重加权算法(CARS)选择出6个最佳波长用于偏最小二乘判别分析, 结果表明该方法适用性好, 对不同奶粉样品均有不错的检测能力, 检测限为0.5%。
其他光谱技术在三聚氰胺的检测中也有广泛应用。 Hwang等[32]用太赫兹(Tera Hertz, THz)光谱技术测定三聚氰胺的特征吸收峰, 并用固态密度泛函理论分析三聚氰胺分子的振动模式。 结果表明THz光谱获得的特征峰是由三聚氰胺分子间振动产生的, 该研究可作为检测三聚氰胺分子结构的可靠工具。 Sun等[33]基于THz光谱建立了快速无损检测奶粉中三聚氰胺的方法, 选择2.04和2.34 THz的两个吸收峰, 采用多元线性回归(multiple linear regression, MLR)模型与基于全谱的PLSR模型进行对比, 结果显示MLR模型回归效果较好, 决定系数R2为0.97, RMSEP为1.38%。
Gü rkan[34]等结合火焰原子吸收光谱法(FAAS), 研究了一种简便、 低成本的超声辅助云点提取法, 用于牛奶样品中三聚氰胺的预浓缩和间接测定。 结果表明三聚氰胺在0.8~130 μ g· L-1范围内具有良好的线性关系, 检测限为0.23 μ g· L-1。
光学数据处理是光谱检测技术中的关键步骤。 食品中的复杂基质会产生光谱干扰, 如拉曼光谱中的基质荧光干扰[35]、 近红外光谱中的散射光干扰[36]等。 需要使用适宜的预处理方法, 对光谱进行基线校正、 误差消除和特征提取, 最后选择最佳的建模方法, 根据实验的不同要求建立分类或回归模型, 才能有效利用光谱检测技术采集到的数据信息[37]。
2.1.1 导数校正
导数校正是对光谱数据求一阶、 二阶至三阶导数, 可有效去除线性背景[38]。 由于导数校正会改变光谱峰形, 且高阶导数校正对光谱噪声特别敏感, 因此常与平滑校正算法结合使用。 Jiang等[60]使用近红外光谱结合多元线性回归模型检测了石榴中的可溶性固形物含量, 结果表明, 使用一阶导数的预处理非常有效。 该方法基于一阶导数和竞争自适应重加权采样偏最小二乘模型的性能实现了验证集0.29%和预测集0.31%的均方根误差。
2.1.2 散射校正
多元散射校正(multiplicative scatter correction, MSC)和标准正态变量变换(standard normal variate transformation, SNV)是光谱预处理中使用最广泛的散射校正方法。 MSC将所有光谱样品的平均光谱作为标准光谱, 对每个样品的光谱进行线性回归, 得到平移量和偏移量, 最后消除基线平移和偏移, 得到校正后的光谱[39]。 有报道用近红光谱检测奶粉中的三聚氰胺, 对获得的原始光谱进行MSC和标准化处理, 提取自相关谱, 结合偏最小二乘模型, 识别准确率达到100%。
SNV主要用于消除待测物固体颗粒大小、 表面散射以及光程变化对光谱的影响[40]。 Raphael等[41]的研究中, 使用Savitzky-Golay (S-G)平滑滤波和SNV处理了三种市售近红外光谱仪采集到到的三聚氰胺光谱, 并构建了PLSR校准模型。 三种近红外光谱仪均获得了不错的检测效果, RMSEP分别为0.28%, 0.33%和0.27%。
2.1.3 平滑校正
Savitzky-Golay平滑滤波和高斯平滑滤波(Gaussian smoothing filter, GSF)是常用的光谱平滑校正方法。 S-G平滑滤波可以提高光谱的平滑性, 降低噪音的干扰。 其原理是将光谱分为数个窗口, 在每个窗口内使用最小二乘法进行多项式拟合[42]。 Dhakal等[30]采用S-G平滑滤波对奶粉中污染物的拉曼光谱成像结果进行降噪, 图像二值化处理后每个分量的像素数与实际样本浓度呈线性相关, 相关系数为0.99。 结果表明, 该方法可用于同时识别不同成分, 并估计其浓度以进行身份验证或定量检查。 Liu等[43]用一阶导数数结合S-G平滑滤波, 对鱼粉中的三聚氰胺近红外光谱检测结果进行了处理, 有效消除了散射光和颗粒粒径的干扰。 对于三聚氰胺浓度高于136.36 mg· kg-1的样品, 检出准确率达100%。
高斯平滑滤波(Gaussian smoothing filter, GSF)是一种图像降噪处理方法, 常用于高光谱成像。 其原理是将图像中的每一个点都与附近的像素点进行加权平均, 使用高斯窗口内的加权平均灰度值代替窗口中心像素点的光谱信息[42]。 Huang等[61]使用多种光谱预处理方法结合近红外光谱检测了蜂蜜中的淀粉酶活性, 结果表明高斯滤波结合标准正态变量变换预处理和最小二乘向量机模型获得了最佳的预测结果, R2为0.887 2, RMSEP为0.212 9。
2.1.4 基线校正
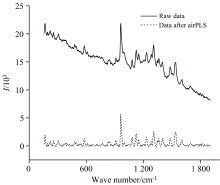
基线校正的早期研究常使用手动多项式拟合去除基线, 因需要较大工作量, 且校正结果包含较多主观因素, 目前多使用自动多项式拟合法。 自适应迭代惩罚最小二乘法(adaptive iteratively reweighted penalized least squares, airPLS)是目前应用最广、 效果最好的基线校正方法。 在airPLS中, 采用基于误差的迭代加权策略, 每一个点的权重根据上一次循环拟合的基线和原始信号之间的差异进行更新[44]。 宗婧等[45]借助拉曼高光谱成像技术, 结合airPLS扣除拉曼光谱的背景信息, 获得了乳粉掺杂物的可视化图像, 识别率为93.3%。 airPLS扣除背景后的光谱与原始光谱的对比如图3, 可以看出该方法在完整扣除了基线的情况下较好的保留了原始光谱的峰形特征。
2.1.5 归一化
归一化是一种简化计算方式, 将有量纲数据集进行变换, 转化为无量纲的数据集。 该方法在色谱和光谱图像校正方面均有应用[46]。 在Fu等[29]的研究中, 使用平均中心化方法对三聚氰胺的近红外高光谱数据进行处理, 将响应强度50~100范围内的光谱曲线映射到了-2~1.5的区域内, 使同类波形相似性更强, 对后续的光谱相似性分析提供了帮助。 所涉及的光谱数据预处理方法见表1。
| 表1 光谱预处理方法 Table 1 Main spectral pretreatment methods |
2.2.1 回归模型
回归模型包括线性回归模型和非线性回归模型。 对于光谱特征明显的样品, 待检对象与光谱的特征区段具有明显的线性相关关系, 使用线性回归模型拟合的效果较好。 大部分情况下, 使用线性模型已经可以较好地完成三聚氰胺的定量检测任务。 对于光谱中包含了较多基质效应的检测结果, 待检物与光谱特征区段的线性关系较弱, 可以采用非线性回归模型进行分析。 非线性回归模型包括支持向量机模型、 神经网络模型等, 多属于黑盒模型, 对光谱的解释能力不强, 但对数据具有潜在特征敏感, 适应范围广。
一元线性回归[50]是仅含有一个自变量的回归模型。 在光谱数据中, 待测物往往存在一个显著的特征峰, 以该特征峰的响应值与待测物浓度进行一元线性回归建模, 是使用最广泛的回归建模方法。 这种方法可有效避免食品复杂基质的光谱峰对分析物特征峰的影响, 但对光谱的利用效率较低, 易造成大量信息遗失。
多元线性回归选择多个特征峰数据作为自变量, 对于含有多个特征峰的待测物定量分析有明显优势[51, 52]。 但多元线性回归要求各自变量间相互独立, 在实际应用中往往无法满足这一要求, 因此具有一定局限性。
主成分分析回归是先提取光谱数据的特征, 然后选择少数几个解释性强的主成分进行多元回归分析[53]。 与多元线性回归相比, 避免了多元共线性问题, 能更好地利用全谱的光谱特征。
PLSR是一种多堆垛的线性回归建模方法, 集中了主成分分析、 典型相关性分析和线性回归分析的特点。 当变量特别多又具有相关性, 同时可观测的样本量较少时, PLSR是最佳的回归分析方法[54]。
支持向量机回归模型(support vector machine regression, SVMR)是典型的非线性回归模型, 其基本思想是优化回归曲线与数据最外侧超平面的距离间隔。 在模型迭代时, 处于临界超平面上或超平面外的数据会对模型回归产生影响, 而其他数据则不产生权重, 与基于最小二乘法的回归模型具有很大不同。 另一方面, 支持向量机回归模型可以通过不同的核函数来拟合不同的回归曲线, 如二次多项式、 三次多项式等。 Li等基于表面增强拉曼光谱法对比了PLSR和SVM模型对牛奶中三聚氰胺浓度的预测能力, 结果表明SVM模型表现出更好的预测性能, RMSEP为1.963 6%, 决定系数R2=0.973 6[57]。 所涉及的三聚氰胺定量回归模型汇总见表2。
| 表2 三聚氰胺定量回归模型 Table 2 Melamine quantification regression model |
2.2.2 分类模型
分层聚类是对给定的数据集合进行层次分解, 包括凝聚分层和分裂分层两种聚类方法[55]。 通过分层聚类分析, 可发现各类间的层次关系, 但计算较为复杂, 易发生链状聚类。
支持向量机模型(support vector machine, SVM)是目前使用最广泛的分类器, 旨在通过求出n维空间的最优超平面进行分类。 当数据量过大时, SVM算法运行速度较慢, 对于有极大数据维度的光谱数据, 需要先借助特征提取算法进行降维。
一类偏最小二乘(one class partial least-square, OCPLS)模型[23]用于描述预测对象被接受或拒绝程度问题, 属于一类分类器, 对非训练集样本比多类分类器具有更好的识别率。 在乳制品掺假问题中, 使用一类分类器还能辨别出除三聚氰胺以外的掺假情况, 如尿素、 双氰胺等, 具有较好的适用性。
人工神经网络是模拟神经元处理信息的一种数学模型。 神经网络包含多个层次, 同一层次间的数据不互通, 而不同层之间的数据可以正向或反向传播, 相邻层之间的神经元相互联接构成网络[58]。 人工神经网络分类算法是有监督分类器, 近年来发展迅速, 主要包括反向传播神经网络、 广义回归神经网络、 径向基函数神经网络和卷积神经网络等。 所涉及的三聚氰胺光谱分配建模方法及测试结果见表3。
| 表3 三聚氰胺检测分类模型 Table 3 Classification model for melamine detection |
随着食品种类的不断增多, 食品安全存在的风险和隐患更多。 综述了近十年拉曼光谱、 近红外光谱、 荧光光谱和高光谱成像等光谱技术在食品中三聚氰胺检测的应用。 光谱技术的时效性、 无损性和准确性, 提高了食品监管的管控效率和范围, 促进了现场自动化食品质量检测的发展, 在食品三聚氰胺检测中的应用前景十分广泛。
目前食品中三聚氰胺的检测研究大多依赖于实验室, 为了使光谱技术成为常规工具, 未来的研究应集中在降低光谱系统的成本和尺寸, 提高检测效率上, 研发紧凑、 精确和便携式的手持设备, 用于现场检测。 虽然光谱技术各具优势, 但在实际应用过程中还应明确各种方法的适用条件和范围。 对可疑样品中三聚氰胺的痕量检出, 可以选择检测限最低, 灵敏度最高的表面增强拉曼光谱法和近红外光谱法; 对于未知抽检样品的初步筛选, 则推荐使用光谱成像技术, 进样量大, 检测效率高。
光谱数据预处理方法近年来发展迅速。 去噪和基线校正算法的不断完善, 有利于能够更好地剔除干扰信息、 突出特征波形和特征峰。 随着模式识别技术的发展, 光谱数据建模方法也发生了巨大改变, 总体呈现出从一元到多元再到全谱、 从线性到非线性的发展趋势。 未来, 应加强食品光谱数据库的建设, 为模型建立提供数据支持; 开发更加适用于光学数据处理的模式识别方法, 提高算法精度、 效率和适用性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|