作者简介: 李姝洁, 1995年生,云南师范大学物理与电子信息学院硕士研究生 e-mail: 1052018463@qq.com
种子的萌发是种子生命历程中的主要组成部分之一, 了解种子萌发过程中经历的生理生化变化, 准确确定种子的活力, 对农业生产很重要, 因而, 研究种子萌发有重要意义。 采用傅里叶变换红外光谱结合曲线拟合研究不同萌发程度的水稻种子, 以探寻种子贮藏物质动员情况, 对不同萌发时间的水稻种子进行傅里叶变换红外光谱、 二阶导数光谱、 二维相关红外光谱和曲线拟合研究。 结果显示, 原始红外光谱整体相似, 光谱反映出水稻种子的主要贮藏物质为淀粉、 蛋白质和脂肪; 吸收峰强度比 A1 659 /A1 019, A1 740 /A1 019, A1 157 /A1 019, A1 157 /A1 081随萌发时间的增加而降低。 814~1 000和1 028~1 340 cm-1范围内的二维相关红外光谱结果显示自动峰个数和最强自动峰的位置、 强度随种子萌发时间的增加而变化, 表明种子在萌发过程中糖类和蛋白质发生变化。 二阶导数光谱在1 200~950 cm-1范围内出现七个峰, 其中988 cm-1处的峰随萌发时间的增加向较高波数蓝移, 而1 053和1 158 cm-1处的峰向较低波数红移, 表明水稻种子在萌发过程中多糖的结构和含量可能发生了变化; 在1 700~1 600 cm-1范围内出现九个峰, 其中1 641和1 692 cm-1处的峰呈现随萌发时间的增加红移到较低波数的趋势, 表明水稻种子在萌发过程中蛋白质的结构和含量可能发生了变化; 在1 800~1 700 cm-1范围二阶导数光谱仅观察到1 712和1 744 cm-1处的两个峰, 其中1 744 cm-1由脂类物质C=O伸缩振动引起, 为脂肪的特征峰。 为进一步研究水稻种子萌发过程中贮藏物质的具体变化, 以二阶导数光谱确定的子峰位置和数目为依据, 对原始红外光谱的1 200~950与1 800~1 600 cm-1区域进行曲线拟合分析。 曲线拟合结果显示, 随萌发时间的增加, 多糖和蛋白质的相对含量总体上呈现下降趋势, 脂肪的相对含量先降后升。 研究表明, 傅里叶变换红外光谱结合曲线拟合可作为研究种子萌发的有效手段。
Seed germination is one of the main components of the seed life course. Agricultural production needs to understand the physiological and biochemical changes in seed germination and accurately determine the vigor of seeds. Therefore, it is of great significance to study seed germination. In order to explore the mobilization of storage materials during seed germination, Fourier transforms infrared spectroscopy (FTIR) combined with curve fitting was used to study rice seeds with different germination days. The rice seeds with different germination times were studied by original infrared spectra, second derivative spectra, two-dimensional correlation infrared spectra and curve fitting. The results showed that the original infrared spectra were overall similar. The spectra reflected that the main storage substances of rice seeds were starch, protein and fat. The absorption peak intensity ratios of A1 659 /A1 019, A1 740 /A1 019, A1 157 /A1 019 and A1 157 /A1 081 decreased with germination time. The results of two-dimensional correlation infrared spectroscopy in the range of 814~1 000 and 1 028~1 340 cm-1 showed that the number of auto-peaks, and the position and intensity of the strongest auto-peaks changed with the increase of seed germination time, indicating that carbohydrate and protein changed during seed germination. The second derivative spectra showed seven peaks in the range of 1 200~950 cm-1. The 988 cm-1 peaks shifted to the higher wavenumber with the increase in germination time, while the peaks at 1 053 and 1 158 cm-1 were shifted to a lower wavenumber, which indicated that the structure and content of polysaccharides in rice seeds changed during germination. Nine peaks appeared in the range of 1 700~1 600 cm-1, among which the peaks at 1 641 and 1 692 cm-1 moved to lower wavenumber with the increase in germination time, indicating that the protein structure and content of rice seeds may have changed during germination. In the range of 1 800~1 700 cm-1, only two peaks at 1 712 and 1 744 cm-1. There are observed in the second derivative spectra, which 1 744 cm-1 is caused by the C=O stretching vibration of the lipid substance. In order to further explore the specific changes of storage substances during the germination of rice seeds, curve fitting analysis was carried out in the regions of 1 200~950 and 1 800~1 600 cm-1 of original infrared spectra based on the location and number of sub-peaks determined by the second derivative spectra. The curve fitting results showed that with the increase of germination time, the relative polysaccharide and protein content showed a downward trend, while the relative content of fat first decreased and then increased. The results show that FTIR combined with curve fitting can be an effective method for seed germination study.
水稻是世界的三大粮食作物之一, 超过一半的世界人口以大米为主食[1]。 世界上有一百多个国家种植水稻, 每年全世界种植的水稻超过7亿吨, 中国的水稻产量占世界总产量的四分之一以上[2]。 水稻种子是重要的农业生产资料, 其萌发特性可以直接影响到水稻的产量。 萌发是水稻生产的第一步, 良好的种子萌发是幼苗形态建成的关键基础[3]。
种子萌发是指种子从生命活动相对静止状态转化为生理代谢旺盛状态发育成新个体的过程, 在形态上表现为胚根、 胚芽突破种皮并向外生长[4]。 种子萌发过程一般分为三个阶段, 第一阶段开始吸水, 水分代谢、 呼吸代谢开始, 酶的活化与合成; 第二阶段吸水滞缓, 贮藏物质动员, 胚细胞迅速生长至一定阶段, 胚根突破种皮; 第三阶段重新开始大量吸水, 胚细胞加速分裂和分化, 胚根和胚芽伸出种皮发育到一定程度。 在这个过程中会发生一系列生化变化, 包括酶的活化与胚乳和种皮的破裂, 细胞溶质的渗漏, 细胞器、 膜和DNA的修复, 以及DNA、 RNA和蛋白质的合成[5]。 种子从发育的成熟阶段便开始大量积累淀粉、 蛋白质和脂肪等贮藏营养物质。 在种子萌发时, 糊粉层受赤霉素诱导产生淀粉酶和蛋白酶, 淀粉被水解酶分解为可溶性的葡萄糖和麦芽糖, 降解后的淀粉被盾片吸收, 然后合成蔗糖并运送到胚胎或幼苗中进行生长发育, 在玉米种子萌发过程中发现蔗糖明显由盾片向胚轴输出[6]; 蛋白质被蛋白酶水解为氨基酸, 分解产生的氨基酸可用于合成新的蛋白质, 或脱氨后为呼吸氧化提供碳链[4]; 脂肪先被脂肪酶水解为甘油和脂肪酸, 随后分别经过氧化、 三羧酸循环、 乙醛酸循环和糖酵解最终被转化为葡萄糖和蔗糖, 输送到生长部位, 为新器官和组织的合成提供必需的营养物质和能量。 Han等[7]采用气相色谱与质谱联用技术对小麦种子萌发过程中胚和胚乳进行代谢组学比较分析, 研究发现胚动员主要蛋白质和脂质代谢, 而胚乳动员贮藏淀粉和次要蛋白质代谢。 Zhou等[8]对苦荞麦种子萌发过程中营养成分的变化及其抗氧化活性研究发现, 发芽种子中总蛋白和总糖含量的下降分别伴随着氨基酸和还原糖含量的增加, 维生素C和B1降低, 维生素B2和B6含量变化不大, 脂肪酸含量随发芽时间的变化趋势无规律性。 用气相色谱法、 质谱法、 化学测定等方法研究种子萌发中营养物质动员, 这些方法需要复杂的化学提取和分离过程, 操作繁琐, 周期较长。 因此选择一种可靠、 简便、 快速、 无损的方法来研究贮藏物质在种子萌发过程中的变化是一个迫切的需要。
傅里叶变换红外光谱(FTIR)是一种基于化合物中官能团和极性键振动的结构分析技术, 具有快速、 低成本等特点, 是获取分子结构信息的有力工具, 已广泛应用于生物、 化学、 医学等多个研究领域。 FTIR也应用于种子研究, Gordon等[9]利用中红外光谱与化学计量学相结合的方法, 鉴定了不同地区(如降雨量、 温度和阳光的不同)大麦的光谱差异。 Juliá n de la Rosa-Millá na等[10]用傅里叶变换红外光谱研究去皮、 发芽和挤压对黑豆理化特性、 蛋白质和淀粉消化特性影响。 在此用傅里叶变换红外光谱法结合曲线拟合研究萌发水稻种子, 分析未处理、 萌发2, 4, 6, 8, 10, 12和14 d的水稻种子的原始、 二阶、 二维红外光谱, 对多糖、 蛋白质和脂肪的特征带进行曲线拟合, 通过特征带的峰面积百分比分析贮藏物质的动用情况。
实验所用的水稻种子为楚粳29号, 购买于云南省陆良县种子公司。 选取大小均匀、 颗粒饱满的水稻种子, 按一定间隔均匀放于铺有两层湿润发芽纸的发芽盒中进行发芽试验。 每盒24粒, 每个处理重复3次。 然后将发芽盒移至25 ℃的智能恒温光照培养箱中, 保持水分充足, 分别培养2, 4, 6, 8, 10, 12和14 d, 光照设置为12 h光照, 12 h黑暗。 每天查看发芽情况, 每隔两天取出一组, 干燥待测。
将样品放于玛瑙研钵中研磨成细粉, 与适量溴化钾混合研磨后压片, 测试光谱。 光谱仪为美国Perkin Elmer公司生产的Frontier型傅里叶变换红外光谱仪, 配备DTGS探测器。 分别对未处理、 发芽2, 4, 6, 8, 10, 12和14 d的水稻种子各采集15个样本光谱, 所得光谱均为扣除溴化钾背景的光谱。 光谱范围为4 000~400 cm-1, 分辨率为4 cm-1, 扫描次数16次。 用EUROTHERM公司生产的SYD-TC-01型的温控仪进行热扰动, 以2 ℃· min-1的速度加热, 光谱采集温度范围为50~120 ℃, 每隔10 ℃进行一次采集。
利用红外分析软件OMNIC8.2对光谱进行基线校正、 5点平滑、 归一化等预处理; 用Savitsky-Golay方法对光谱进行二阶导数处理; 利用Origin9进行光谱处理及曲线拟合, 对红外光谱的多糖、 蛋白质、 脂肪的选定区域特定带进行拟合, 计算子峰面积占比。
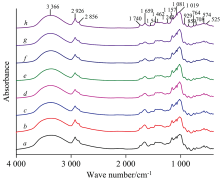
不同萌发天数水稻种子的原始红外光谱如图1所示, 图中所示的各光谱均为10个样本光谱的平均谱图。 在3 366 cm-1附近显示出强宽峰, 在2 926, 1 659, 1 157, 1 081, 1 019和859 cm-1附近显示出强峰, 在2 856, 1 740, 1 541, 1 462, 1 242, 929, 764, 708, 574和525 cm-1附近显示出弱峰。 3 366 cm-1左右归属于糖类的O—H和蛋白质的N—H伸缩振动; 2 926 cm-1归属于CH2不对称伸缩振动; 2 856 cm-1归属于CH2对称伸缩振动[11]; 1 740 cm-1归属于脂类物质的C=O伸缩振动; 1 659 cm-1归属于淀粉的O—H弯曲振动[12]和蛋白质酰胺Ⅰ 带[11]; 1 541 cm-1附近归属于蛋白质酰胺Ⅱ 带[11]; 1 500~1 200 cm-1为蛋白质、 脂质及多糖的混合振动吸收区, 1 462 cm-1左右归属于芳香骨架的C—O弯曲振动, 1 242 cm-1归属于酰胺Ⅲ 和C—O伸缩振动[11]; 1 200~900 cm-1范围为多糖和糖苷的C—O基团的伸缩振动区, 1 157 cm-1归属于糖苷键C—O—C伸缩振动[11], 1 081 cm-1左右归属于C—H键的弯曲振动[12], 1 019 cm-1左右归属于C—O键的伸缩振动和C—OH弯曲振动[12]; 950~750 cm-1为糖类异构体的吸收区, 929 cm-1归属于淀粉α -1, 4糖苷键(C—O—C)的骨架振动[12], 859 cm-1附近的弱峰分别归属于淀粉的非对称环模式振动和CH2摇摆振动[13]; 764 cm-1归属于淀粉的C—C键的伸缩振动[12]; 708 cm-1归属于淀粉的—OH平面外弯曲振动; 574 cm-1对应于淀粉的骨架模式振动; 525 cm-1对应于糖类物质糖苷键或骨架模式的C—O—C平面内弯曲振动。 光谱显示, 水稻种子的主要贮藏营养物质为淀粉、 蛋白质和脂肪。
图2为不同萌发天数水稻种子原始红外光谱的几个特征峰吸收强度比, 各峰强比均来自10个样本光谱的平均谱图。
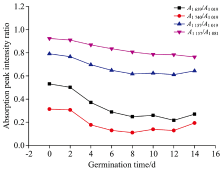 | 图2 不同萌发天数水稻种子红外光谱的特征峰吸收强度比Fig.2 Absorption peak intensity ratios of rice seeds on different germination days |
A1 659/A1 019比值随萌发天数的增加而减小, 表明蛋白质与多糖的相对含量随萌发时间的增加而发生变化; A1 740/A1 019比值随萌发天数的增加而减小, 表明脂肪与多糖的相对含量随萌发时间的增加而发生变化; A1 157/A1 019和A1 157/A1 081的比值随萌发天数的增加而减小, 表明多糖的相对含量随萌发时间的增加而发生变化。
图3为不同萌发天数的水稻种子在814~1 000 cm-1范围内的二维相关红外光谱, 其自动峰情况见表1。 萌发0~8 d水稻种子二维相关红外光谱[图3(a—e)]的所有交叉峰均为正交叉峰; 萌发10 d的水稻种子[图3(f)]在(840, 908 cm-1)处的交叉峰为负, 其余交叉峰为正; 萌发12 d的水稻种子[图3(g)]在(843, 908 cm-1)处的交叉峰为负, 其余交叉峰为正; 萌发14 d的水稻种子[图3(h)]在(834, 884 cm-1)和(834, 908 cm-1)处的交叉峰为负, 其余交叉峰为正。 从图3(a—h)还可看出, 随种子萌发时间的增加, 883 cm-1自动峰强度呈现先增强后减弱的趋势, 834 cm-1自动峰强度先增强后减弱, 950 cm-1处自动峰在萌发6 d后消失, 同时出现了974 cm-1的自动峰。 结果显示, 在814~1 000 cm-1范围内不同萌发天数水稻种子的二维相关红外光谱自动峰个数有一定的变化, 随萌发时间的增加, 最强自动峰的位置从875 cm-1附近变为了974 cm-1附近, 而在901, 875和834 cm-1左右自动峰强度和位置均发生明显变化, 这些变化可能与种子在萌发过程中糖类物质的动员有关。
| 表1 不同萌发时间水稻种子在814~1 000 cm-1范围内二维相关红外光谱的自动峰情况 Table 1 Auto-peaks of two-dimensional correlation infrared spectra of rice seeds at different germination times in the range of 814~1 000 cm-1 |
图4为不同萌发天数的水稻种子在1 028~1 340 cm-1范围内的二维相关红外光谱, 其自动峰情况见表2。 从图4可看出, 所有自动峰的交叉峰均为正交叉峰。 在萌发6 d前, 最强自动峰的位置由1 229 cm-1逐渐变为1 067 cm-1, 且强度发生变化; 在种子萌发6~14 d中, 最强自动峰位置不变, 但强度发生变化。 随萌发时间的增加, 1 118 cm-1弱自动峰强度先增强后减弱, 最终消失。 结果显示, 在1 028~1 340 cm-1范围内不同萌发天数水稻种子的二维相关红外光谱自动峰个数有一定的变化, 1 067, 1 138和1 198 cm-1处自动峰位置不变但强度有所变化, 而在1 038, 1 098, 1 229和1 259 cm-1左右自动峰强度和位置均发生明显变化, 这些变化可能与种子在萌发过程中糖类、 蛋白质等营养物质的动员有关。
| 表2 不同萌发时间水稻种子在1 028~1 340 cm-1范围内二维相关红外光谱的自动峰情况 Table 2 Auto-peaks of two-dimensional correlation infrared spectra of rice seeds at different germination times in the range of 1 028~1 340 cm-1 |
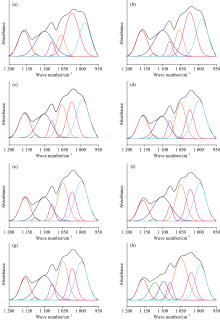
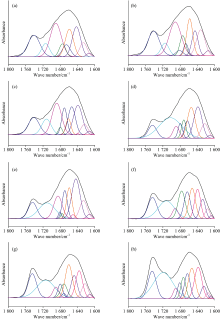
红外光谱的定量分析方法一般分为两种: 一种是测定特征峰的吸收强度, 另一种是测量特征吸收峰的峰面积。 由于峰面积受样品因素和仪器因素的影响比峰强度小, 因此采用峰面积进行定量分析的较多。 二阶导数红外光谱和曲线拟合相结合是进行分峰拟合的有效手段, 由二阶导数光谱确定所取范围内重叠峰的位置和个数, 在此基础上对所选范围的原始红外光谱进行曲线拟合则可将重叠峰一一分开。 水稻种子的光谱在1 200~950和1 800~1 600 cm-1的拟合结果如图5、 图6所示。
 | 图5 水稻种子1 200~950 cm-1范围的二阶导数光谱(a)和曲线拟合图(b)Fig.5 Second derivative spectra (a) and curve fitting spectra (b) of rice seeds in the range of 1 200~950 cm-1 |
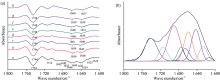 | 图6 水稻种子的红外光谱在1 800~1 600 cm-1范围的二阶导数光谱(a)和曲线拟合图(b)Fig.6 Second derivative spectra (a) and curve fitting spectra of rice seeds (b) in the range of 1 800~1 600 cm-1 |
1 200~950 cm-1区域主要受到多糖和糖苷键C—O基团的伸缩振动, C—O—C键拉伸振动, C—H和C—OH键弯曲振动的影响。 由该区域的二阶导数光谱[图5(a)]观察到水稻种子在多糖范围内出现1 158, 1 123, 1 108, 1 081, 1 053, 1 020和988 cm-1七个峰, 并发现随着种子萌发时间的增加, 988 cm-1峰向较高波数移动, 1 053 cm-1峰向较低波数移动, 1 158 cm-1峰向较低波数移动, 这些峰移明显, 表明水稻种子在萌发过程中多糖的结构和含量可能发生了变化。 1 700~1 600 cm-1是蛋白质的酰胺Ⅰ 区, 主要受到C=O伸缩振动的影响。 该区域的二阶导数光谱[图6(a)]显示出1 612, 1 623, 1 639, 1 641, 1 659, 1 668, 1 673, 1 681和1 692 cm-1九个峰, 其中1 612, 1 623和1 639 cm-1为β -折叠结构, 1 641 cm-1为自由卷曲结构, 1 668, 1 673, 1 681和1 692 cm-1为β -转角结构, 均为蛋白质的二级结构。 随萌发时间的增加, 1 641 cm-1峰向较低波数移动, 1 692 cm-1峰大致向较低波数移动, 表明水稻种子在萌发过程中蛋白质的结构和含量可能发生了变化。 1 800~1 700 cm-1区域的峰主要由脂类物质C=O伸缩振动引起的, 从该区域的二阶导数光谱[图6(a)]观察到1 712和1 744 cm-1两个峰。 依据二阶导数光谱在两个区域确定的吸收峰位置和个数, 对不同萌发程度的水稻种子多糖、 蛋白质和脂肪区域的原始红外光谱进行曲线拟合分析, 拟合谱图见附录图S1和图S2, 并计算出特征峰的峰面积百分比。 经基线校正后, 用高斯分布进行分解, 得到的拟合结果R2值均达0.999以上。
种子的主要营养物质在萌发过程中有明显变化, 采用峰面积百分比来分析它们的含量变化。 分别对每个萌发时间下的8个样本光谱进行曲线拟合, 选取多糖特征峰(1 020, 1 053 cm-1)、 蛋白质特征峰(1 641, 1 692 cm-1)和脂肪特征峰(1 744 cm-1), 计算它们的峰面积百分比, 统计结果如表3所示。
| 表3 水稻种子在不同萌发程度下的特征峰峰面积百分比 Table 3 Percentage of characteristic peak area of rice seeds on different germination days |
未萌发的水稻种子1 020 cm-1特征带的面积百分比为30.46%, 萌发14天后减小到12.10%。 结果表明, 多糖的相对含量在萌发过程中总体上呈现动态减小的趋势, 这与黄国平[14]研究小米的总糖变化趋势一致。 1 053 cm-1峰面积百分比在未萌发水稻种子中为8.89%, 随萌发时间的增加, 该百分比呈现递增的趋势, 最终在萌发14天时达到30.88%。 结果表明, 该特征带可能表示可溶性糖的相对含量变化情况, 可溶性糖的相对含量随萌发时间的增加而上升。 在萌发前期淀粉被活化的淀粉酶水解导致淀粉含量减少, 水解产生可溶性糖(如葡萄糖、 麦芽糖)导致可溶性糖含量增多, 之后水解产物被运输到胚, 提供给新器官生长所需的物质与能量。
1 641 cm-1峰由氨基酸分子中
未萌发水稻种子的脂肪特征带1 744 cm-1峰面积百分比为16.86%, 萌发后0~8 d逐渐下降为9.05%, 随后10~14 d有所增加。 结果表明, 随萌发时间的增加, 水稻种子脂肪的相对含量呈现先减少后增大的趋势。 萌发初期脂肪含量会降低可能是由于萌发初期胚乳代谢尚未开启, 细胞修复不完全, 脂肪外渗所导致的含量下降, 还可能是脂肪被活化的水解酶水解为甘油和脂肪酸, 又经过糖酵解最终转化为葡萄糖和蔗糖而导致的。 而随后脂肪含量的略微增加可能是萌发过程中其他物质转化为脂质用于合成膜脂, 此时主要消耗的能量物质并非脂肪, 因此其含量会有所增加[17]。
综上, 在水稻种子的萌发过程中营养物质的含量和结构发生着显著的变化, 随萌发时间的增加, 多糖和蛋白质的相对含量逐渐减少, 可溶性糖的相对含量逐渐增加, 氨基酸的相对含量先增加后减少, 脂肪的相对含量在0~8 d内逐渐降低, 随后8~14 d内有所增加。
利用傅里叶变换红外光谱结合曲线拟合对萌发水稻种子营养物质的动态变化进行研究, 分别测量了不同萌发时间水稻种子的傅里叶变换红外光谱、 二阶导数红外光谱和二维相关红外光谱。 原始光谱显示, 水稻种子的主要成分为淀粉、 蛋白质和脂肪, A1 659/A1 019, A1 740/A1 019, A1 157/A1 019和A1 157/A1 081的吸收峰强度比随萌发时间的增加而减小。 不同萌发程度水稻种子在814~1 000和1 028~1 340 cm-1的二维相关红外光谱自动峰个数有一定差异, 最强自动峰的位置和强度发生了明显变化。 基于二阶导数红外光谱对1 200~950和1 800~1 600 cm-1区域进行曲线拟合分析并计算相应的特征峰峰面积百分比, 多糖、 蛋白质和脂肪特征峰面积百分比均随萌发时间的增加有显著变化。 以上结果表明, 种子萌发伴随着一系列的水分代谢、 呼吸代谢和贮藏物质代谢, 萌发的水稻种子生理生化特性发生了显著变化。 贮藏物质动用明显, 淀粉、 蛋白质和脂肪在萌发过程中被分解, 淀粉和蛋白质相对含量随萌发时间的增加逐渐下降, 脂肪的相对含量随萌发时间的增加先降低后上升, 表明傅里叶变换红外光谱法是种子萌发的一种可靠、 快速、 简便、 有效的研究手段。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|